烟草乙烯转录因子ERF基因NtTOE3的克隆、载体构建及表达分析
卓 维 陈 倩 罗 银 杨尚谕 鲁黎明 李立芹*
(1.四川农业大学农学院,成都 611130; 2.作物科学国家级实验教学示范中心,成都 611130)
植物在自然生长过程中,会受一些非生物逆境的影响。为了适应环境,体内形成了一个复杂的信号传导网络,可通过激活一些转录因子与顺式作用元的相互作用,产生特定的转录表达以抵抗胁迫。AP2/ERF(PETALA2/Ethylene-responsive factor)超家族是植物中一类特有的转录因子[1],乙烯应答转录因子ERF是AP2/ERF家族的一个亚族,具有AP2/ERF类转录因子所共有的AP2特征结构域,该结构域由60~70个高度保守氨基酸构成[2]。AP2结构域能够识别含有GCC-box或DRE/CRT(C-Repeat/Dehydration-Responsive Element)顺式作用元件基因的启动子,作为反式作用因子调控靶基因表达[3]。研究发现,不同物种的ERF转录因子的数量不同,番茄中有85个[4],黄瓜中有103个[5],甜瓜中有136个ERF家族基因[6]。
ERF作为一种重要的转录因子,对植物的生长发育以及逆境胁迫应答反应有着重要调控作用[7]。并且在辣椒,拟南芥,大豆等植物研究中都有报道。辣椒CaJERF1基因在300 mmol·L-1NaCl和4℃冷处理1~24 h后表达量上调[8];怪柳中16个ThERF基因家族成员在400 mmol·L-1NaCl处理之下表达情况不同,根中10个ThERF成员在3 h都被抑制,后随处理时间增加缓慢上升,24 h迅速下降;茎中有9个ThERF成员被显著诱导[9]。大豆GmERF056和GmERF057在干旱、高盐和ABA处理下均能够被诱导表达,但低温处理后没有显著差异[10]。水稻中过表达OsERF71基因通过参与细胞壁组分的合成,改变根形态提高水稻的干旱耐受性[11]。
本研究从普通烟草K326中克隆到一个乙烯转录因子ERF基因NtTOE3,利用生物信息学分析NtTOE3蛋白相关性质,同时运用qRT-PCR研究其在烟草中的组织表达水平,以及6种非生物逆境胁迫下基因的表达水平,旨在为今后烟草ERF家族关键转录因子的筛选以及其功能的研究奠定基础。
1 材料与方法
1.1 试验材料及试剂
试验植物材料为烟草栽培品种K326(Nicotianatabacumcv.K326),由四川农业大学农学院提供。
大肠杆菌DH5α购自Vazyme Biotech公司;目的基因的克隆及回收使用的Trizol试剂、载体PMD19-T、高保真Pfu酶,cDNA合成试剂盒,SYBR Green Master mix、限制性内切酶、DNA Ligation Kit 2.0等试剂购自TaKaRa,DNA凝胶纯化回收试剂盒购自天根公司;引物合成与测序由上海生工生物工程有限公司完成。
1.2 试验方法
1.2.1 试验材料处理
选取均一饱满的烟草种子进行表面消毒然后布种,消毒方法和配置培养基方法参考张雪薇[12],配置NaCl(200 mmol·L-1)、PEG-6000(5%)、ABA(1 μmol·L-1)、H2O2(10 mmol·L-1)和低钾(10 μmol·L-1K+)培养基。处理相应时间(0、3、6、12、24 h)后进行整株取样,提取RNA后分析NtTOE3在6种非生物逆境胁迫下的表达模式。提取烟草K326幼苗的根、茎、叶以及盛花期的花RNA,反转录为cDNA后分析NtTOE3在各个组织的表达情况。
1.2.2烟草NtTOE3基因的克隆和过表达载体的构建
参考GenBank收录的美花烟草(Nicotianasylvestris)NsTOE3序列(XM_009783708.1),采用同源克隆的方法,用DNAMAN软件设计全长引物NtTOE3-F和NtTOE3-R,带有酶切位点(BamHⅠ和EcoRⅠ)的载体引物NtTOE3-mF和NtTOE3-mR。(表1)。扩增后将纯化的目的片段与pMD19-T载体16℃连接过夜,连接产物转化大肠杆菌DH5α感受态,氨苄青霉素抗筛选阳性克隆,测序鉴定。将重组克隆载体pMD19-T和过表达载体PBI121分别用内切酶BamHⅠ和EcoRⅠ进行双酶切,同上方法转化后用对应抗性筛选阳性克隆,培养后送至上海生工生物工程有限公司进行测序。
1.2.3 烟草NtTOE3蛋白生物信息学分析
利用ExPASyProtParam tool分析NtTOE3蛋白的理化性质;用SOPMA和SWISS-MODEL软件预测蛋白的二、三级结构;用ProtScale,DNAMAN软件分析蛋白的疏水性和结构域;采用PSORT预测NtTOE3的亚细胞定位;运用MEGA5和clustalx-2.0.9软件以邻近法构建系统进化树。
1.2.4 烟草NtTOE3基因的表达分析
根据基因序列,采用Primer Premier 5.0设计qRT-PCR引物NtTOE3-qF和NtTOE3-qR,采用烟草的18SrRNA为内参进行表达差异研究。qRT-PCR反应结束后,用2-ΔΔCt方法进行计算基因相对表达水平(表1)。

表1 引物序列
GGATCC.BamHⅠ; GAATTC.EcoRⅠ
2 结果与分析
2.1 NtTOE3基因克隆
以烟草K326叶片cDNA为模板进行PCR扩增,电泳结果显示在1 000~1 500 bp的位置上有清晰的条带(图1)。将该条带回收纯化后与pMD19-T载体进行连接,转化大肠杆菌DH5α。将鉴定出的阳性克隆随机挑选3个送至测序公司进行测序,测序结果显示:目的片段大小为1 356 bp。后提取质粒用BamHⅠ和EcoRⅠ双酶切验证,酶切后检测目的条带(图2)。
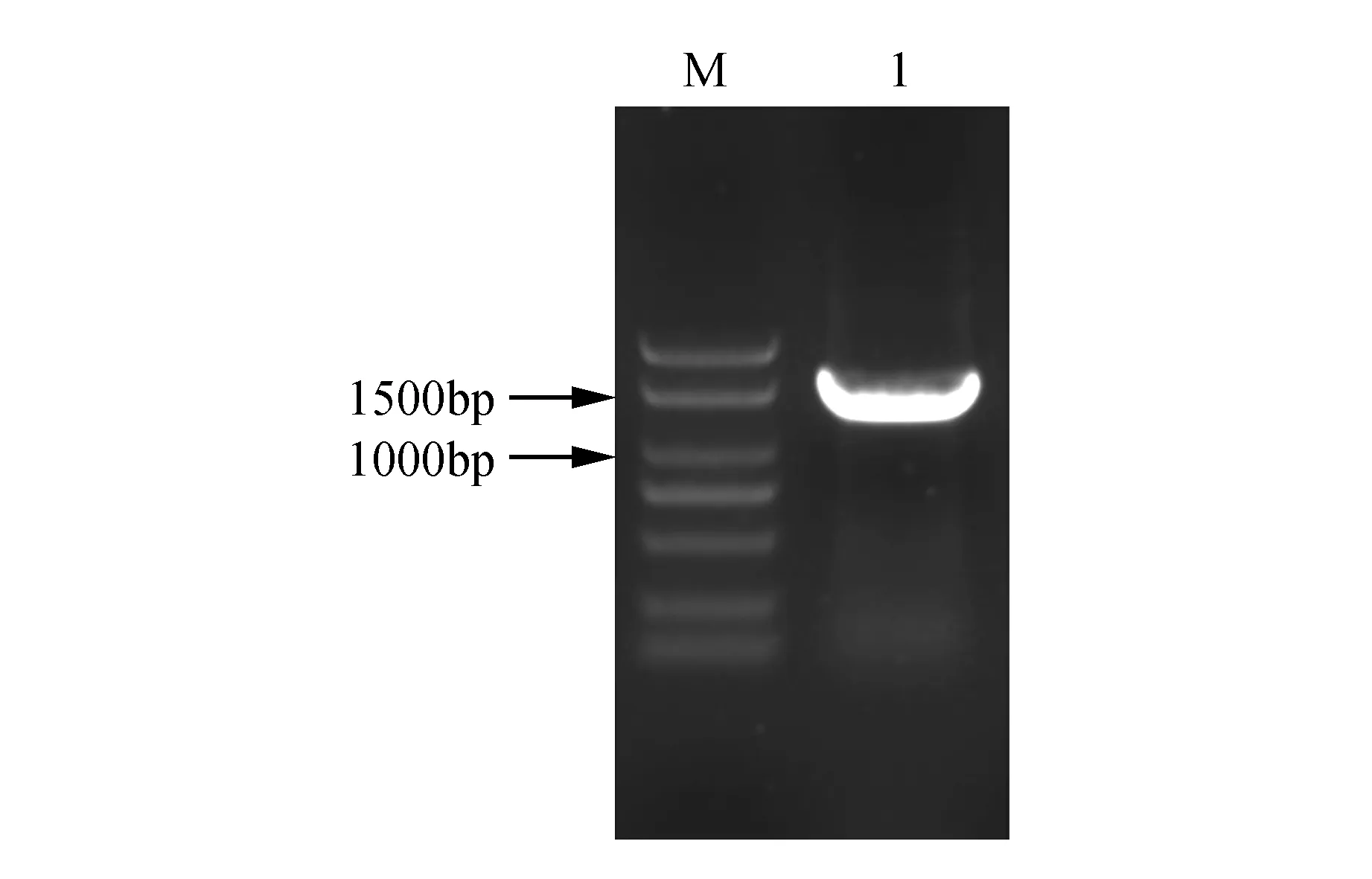
图1 NtTOE3基因的克隆 M. Marker 2 000 bp;1. NtTOE3基因Fig.1 Cloning of NtTOE3 gene M. Marker 2 000 bp; 1. NtTOE3 gene
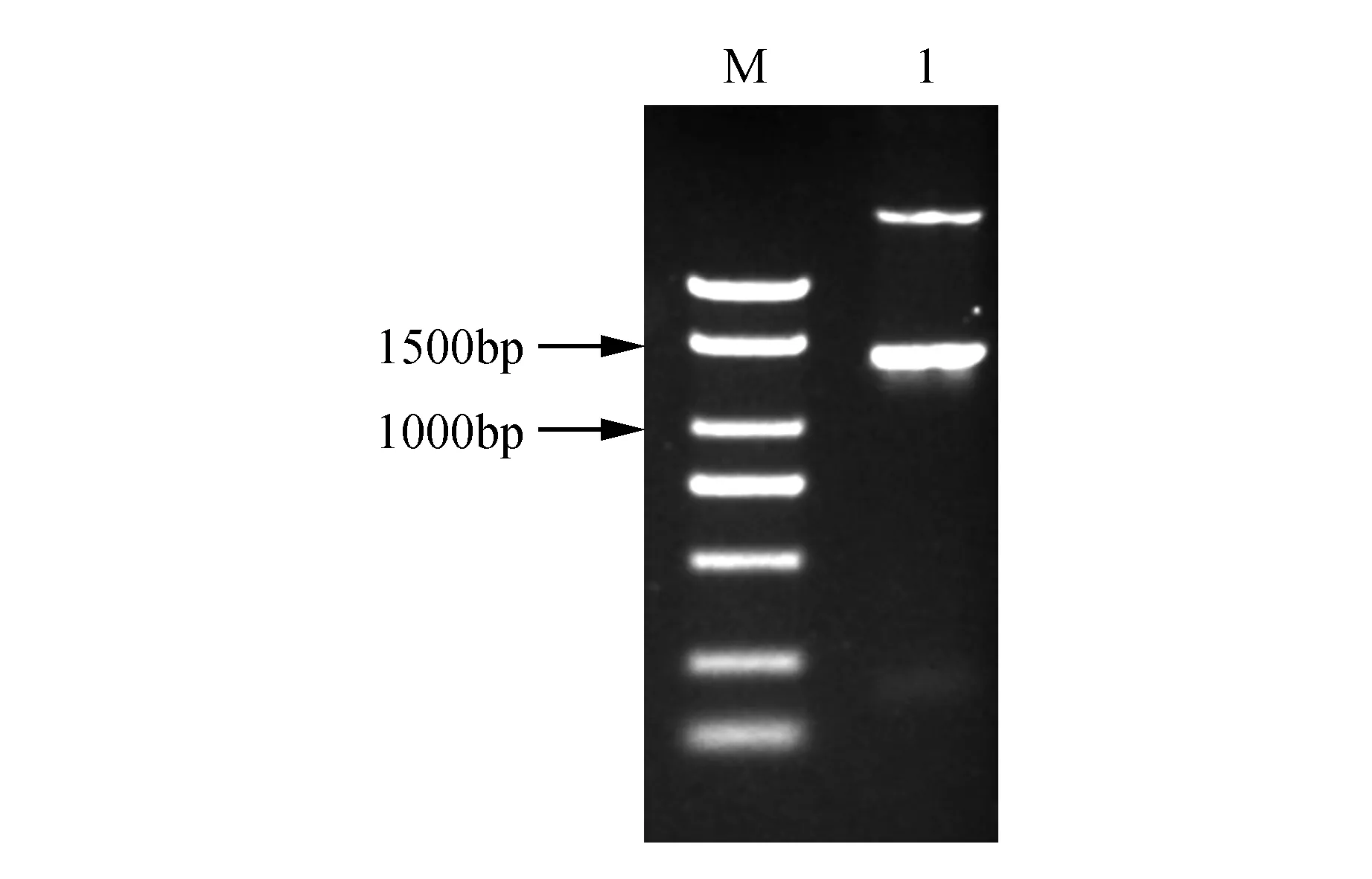
图2 pMD19-NtTOE3重组质粒双酶切条带 M. Marker 2 000 bp;1.NtTOE3基因Fig.2 Digesting of pMD19-NtTOE3 recombinant plasmid M. Marker 2 000 bp; 1. NtTOE3 gene
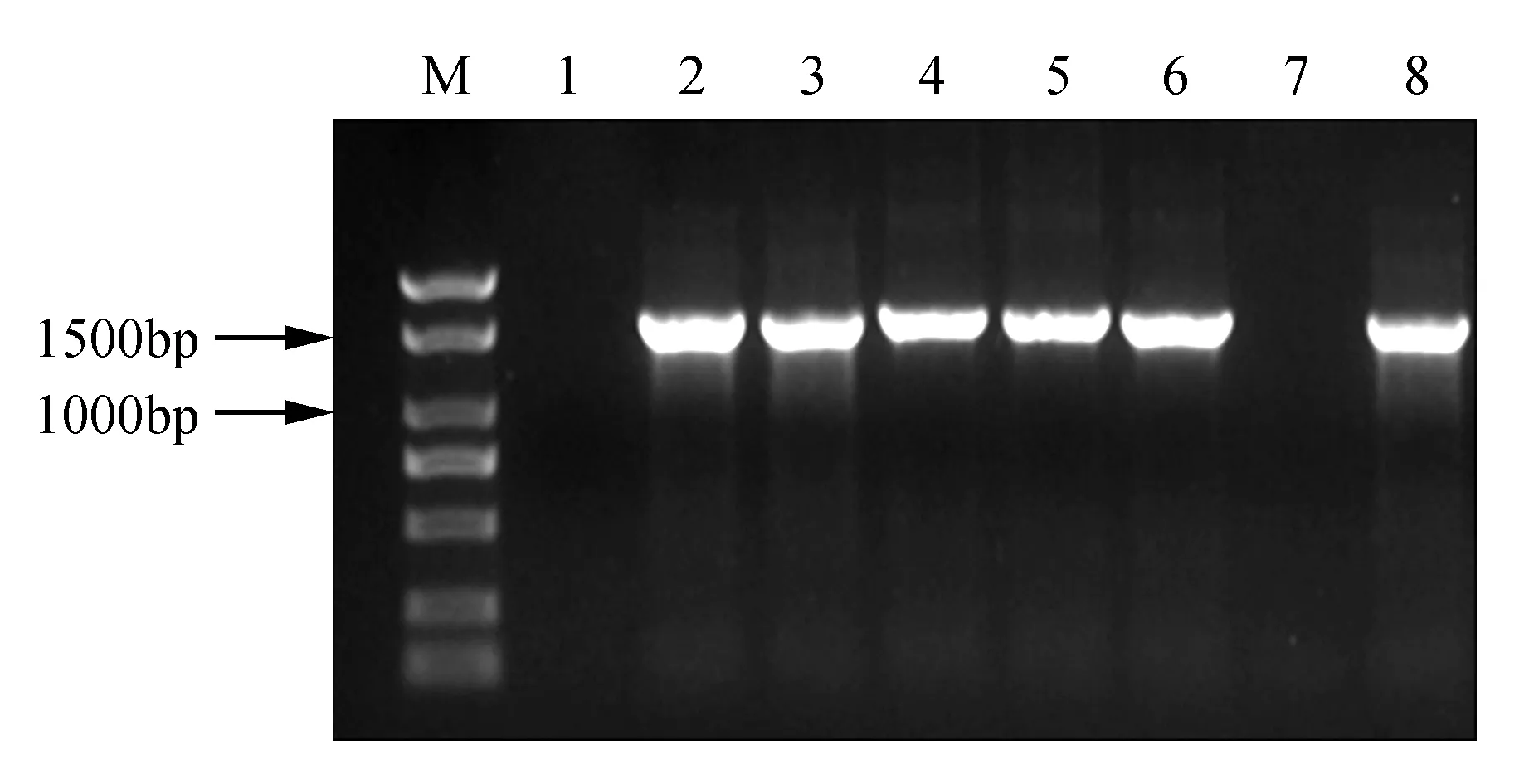
图3 NtTOE3基因阳性克隆PCR扩增电泳图M. Marker 2 000 bp;1~7.NtTOE3基因菌落PCR;8.阳性对照Fig.3 Electrophoresis analysis of NtTOE3 positive clone PCR product M. Marker 2 000 bp; 1-7. NtTOE3 colony PCR product; 8. Positive control
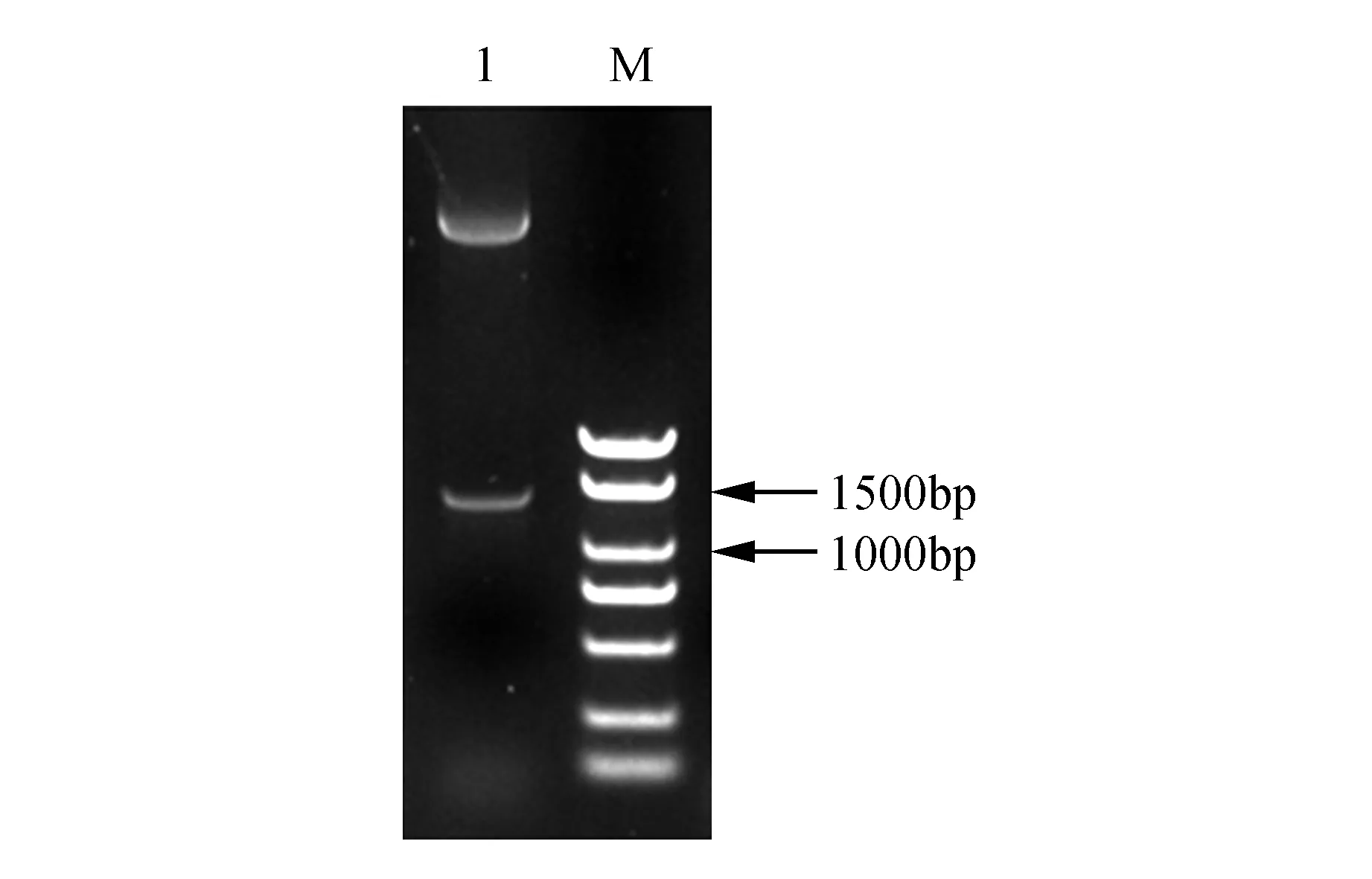
图4 NtTOE3-PBI121重组质粒双酶切条带 M. Marker 2 000 bp;1.NtTOE3基因Fig.4 Digesting of NtTOE3-PBI121 recombinant plasmid M. Marker 2 000 bp; 1. NtTOE3 gene
2.2 NtTOE3-PBI121过表达载体的构建与检测
将NtTOE3基因连接到PBI121载体后,转化大肠杆菌DH5α中,用菌落PCR筛选阳性克隆。结果显示(图3),2~6为阳性克隆。挑选3个阳性克隆送至公司测序,摇菌提取质粒进行双酶切验证,BamHⅠ和EcoRⅠ酶切后检测目的条带(图4)。双酶切和测序结果均表明,NtTOE3已正确插入PBI121载体中,NtTOE3-PBI121过表达载体的构建成功。
2.3 NtTOE3基因的生物信息学分析
2.3.1 NtTOE3编码蛋白的理化性质及疏水性分析
蛋白质理化性质分析显示,NtTOE3基因共编码451个氨基酸,其中丝氨酸Ser(12.2%)含量最高,半胱氨酸Cys(0.7%)含量最低,带负电荷氨基酸(Asp+Glu)51个,带正电荷氨基酸(Arg+Lys)55个。该蛋白预测的分子量为49.84 ku,理论等电点pI为8.70,其亲水性平均指数为-0.783,用在线软件ProtScale进行的疏水性分析(图5),结果预测该蛋白属于亲水性蛋白。
2.3.2 NtTOE3蛋白的二级、三级结构预测
利用SOPMA对NtTOE3编码的蛋白进行二级结构预测发现,该蛋白中52.11%的氨基酸参与无规则卷曲(Random coil),15.74%的氨基酸参与α-螺旋(Alpha helix),22.17%的氨基酸参与延伸链(Extended strand),9.98%的氨基酸参与β-转角(Beta turn),由此可见, 该蛋白二级结构的最大元件为无规则卷曲(图6)。运用SWISS-MODEL对NtTOE3的三级结构进行了预测,RasTop软件进行显示(图7),并将结果与二级结构预测进行比照,结果较为统一。
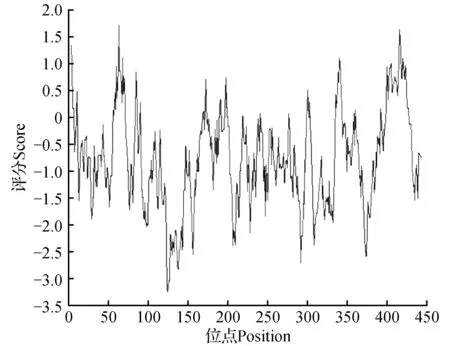
图5 NtTOE3蛋白疏水性分析Fig.5 Hydrophobicity analysis NtTOE3 protein
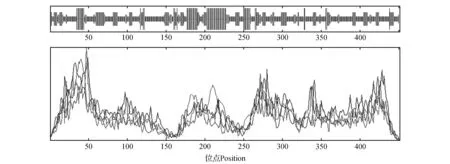
图6 ANtTOE3蛋白的二级结构预测Fig.6 Predicted secondary structure of NtTOE3 protein
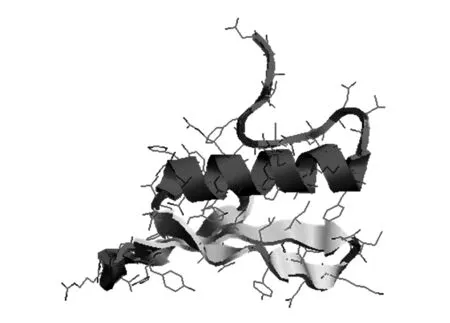
图7 BNtTOE3蛋白的三维结构预测结果Fig.7 The predicted advanced structure of NtTOE3 protein
2.3.3 NtTOE3蛋白的结构域及亚细胞定位分析
利用DNAMAN软件进行NtTOE3与其他5个不同物种的AP2保守结合域序列比对,包括美花烟草NsTOE3、川椒CaTOE3、番茄SlTOE3、苦瓜McTOE3、葡萄VvTOE3,结果显示6种植物的AP2结合域非常保守(图8)。
利用PSORT在线预测NtTOE3的亚细胞定位,结果显示,该蛋白在细胞核上占0.696,在细胞质上占0.174,在细胞骨架中占0.043,在线粒体中占0.043,预测NtTOE3可能定位在细胞核上。
2.3.4 NtTOE3同源性分析
把NtTOE3编码的氨基酸序列在NCBI数据库中进行BLAST比对, 按照相似性程度高低选择美花烟草(Nicotianasylvestris)、烟草(Nicotianaattenuata)、辣椒(Capsicumannuum)、番茄(Solanumlycopersicum)、马铃薯(Solanumtuberosum)、苦瓜(Momordicacharantia)、葡萄(Vitisvinifera)、牵牛花(Ipomoeanil)、麻疯树(Jatrophacurcas)等19个不同物种的TOE3蛋白序列与NtTOE3构建系统进化树(图9)。结果表明:NtTOE3和美花烟草、烟草聚为一支,相似性分别为96%和95%,与结构域比对结果一致;其次是与辣椒、番茄和马铃薯相似性分别为76%、72%和64%;与葡萄、苦瓜相似性最低,分别是56%和55%。

图8 NtTOE3蛋白与5种植物TOE3蛋白的AP2保守结构域分析Fig.8 AP2 conserved domain analysis ofNtTOE3protein and five plant TOE3proteins NsTOE3. Nicotiana sylvestris; CaTOE3. Capsicum annuum; SlTOE3. Solanum lycopersicum; McTOE3. Momordica charantia; VvTOE3. Vitis vinifera
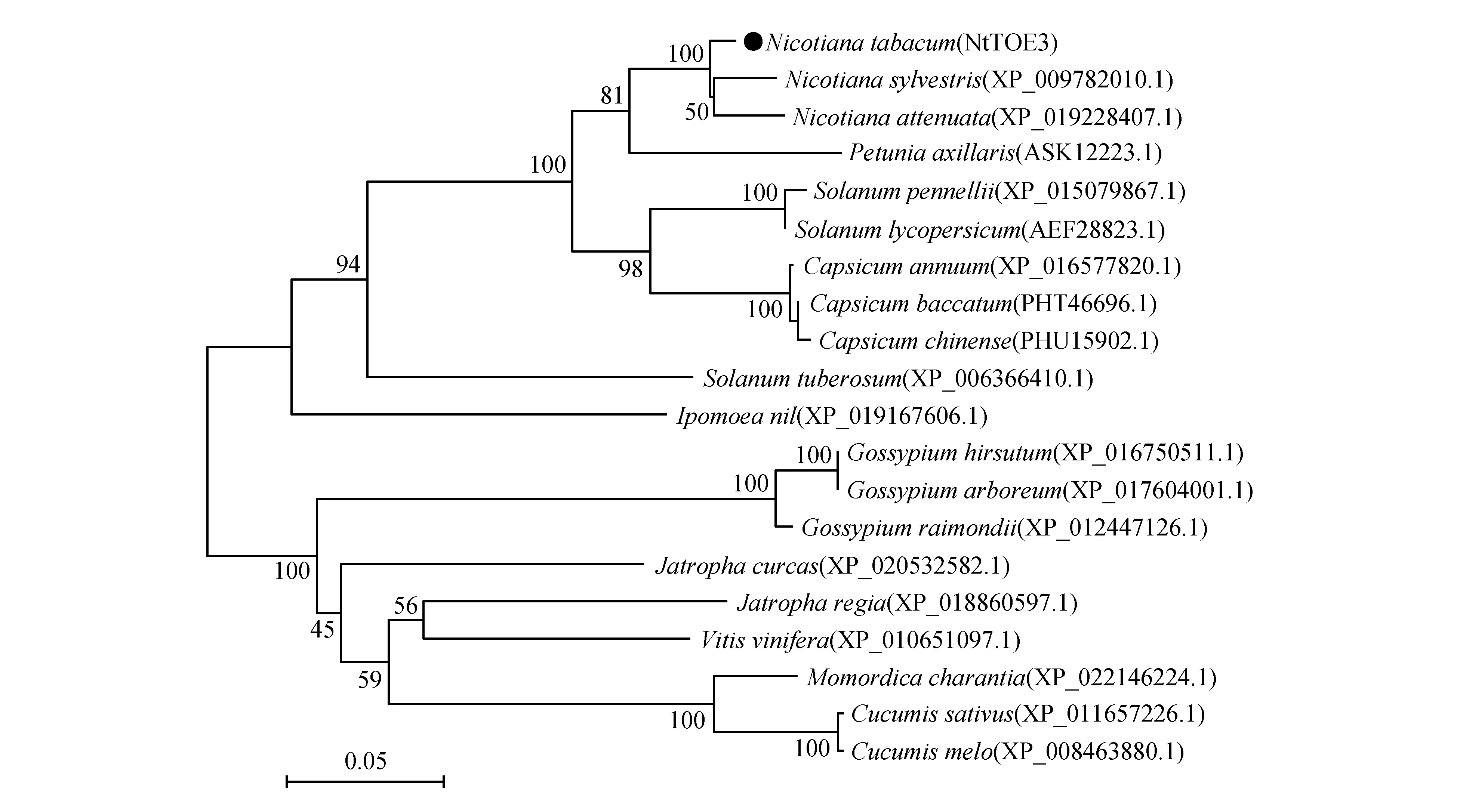
图9 NtTOE3进化树分析Fig.9 The phylogenetic tree analysis of NtTOE3
2.4 NtTOE3的组织表达分析
采用qRT-PCR反应分析NtTOE3的组织表达情况。结果表明,NtTOE3在烟草根、茎、叶、花中均有表达,但主要是在茎和叶中表达,在花中的表达量最低。其中茎中表达量是在叶中的9.41倍,是花中的53.74倍。说明烟草NtTOE3主要在茎中表达(图10)。
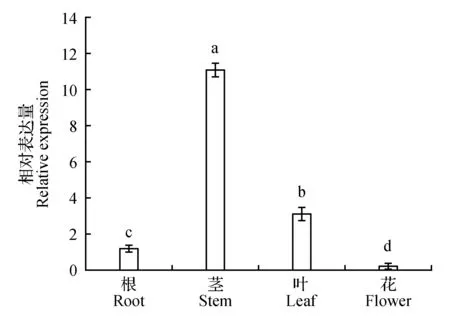
图10 NtTOE3在不同组织中的相对表达量分析Fig.10 Analysis of relative expression of NtTOE3 in different tissues
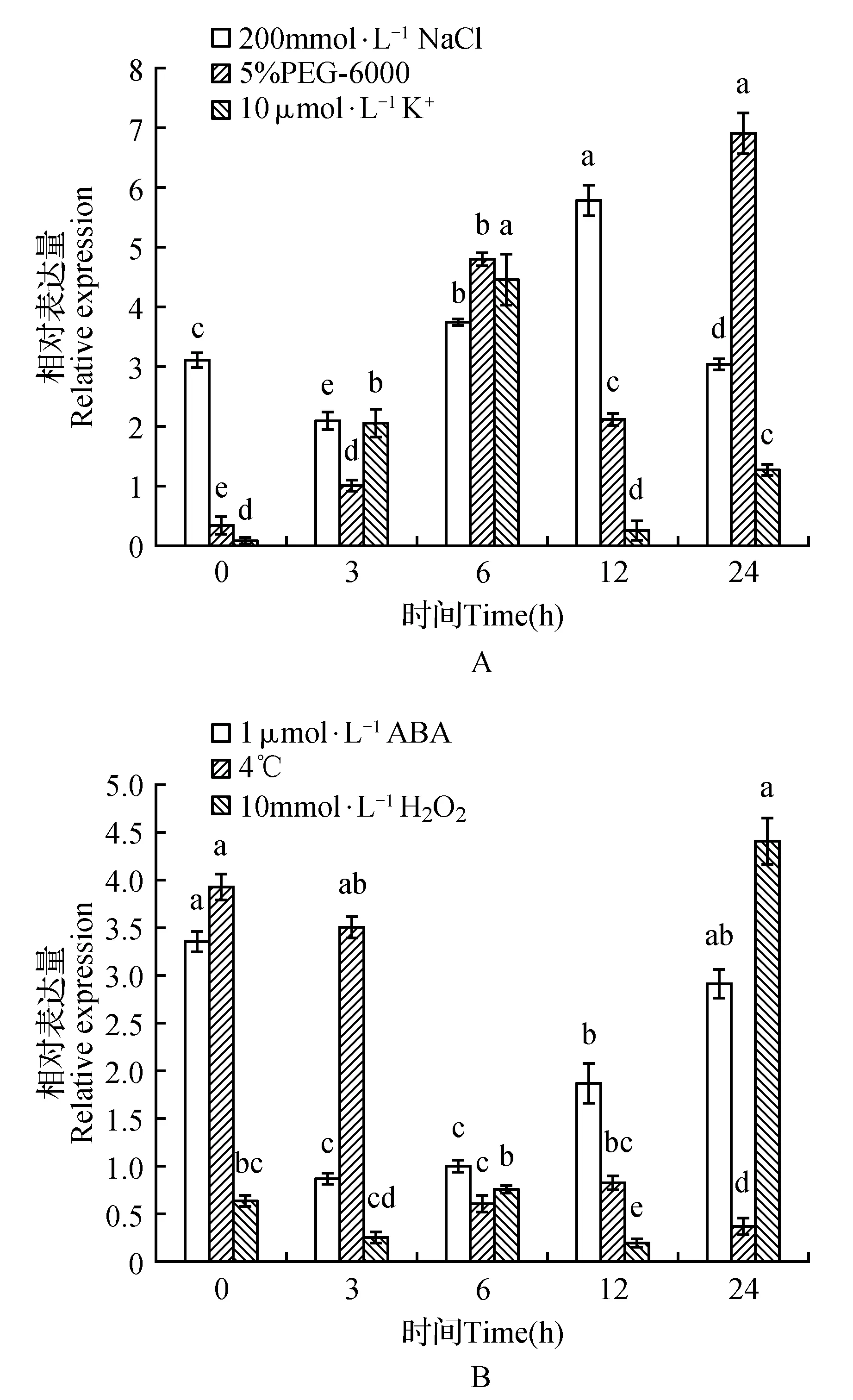
图11 NtTOE3在6种非生物逆境胁迫下处理后的相对表达量Fig.11 Relative expression of NtTOE3 under six kinds of abiotic stress treatment
2.5 6种非生物逆境胁迫下NtTOE3的表达分析
采用qRT-PCR分析NtTOE3在6种处理后的表达情况。高盐(200 mmol·L-1NaCl)处理后,NtTOE3表达量在3~12 h逐渐增加,最高值出现在12 h,为对照(0 h)的1.86倍;在低钾(10 μmol·L-1K+)处理后,该基因表达量在3~6 h逐渐上升,最高值为对照(0 h)的44.36倍,后其表达量下降,但均高于对照(图11A);10 mmol·L-1H2O2和5% PEG-6000处理后,该基因都在24 h达到最大,分别为对照(0 h)的6.81和19.66倍。在1 μmol·L-1ABA和冷处理(4℃)下,NtTOE3表达情况有所不同。1 μmol·L-1ABA处理之后,该基因3 h表达先下降,后随着处理时间增加表达量逐渐增加,24 h与对照无差异。冷处理(4℃)后,该基因逐渐下降,最低为24 h,仅为对照的9.42%(图11B)。实验结果说明,NtTOE3能够响应逆境胁迫,受到NaCl、低钾、PEG-6000和H2O2诱导,也受到4℃和ABA处理抑制。
3 讨论
乙烯转录因子ERF属于植物AP2/ERF转录因子家族,参与细胞发育、激素合成等生理反应,同时在植物抗病、低温、干旱、高盐等逆境信号转导中具有重要作用,该基因在不同植株中的超表达能够提高其抗性,并具有一定的广谱效应[13]。本试验从普通烟草K326中克隆到一个NtTOE3基因,分析发现NtTOE3有由54个氨基酸残基组成的AP2保守结构域,且不同物种之间该结构域保守。同源性比较发现,该蛋白与美花烟草、川椒和番茄TOE3等具有较高同源性。亚细胞定位预测表明NtTOE3可能定位在细胞核中。丹参SmERF1,巴西蕉MaERF25蛋白均定位到细胞核[14~15],烟草中ERF蛋白家族绝大部分成员定位在细胞核,少数定位在线粒体和叶绿体上[16]。
本研究利用qRT-PCR分析NtTOE3在烟草K326不同组织中的表达水平,结果显示该基因在根、茎、叶、花中均有表达,茎中表达量最高,推测TOE3可能参与烟草茎和叶的生长发育以及渗透调节。这与茶树和油菜ERF的组织表达情况不一样,茶树CsERF-B3主要在根中表达,油菜BnaERFB1-2则集中在分生组织[17~18];而大豆GmERF的研究发现,该基因主要分布在叶和根中,同时在茎、花、胚中也有表达[19]。说明不同的ERF家族基因在不同植物中分布不同,其参与植物生长发育的整个时期,且存在组织特异性。
本研究发现,在高盐(200 mmol·L-1NaCl)处理下,NtTOE3表达量最高值出现在12 h,说NtTOE3表达受到高盐诱导。这与杨树48个ERFs在响应盐胁迫下的表达模式相同,处理后ERFs上调的倍数在2~32倍。转杨树ERF76的烟草在盐处理下表现出抗逆境保护分子含量升高,相对电导率和活性氧积累的减少,说明ERF76是一个盐胁迫诱导表达基因[20~21]。在野大豆GsERF的研究发现,NaHCO3盐碱胁迫下,GsERF71通过上调H+-ATPase的表达水平和提高生长素的积累来增强耐受性,从而植株表现出叶片较绿,更长的根长等现象[22]。除此之外,拟南芥中ERF96在100 mmol·L-1NaCl处理下被大量诱导,与盐处理相关的Marker基因如RD29A、P5CS、KIN1等积极响应,与Na+和K+含量以及Na+/K+稳态有关的K+外向整流器SKOR和钾转运AKT2/3上调,说明AtERF96是拟南芥中耐盐性的正调节因子[23]。转番茄SpERF-B7的拟南芥植株在130 mmol·L-1NaCl处理15 d后,其鲜重和根长明显优于野生型,同时该基因受到甘露醇,ABA和乙烯诱导表达,推测SpERF-B7受乙烯/ABA途径影响从而改善耐盐性[24]。
5%PEG-6000模拟干旱处理后,NtTOE3表达量随着处理时间的增加逐渐升高,最高点24 h是对照的19.66倍。这与大豆GmERF7的表达模式一致,在20%PEG-6000处理后显著诱导[25]。其他研究发现,针茅SpERF1可能参与植物脯氨酸合成,通过脯氨酸累积量使细胞具有较好的缓冲能力和膜保护作用[26];而水稻ERF基因则是激活与干旱胁迫相关基因的转录,同时改变水稻根部结构包括调控细胞壁松弛度及木质素生物合成基因直接作用根部结构来提高其耐旱性。ERF基因也可以提高乙烯生物合成调节水稻的抗旱性[27~29]。在拟南芥中过表达ERF1能够提高植株对干旱和盐胁迫的耐受性,在不同盐浓度(100、200、300 mmol·L-1NaCl)处理下,过表达植株的发芽率,存活率,体内ABA和脯氨酸含量明显比野生型高。因为脯氨酸含量的积累程度直接反应了植物在胁迫下的渗透调节能力,脱落酸能够部分调整脯氨酸的积累,这表明ERF1可能通过调节ABA含量和依赖ABA信号传导途径对植株进行调节[30]。
本试验NtTOE3在胁迫条件的表达模式推测该基因面对逆境存在不同的应答机制,可能是由于DNA结合特性不同或者是存在翻译后水平调控,也有可能是与不同蛋白相互作用的结果。所以烟草NtTOE3蛋白在非生物逆境胁迫中发挥的具体作用,尚待进一步研究。今后可构建GFP融合表达蛋白确定其亚细胞定位,构建原核表达载体表达蛋白,通过酵母单杂交实验寻找NtTOE3的下游靶基因,同时过表达载体转化烟草后深入研究NtTOE3基因的功能,为从分子水平阐明NtTOE3蛋白在非生物逆境胁迫中的作用机制提供科学依据。

