YFT1基因突变影响番茄果色和硬度
李 玲 冯学超 赵凌侠,2*
(1.上海交通大学农业与生物学院番茄联合研究中心,上海 200240; 2.上海交通大学植物生物技术研究中心,上海 200240)
番茄(Solanumlycopersicum)是全球第一大经济作物[1],2014年全球产量1.71×1011kg,产值US$ 9.25×1010;我国番茄产量(5.27×1011kg)约占全球1/3(http://www.fao.org/faostat/en/#data/QV/metadata),在国民经济发展和蔬菜供给中占有不可或缺地位。同时,番茄还是植物特别是浆果类遗传、进化、生殖生物学和分子生物学研究的模式植物[2~7]。经过半个多世纪努力,番茄育种家已培育出数以千计的番茄品种,对番茄产量、抗病性及货架期改良取得了长足发展[8~9]。不过,现有番茄特别鲜食番茄已很难满人们日益增长对高品质番茄的要求,给番茄育种家和科学工作者提出了新课题;而番茄品质改良的关键限制因素是种质资源匮乏和基础理论研究薄弱[8]。
番茄果色和硬度是与品质密切相关的重要经济性状,而目前对番茄果色和硬度形成分子机制还知之甚少。作者实验室在解析番茄果色形成机制时,用番茄yft1突变体图位克隆了控制番茄果色形成YFT1基因[10];同时,还发现YFT1也调控果实硬度的形成。基于此,本研究主要比较分析了yft1与野生型(cv.M82)番茄在果色、硬度和解剖结构随果实生育的变化;以期为后续深入解析YFT1调控番茄果色和硬度发育分子机制和基因调控网络,特别是对番茄果色和硬度精准改良提供理论依据。
1 材料方法
1.1 植物材料
番茄种子(cv.M82和yft1)由以色列希伯来大学Dani Zamir教授提供(http://zamir.sgn.cornell.edu/mutateds);种子催芽并露白后播种于深圳山智公司生产的60孔育苗盘(装有湿润育苗土)中,在26/20℃(光/暗)条件下发芽和育苗。待4片真叶展开时,将小苗移栽植于标准聚碳酸酯日光温室中生长(上海交通大学,浦江绿谷农场,上海市闵行区浦江镇),田间管理与普通番茄同。
1.2 番茄果色和硬度检测
分别在35、47和54 dpa时取样,所选定的取样时间点分别对应于cv.M82的绿熟期(Mature Green,MG),转色期(Breaker,BR)和红熟期(Red Ripe,RR)。cv.M82和yft1果实硬度用质构仪(Model TA.XT Plus,SMSTA,UK)带直径6 mm柱形塞(Model SMS P/5)进行分析。用0.3牛顿(newton,N)的起始压力并以100 mm·min-1速度压入11 mm,硬度值取每次测量最大值。每个番茄果实进行5点——果蒂、果顶和赤道面3点(1点/120°)测定,3个生物学重复;并观察并记录不同发育期的番茄果色。
1.3 番茄果皮显微结构
分别在35,47和54 dpa取cv.M82和yft1果皮,切成1~2 mm小块,迅速浸入FAA(Formalin-Acetic Acid,100 mL FAA中含有5 mL 37%甲醛,5 mL冰醋酸,63 mL无水乙醇和27 mL去离子水)固定液中。抽真空更换新鲜FAA,4℃贮存备用。随后,固定番茄果皮样品用浓度梯度乙醇(70%,80%和95%)依次脱水30 min,最后100%乙醇脱水2 h。脱水番茄果皮样品浸入无水乙醇和Technovit 7100树脂试剂盒(Kulzer and Co,Wehrheim,Germany)Basic Liquid配制预渗透液(v∶v=1∶1)中2 h,随后转入渗透液(将Technovit 7100试剂盒的1 g hardener Ⅰ粉末溶于100 mL Basic Liquid)中过夜。渗透处理后的番茄果皮样品进行包埋(包埋剂:1 mL hardener Ⅱ溶于15 mL渗透液中),在60℃恒温箱中烘干48 h。用切片机(LEICA RM2265)将样品切成2~3 μm薄片,用甲苯胺蓝(Toluidine Blue O,TBO)染色,在显微镜(Nikon Eclipse 80i,USA)下观察并拍照。
2 结果分析
2.1 番茄果色和果实硬度随果实发育的变化
在35 dpa时,野生型cv.M82和突变体yellowfruittomato1(yft1)果实均处于绿熟期(MG),果色为绿色,二者间未发现差异。在47和54 dpa时,cv.M82果实分别进入了转色期(BR)和红熟期(RR),果色分别为橙黄/浅红和红色,而yft1的果色与35 dpa时的无明显差异,仍处于绿熟期状态(图1)。说明YFT1突变致使番茄果色发育延迟。
质构仪检测果实硬度结果发现,在cv.M82和yft1中均表现出果蒂处硬度(36.93±3.12N)比果顶(31.03±4.99N)和赤道面(29.79±1.68N)的大;而果顶与赤道面间的果实硬度差异不明显(表1)。cv.M82番茄硬度随果实发育迅速下降,红熟期(RR)54 dpa果实硬度(13.68±1.78N)仅相当于绿熟期(MG)35 dpa(35.51±1.09N)的1/3。而yft1番茄硬度随果实发育(35~47 dpa)变化不明显(表1)。
在35 dpa,cv.M82与yft1果实硬度无显著差异;而进入转色期(47 dpa)后,cv.M82番茄硬度迅速下降,显著低于yft1的,在红熟期(54 dpa),cv.M82番茄硬度(13.68±1.78N)仅相当于yft1(33.79±3.28N)的40%(表1)。该结果暗示YFT1不仅与番茄果色发育有关,还参与番茄果实硬度形成这一重要的生理过程。
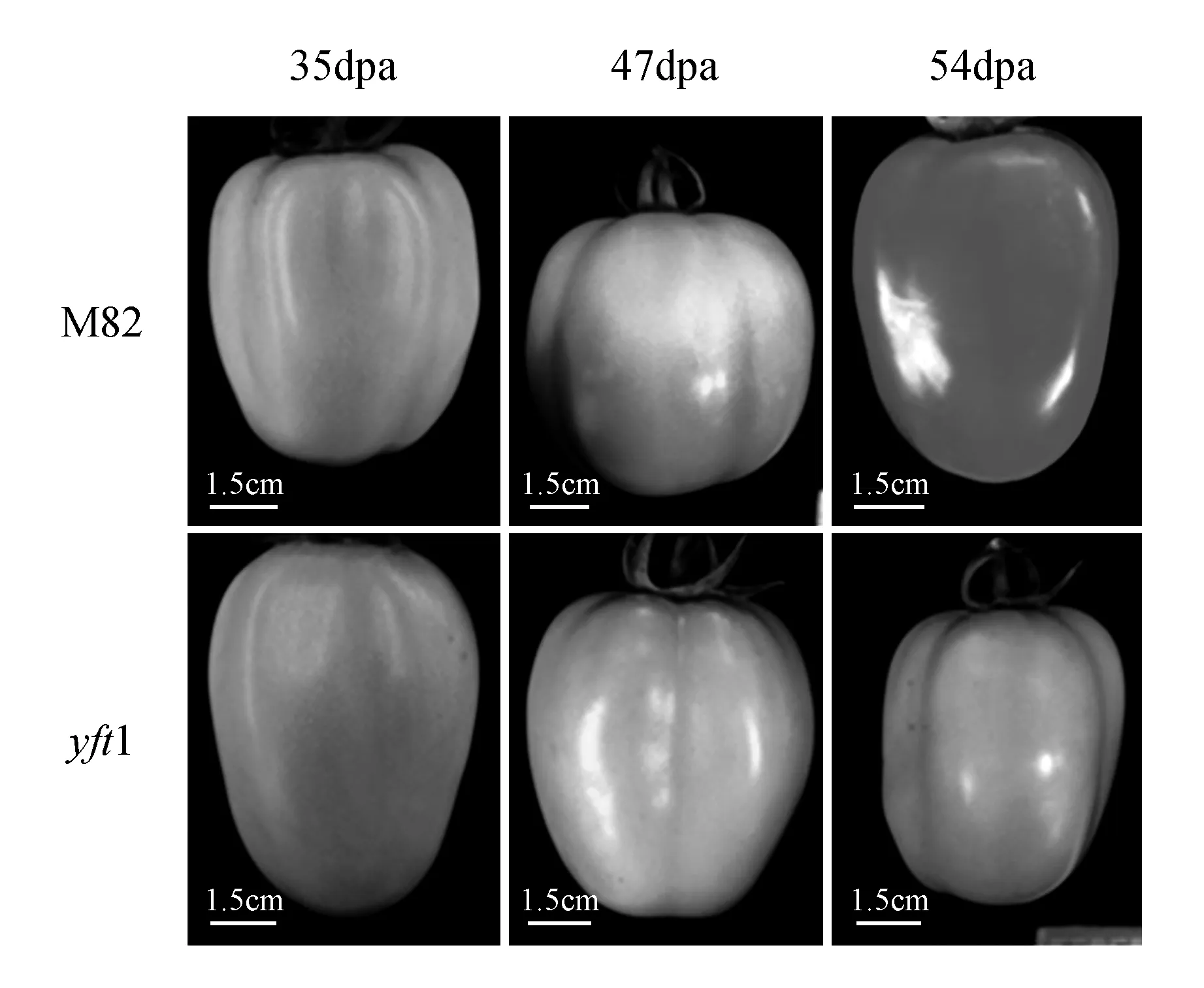
图1 野生型cv.M82和突变体yft1果色随发育的变化Fig.1 Alteration of fruit colors with development stages in wild type of cv.M82 and yft1
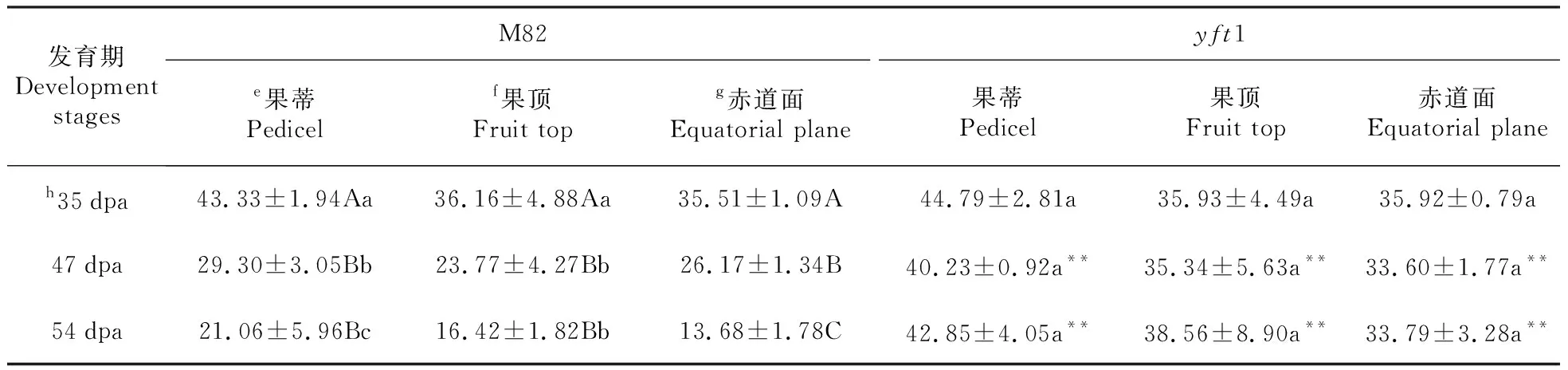
发育期Development stagesM82yft1e果蒂Pedicelf果顶Fruit topg赤道面Equatorial plane果蒂Pedicel果顶Fruit top赤道面Equatorial planeh35dpa43.33±1.94Aa36.16±4.88Aa35.51±1.09A44.79±2.81a35.93±4.49a35.92±0.79a47dpa29.30±3.05Bb23.77±4.27Bb26.17±1.34B40.23±0.92a**35.34±5.63a**33.60±1.77a**54dpa21.06±5.96Bc16.42±1.82Bb13.68±1.78C42.85±4.05a**38.56±8.90a**33.79±3.28a**
Note:A,B,C and a,b,c indicate that statistically significance differences of the tomato firmness(on the identical regions of both cv.M82 oryft1) existed between developmental stages atP<0.01 andP<0.05 levels, respectively;**indicate the statistically significance differences of the tomato firmness existed between cv.M82 andyft1 atP<0.01 level(the same regions and developmental stages);e,fthe value was an mean value derived from three biological replicates(mean ± Standard Deviation);gthe value was an calculated average value the total of 9 measured values derived from three biological replicates(mean±SD);hdpa,days post anthesis
2.2 番茄果皮解剖结构分析
为了深入理解YFT1参与调控番茄果实硬度形成机制,本研究通过半薄切片观察了cv.M82和yft1果皮显微结构,分析了YFT1对番茄果皮微结构形成和不同组织细胞发育的影响。结果表明,YFT1突变影响了番茄果皮的微结构、细胞大小和形状。cv.M82果皮中间层的薄壁组织细胞比靠近外果皮和内果皮的大。同时还发现,靠近果皮薄壁细胞伴随果实发育而增大(起始于47 dpa的BR),由内向外;在54 dpa(RR)时,中果皮和外果皮的薄壁细胞也变大。并且随着果实发育内果皮最初的圆形薄壁细胞(35 dpa)变成卵圆形(47 dpa)和不规则形(54 dpa),甚至在54 dpa时靠近内果皮薄壁细胞因内陷而呈现出不规则形,细胞间隙消失(图2:M82)。与cv.M82相比,yft1果皮细胞大小和形状随果实发育变化不明显,甚至在果实发育后期54 dpa,内果皮的薄壁细胞间隙仍清晰可见,这可能与yft1果皮在发育过程中始终保持较高细胞膨压、细胞间粘合性下降和构成细胞壁多糖降解滞后有关(图2:yft1)。

图2 番茄cv.M82和yft1果皮细胞显微结构随果实发育的变化Fig.2 Alteration of pericarp microstructure in cv.M82 and yft1
3 讨论
番茄(S.lycopersicum)是全球第一大经济作物,其品质决定了番茄的消费习惯、生产规模和发展潜力,而番茄外观、口感、风味、营养组分和功能物质含量与品质密切相关[1,8,11]。果色不仅是番茄果实发育进程标志,决定番茄果色的类胡萝卜素、花青素和叶绿素等重要抗氧化性物质与人类健康密切相关[11~12];而果实硬度取决于果皮细胞壁多糖沉积水平和细胞膨压大小[9,13~14]。我们在研究番茄yft1突变体时发现,源自cv.M82的yft1突变体致使果色由红变黄,并通过遗传分析确认了其单隐性遗传机制;通过对源自cv.M82和yft1的YFT1分析发现,yft1是由于YFT1的5′UTR遗传损伤所致。YFT1基因突变致使表达明显下降,并使乙烯合成和类胡萝卜素含量下降和叶绿体发育延迟[10]。同时,我们也发现YFT1突变也影响到番茄硬度和发育进程。观察cv.M82和yft1果皮显微结构发现,在54 dpa时,野生型cv.M82果皮细胞或许是由于细胞壁多糖(纤维素、半纤维素和果胶)沉积、细胞张力改变,细胞间相互挤压呈现出不规则细胞和细胞间隙的消失表型(图2:M82)。不过,YFT1是通过何种途径、如何调控多糖在番茄果皮细壁上沉积和细胞膨压还未见研究报道。特别是随着番茄分子生物学研究进展和组学数据增加[1,7],计算生物学应用构建细胞壁形成(多糖沉积、组装、解聚和基因、转录和蛋白水平调控)和细胞膨压的信号转导及调控网络,将对后续番茄品质精准和靶向改良提供理论依据。而本研究从表型(硬度和显微结构)证实了YFT1通过延迟番茄发育而控制番茄果色和硬度形成,将为后续番茄果色和硬度形成分子机制的揭示提供了必要表型证据。
致谢我们感谢以色列希伯来大学的Dani Zamir教授提供了宝贵的番茄研究材料cv.M82和yft1(n3122);感谢上海交通大学农业与生物学院李云飞教授在番茄硬度测量给予的帮助,并对上海交通大学生命科学技术学院的许杰博士在番茄果皮半薄切片制备、果皮显微结构观察给予的指导和帮助表示感谢!

