3-甲基-1-丁醇对玉米和小麦种子萌发的影响
李春英 张晶晶 赵春建 姜宏伟 任雪婷 苏伟然 关佳晶 李玉正
(东北林业大学森林植物生态学教育部重点实验室,哈尔滨 150040)
在植物根际定植的有益真菌和细菌可以促进植物对矿物元素的吸收和利用,或者产生促进植物生长的次生代谢产物。这些定植在根际可直接或间接对植物生长产生促进作用的细菌和真菌分别被命名为植物根际促生细菌(PGPR)和根际植物促生真菌(PGPF)[1~2]。基于PGPR和PGPF在可持续的问题上对作物生产的重要性,它们在植物生长的过程中扮演的角色被广泛研究[3]。PGPR/PGPF-植物相互作用的因素包括生物肥料、生物防治、植物刺激和挥发性信号释放等[4]。在过去的十年中,挥发性有机化合物(VOCs)能诱导植物生长这一现象及其相关机制已有报道[5~7]。据报道,芽孢杆菌(Bacillus)BCT9释放的挥发物可以作为生长调节剂对莴苣幼苗生长起促进作用[8]。Hung[9]报告,天然存在23种不同的真菌VOCs能对植物的生长和健康产生正面或负面影响。由枯草芽孢杆菌(Bacillussubtilis)GB03和解淀粉芽孢杆菌(B.amyloliquefaciens)IN937a产生的2,3-丁二醇和3-羟基丁酮,由巨大芽孢杆菌(B.megaterium)XTBG34产生的2-戊基呋喃等均可促进植物生长[6,10~11]。3-甲基-1-丁醇是芽孢杆菌属(Bacillus)、假单胞杆菌属(Pseudomonas)和茎点霉属(Phoma)微生物等释放的一种常见VOC[12~14]。一些报道研究了包括3-甲基-1-丁醇在内的多种VOC混合物对植物生长的影响:例如,将烟草暴露于2-甲基丙醇,3-甲基-1-丁醇,甲基丙烯酸和乙酸异丁酯等的混合物后,发现其鲜重有显著的增加[12]。但单独的3-甲基-1-丁醇处理对植物萌发和生长的影响尚鲜见报道。产生3-甲基-1-丁醇的常见菌属如芽孢杆菌属和假单胞杆菌属微生物常在如小麦、玉米等作物根际定植。因此,本文研究了3-甲基-1-丁醇对小麦和玉米种子萌发的影响,以初步探查3-甲基-1-丁醇在介导微生物-植物种间化学关系中的作用。
1 材料与方法
1.1 材料与试剂
小麦种子(科农2009)和玉米种子(辽单120)购于哈尔滨种子市场。3-甲基-1-丁醇(99%)购于阿拉丁试剂有限公司(上海)。
1.2 种子实验
将小麦和玉米种子在0.4% KMnO4溶液中浸泡20分钟进行表面消毒,用无菌蒸馏水洗涤几次去除残留的KMnO4溶液,然后均匀地摆放在直径9 cm的无菌培养皿中(每皿30粒种子),皿内放置用10 mL 3-甲基-1-丁醇水溶液预先润湿的双层滤纸。培养皿内的滤纸每天更换,并设定10 mL浓度的3-甲基-1-丁醇润湿。每次更换滤纸后,将培养皿密封。以无菌蒸馏水处理作为对照。每种处理浓度(1、10、100 mg·L-1)设3个重复,培养皿保持在27±2℃和70%相对湿度下,光周期为16 h光照/8 h黑暗,持续5天。
1.3 萌发指标的测定
以胚根突破种皮1 mm视为发芽。播种后每天计数并记录发芽种子的数量。通过以下公式计算发芽率,发芽势,发芽指数和活力指数:

(1)

(2)
发芽指数(GI)=∑(Gt/Dt)
(3)
式中:Dt表示发芽总天数;Gt表示第t天的发芽数。
活力指数(VI)=发芽指数(GI)×种子鲜重
(4)
1.4 胚根长和胚芽长的测量
在为期5天的培养结束后,测量发芽种子的胚根长和胚芽长,并计算每组的平均数,最后结果以cm计。
1.5 鲜重测量
在为期5天的培养结束后,测量种子的鲜重,并计算每组的平均数,最后结果以g计。
1.6 生化指标分析
在培养结束后,对萌发的种子进行以下生化指标的测定:SOD活性参考何文平等[15]的方法,采用氮蓝四锉(NBT)光化还原法测定;可溶性糖含量参考李娜等[16]的方法,采用蒽酮比色法测定;可溶性蛋白的测定依据Bradford[17]的方法,采用考马斯亮蓝法测定;叶绿素含量,采用乙醇提取,分光光度法测定。
1.7 数据统计分析
使用SPASS软件进行数据处理,ANNOA和LSD检验分析差异显著性。
2 结果与分析
2.1 3-甲基-1-丁醇对小麦和玉米种子萌发的影响
不同浓度3-甲基-1-丁醇处理对小麦和玉米种子萌发的影响见表1。表1数据的方差分析结果显示,1 mg·L-1的3-甲基-1-丁醇处理下,两种受试植物种子的发芽率、发芽势或发芽指数均较对照组有所增加,但差异不显著(P>0.05)。1和10 mg·L-13-甲基-1-丁醇处理的两种受试植物种子活力指数显著增加:与对照组相比,1和10 mg·L-13-甲基-1-丁醇处理下的小麦种子活力指数分别提高8.76%(P=0.040)和6.09%(P=0.011);1和10 mg·L-13-甲基-1-丁醇处理下的玉米种子活力指数分别提高17.12%(P=0.023)和21.06%(P=0.008)。100 mg·L-13-甲基-1-丁醇处理下的小麦和玉米种子活力指数与对照组无显著差异(P>0.05)。

表1 3-甲基-1-丁醇对小麦和玉米种子萌发的影响
注:同列不同的小写字母表示两组的统计学差异显著(P<0.05)。单因素方差分析后,用LSD法做两两比较。
Note:Different lowercase letters in the same column indicate statistical differences between treatment groups atP<0.05,analysis ofvariance(ANOVA),followed by LSD test.

图1 不同浓度3-甲基-1-丁醇处理对玉米和小麦胚芽(A)和胚根长度(B)的影响 误差线表示标准误差(n=3),各柱形图上不同的小写字母表示数据间差异显著(P<0.05)。Fig.1 Effects of 3-methyl-1-butanol in different concentrations on germ(A) and radicle(B) length of maize and wheat Error bars indicate standard error (n=3).Different lowercase letters denote statistical differences between treatmentgroups at the 5% level according to LSD test

图2 不同浓度的3-甲基-1-丁醇对小麦和玉米胚芽SOD活性的影响Fig.2 Effects of 3-methyl-1-butanol in different contents on SOD activity of maize and wheat germ
不同浓度3-甲基-1-丁醇处理对两种受试种子胚根和胚芽长的影响见图1。图1数据的方差分析结果显示,在1和10 mg·L-1的3-甲基-1-丁醇处理下,两种受试植物种子的胚根和胚芽长度均较对照组提高,但差异不显著(P>0.05)。100 mg·L-13-甲基-1-丁醇的处理,抑制了两种受试植物种子的胚根和胚芽生长(P<0.05)。
2.2 3-甲基-1-丁醇对小麦和玉米种子生化指标
2.2.1 SOD活性
如图2所示,3-甲基-1-丁醇处理,对小麦种子SOD活性无显著影响(P>0.05)。3种浓度的3-甲基-1-丁醇处理均可显著提高玉米种子活性:与对照组相比,1、10和100 mg·L-13-甲基-1-丁醇处理下,玉米种子SOD活性分别提高了89.70%(P=0.010),95.71%(P=0.007)和67.64%(P=0.013)。
2.2.2 可溶性糖和可溶性蛋白含量
不同浓度3-甲基-1-丁醇处理对两种受试种子可溶性糖和可溶性蛋白含量的影响见图3。如图3A所示,随着3-甲基-1-丁醇浓度的增加,小麦和玉米种子可溶性糖含量均呈先降低再升高的趋势,但各处理组与对照组相比,差异不显著。如图3B所示,随着3-甲基-1-丁醇浓度的增加,两种受试作物种子可溶性蛋白含量也呈先降低再升高的趋势,且各组可溶性蛋白含量之间无显著差异。
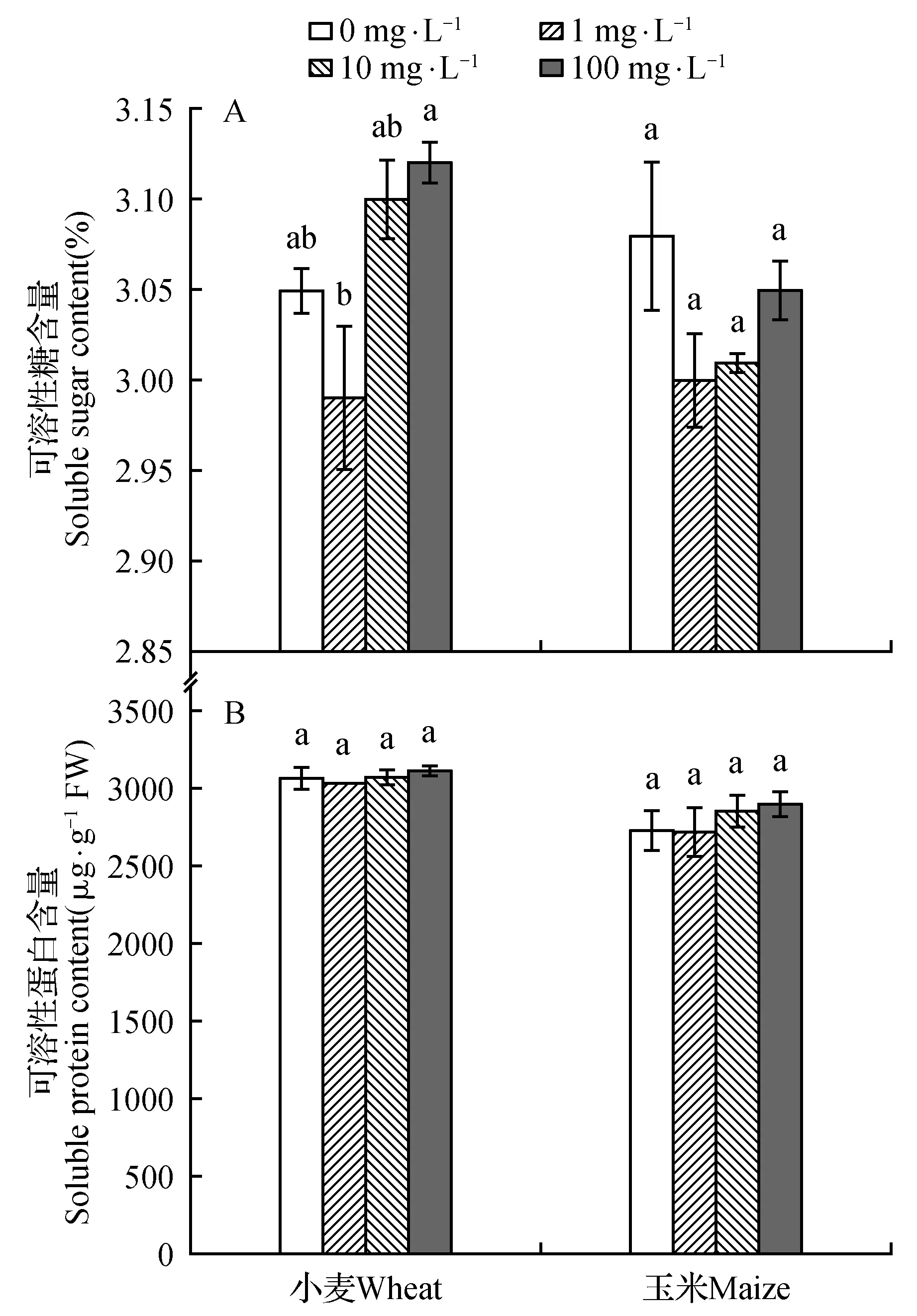
图3 不同浓度的3-甲基-1-丁醇对的小麦和玉米种子可溶性糖(A)和可溶性蛋白(B)含量的影响Fig.3 Effects of 3-methyl-1-butanol in different contents on soluble sugar(A) and protein(B) of maize and wheat
2.2.3 叶绿素含量
3-甲基-1-丁醇对玉米和小麦种子幼芽总叶绿素的影响如图4所示。随着3-甲基-1-丁醇浓度的增加,小麦和玉米幼芽叶绿素含量均呈先增加再减少的趋势。1 mg·L-13-甲基-1-丁醇处理下的小麦幼芽和1、10 mg·L-13-甲基-1-丁醇处理下的玉米幼芽,其总叶绿素均较对照组显著提高(P<0.05)。其中,1 mg·L-13-甲基-1-丁醇处理的小麦幼芽,其总叶绿素含量(18.16 mg·g-1FW)比对照组提高了8.20%;1 mg·L-13-甲基-1-丁醇处理的玉米幼芽总叶绿素含量(22.27 mg·g-1FW)比对照组提高了23.83%;10 mg·L-13-甲基-1-丁醇处理的玉米幼芽,其总叶绿素含量(17.98 mg·g-1FW)比对照组提高了26.25%。

图4 不同浓度的3-甲基-1-丁醇对的小麦和玉米种子胚芽总叶绿素含量的影响Fig.4 Effects of 3-methyl-1-butanol in different contents on total chlorophyll content of maize and wheat germ
3 讨论
植物和它们的种子在生长过程中获得了多种适应环境的能力。除了对生存必要的元素:水、氧气、光、养分以及适宜的温度外,植物对常由PGPF和PGPR产生的挥发物信号分子也很敏感[18]:这些挥发性信号分子能影响种子的萌发、植物根、茎等的生长。本文对常见的微生物挥发性信号分子-3-甲基-1-丁醇对小麦和玉米种子萌发的影响进行了研究。结果表明:低浓度(1 mg·L-1)的3-甲基-1-丁醇处理可以促进小麦和玉米种子萌发,显著提高发芽种子的活力指数。这一结果与Novero等[14]研究结论-1.3 mg·L-1的3-甲基-1-丁醇对种子的形态和萌芽状况无显著影响相比,略有差别。对可溶性糖和可溶性蛋白的生化测定结果显示:在1 mg·L-1的3-甲基-1-丁醇处理下两种受试作物的可溶性糖和蛋白质的含量都是各组最低的。这可能是由于1 mg·L-1处理下,受试作物种子将可溶性糖和蛋白质更多的转化成了其他的生长过程中需要的因子。相反,100 mg·L-1处理下的种子某种程度上生长受阻、糖和蛋白的转化受阻,于是导致了该处理下,种子内可溶性糖和蛋白的积聚。与此相适应的是,1和10 mg·L-1处理下的受试作物种芽总叶绿素含量以及抗氧化酶SOD活力均呈较高的水平。上述研究结果表明:3-甲基-1-丁醇作为介导微生物—植物相互作用的分子,在适宜的浓度下能促进小麦和玉米种子萌发。尽管本文仅做了实验室研究,但3-甲基-1-丁醇作为一种类激素化学信号分子体现极大的潜在价值,对其进行深入研究后可望用于农业生产实践,以达到作物增产的目的。

