头颈部肿瘤SALL4、MAGE-A3特异性CTL免疫反应分析
马苗苗, 胡云辉,2, 王若峥,2
(1中国医学科学院肿瘤免疫与放疗研究重点实验室, 乌鲁木齐 830011; 2新疆医科大学附属肿瘤医院放疗中心, 乌鲁木齐 830011)
头颈部肿瘤是常见的恶性肿瘤之一,其发病率在全球范围内呈逐年上升趋势。该病好发于鼻腔、鼻窦、口咽、下咽、口腔、喉、唇部及颈段食管等部位,其中鳞状细胞癌为常见的病理类型,约占头颈部肿瘤的90%[1]。目前,手术联合放化疗等综合性治疗仍是主要治疗方式,但因头颈部肿瘤易发生局部复发及远处转移、预后较差等特点,成为治疗过程中的棘手问题。近些年,免疫治疗在肿瘤中成为研究热点,与传统疗法相比,免疫治疗具有高特异性、强杀伤能力、毒副反应轻等优点[2-3]。已知肿瘤抗原能够诱导机体产生较强特异性免疫反应,可为抗肿瘤的治疗提供新思路。
在众多肿瘤抗原中,肿瘤-睾丸抗原(cancer-testis antigen,CTA)越来越多引起研究者的关注与重视,这类抗原包括人类婆罗双树样(sal-like,SALL)基因、黑色素瘤抗原(melanoma associated antigen,MAGE)基因家族、滑膜肉瘤X断裂点基因(synovial sarcoma X break point gene,SSX)基因家族等[4-5]。研究表明,SALL4 和 MAGE-A3在睾丸生殖肿瘤、黑色素瘤、肝癌、卵巢癌、前列腺癌、乳腺癌等众多肿瘤组织中高表达,并与患者临床特征和预后相关,但在头颈部肿瘤中的相关报道较少[6-7]。本研究采用 Cultured 酶联免疫斑点法(enzyme-linked immunospot assay,ELISPOT),将分离出的头颈部鳞癌患者外周血单核细胞(peripheral blood mononuclear cells, PBMCs)进行培养,通过特异SALL4和MAGE-A3抗原多肽体外刺激PBMCs中T淋巴细胞分泌干扰素-γ(interferon-γ, IFN-γ),在单细胞水平上测定其数量和功能。进一步比较这两个抗原与临床特征的相关性,以期为头颈部肿瘤的免疫治疗提供理论基础。
1 资料与方法
1.1研究对象收集2016年10月-2017年6月新疆医科大学附属肿瘤医院病理明确诊断头颈部鳞状细胞癌的患者共38例。年龄23~82岁,中位年龄 59岁;其中男性30例,女性 8例,包括鼻窦部肿瘤3例,口腔癌8例,下咽癌11例,喉癌16例(表1)。采集患者治疗前肘静脉血10 mL。入组研究患者均签署知情同意书。纳入标准:(1)病理诊断头颈部鳞状细胞癌明确;(2)卡氏(KPS)评分≥70分者;(3)有完整的临床病例资料。排除标准:(1)合并严重免疫系统疾病、传染病、慢性感染者;(2)既往接受过放化疗、免疫治疗者;(3)合并其他恶性肿瘤;(4)KPS<70分者。
1.2主要试剂与仪器ELISPOT试剂盒由英国牛津大学MRC人类免疫学实验室提供;SALL4、MAGE-A3抗原肽由英国牛津大学MRC人类免疫学实验室合成免费赠送;96孔板(美国Millipore公司);细胞培养液、胎牛血清、磷酸盐缓冲液(PBS)、植物血凝素(PHA)、细胞刺激因子(H10/IL2)(美国Sigma公司);台盼蓝染液、青霉素-链霉素溶液(北京博奥森生物技术有限公司);一抗、二抗(北京中杉金桥生物技术有限公司)。
1.3试验方法SALL4、MAGE-A3抗原多肽设2个反应孔,对应肽段分别设立1个阳性对照孔和1个阴性对照孔。(1)从外周血中分离出PBMCs,96孔板加入50 μL浓度为10 mg/L的一抗包被,室温培养2 h;(2)96孔板用PBS洗涤后加入200 μL含胎牛血清的培养液,放置培养箱中培养1 h;(3)舍弃培养液,加入制备好的PBMCs 50 μL,同时分别加入SALL4、MAGE-A3抗原多肽,阳性对照加入2 μL的PHA ,阴性对照孔加入50 μL培养液,放入培养箱中培养;(4)2~3 d更换培养液,培养3 d和10 d时加入H10/IL2;(5)第13 天弃去培养液,加入一抗50 μL,室温放置2 h;(6)PBS洗涤后加入二抗,室温放置1 h;(7)弃去二抗,PBS洗涤后加入10 mL显色液,室温放置15 min;(8)再次洗涤,室温下晾干,读取数据。

表1 38例头颈部肿瘤患者的基本临床特征/例(%)
1.4试验结果的判定标准检测的96孔板的每一个斑点对应抗原多肽激活的一个分泌 IFN-γ的CTL,记录的斑点数对应抗原多肽激活细胞毒性T淋巴细胞(cytotoxic lymphocyte, CTL)的数量,斑点形成细胞(Spots forming cell,SFC)也称阳性细胞,采用SFC/106PBMCs表示。阳性判断标准为试验孔斑点数≥3倍的阴性对照孔斑点数。
1.5统计学处理应用SPSS17.0软件包进行数据分析,计量资料比较采用t检验,不符合正态性的比较采用秩和检验;计数资料比较采用卡方检验或Fisher确切概率法检验,以P<0.05为差异有统计学意义。
2 结果
2.1头颈部患者中SALL4、MAGE-A3特异性CTL免疫反应频率及强度患者外周血中SALL4、MAGE-A3特异性CTL反应频率分别为47.37%(18/38)和47.37%(18/38),平均反应强度分别为4 233.11 SFC/106PBMCs和2 453.59 SFC/106PBMCs(表2)。

表2 38例头颈部肿瘤患者SALL4、MAGE-A3特异性CTL反应频率及强度
2.2头颈部肿瘤患者SALL4特异性CTL反应频率及反应强度与临床特征的关系SALL4 特异性CTL反应频率及强度在年龄、性别、病灶位置、病理分型、N分期、M分期、临床分期、病例分型之间比较,差异无统计学意义(P>0.05)。在肿瘤T分期中,T1与T2~4期患者SALL4特异性CTL反应频率(18.2%与59.3%)和强度(4 599.73 SFC/106PBMCs与3 945.20 SFC/106PBMCs)比较差异有统计学意义(P=0.033和P=0.042)(图1、2)。
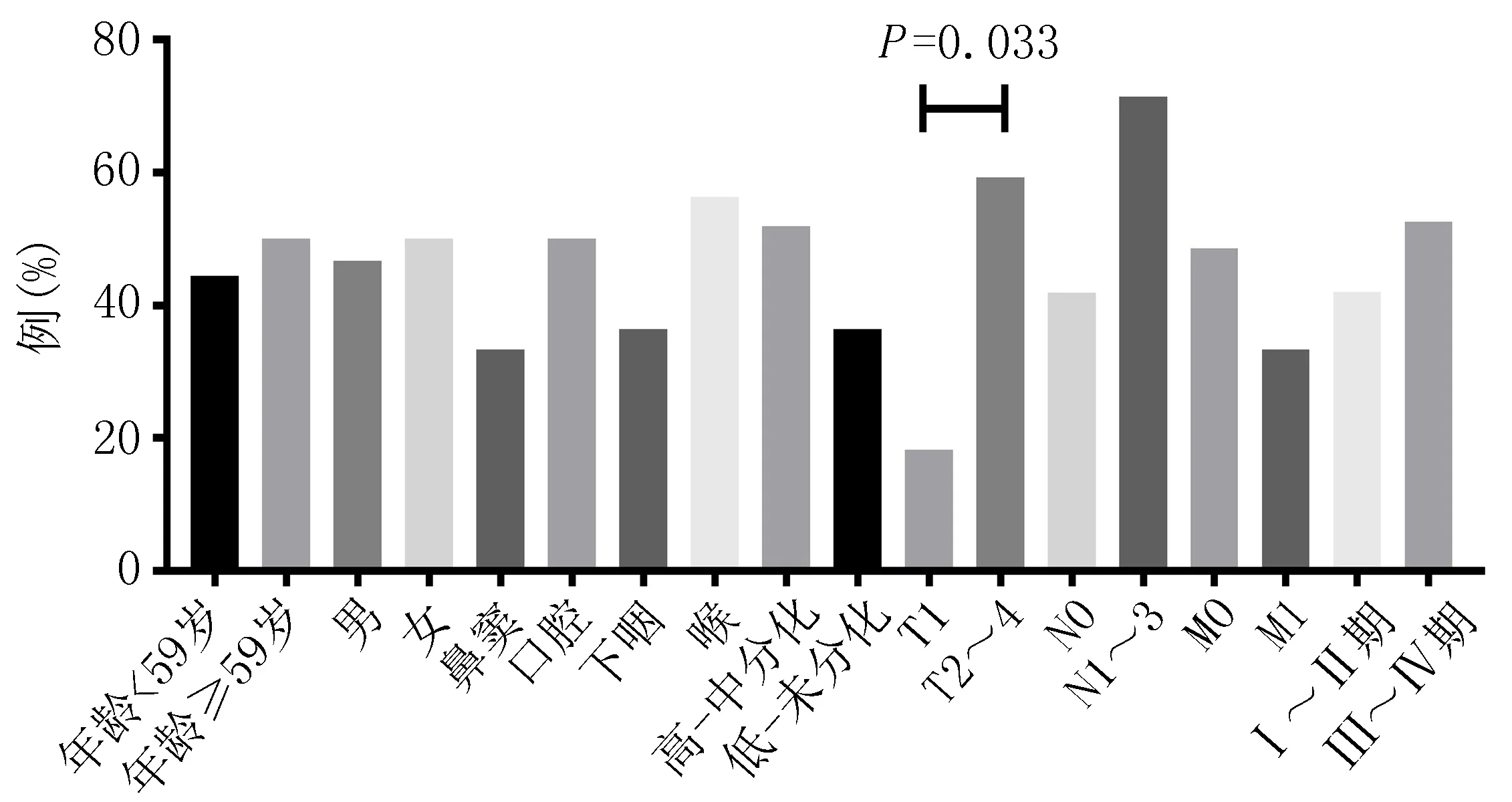
图1 38例头颈部肿瘤患者SALL4特异性CTL反应频率
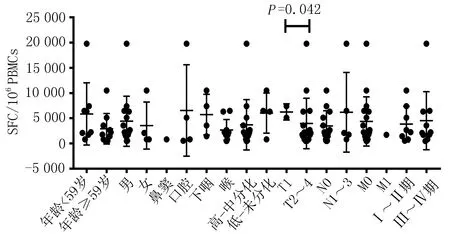
图2 38例头颈部肿瘤患者SALL4特异性CTL反应强度
2.3头颈部肿瘤患者MAGE-A3特异性CTL反应频率及反应强度与临床特征的关系MAGE-A3 特异性CTL反应频率及强度在年龄、性别、病灶位置、病理分型、N分期、M分期、临床分期、病例分型之间比较,差异无统计学意义(P>0.05)。在肿瘤T分期中,T1与T2~4期患者MAGE-A3特异性CTL反应强度(1 449.61 SFC/106PBMCs与2 654.38 SFC/106PBMCs)比较差异有统计学意义(P=0.036)(图3、4)。
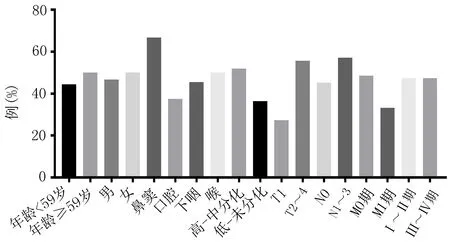
图3 38例头颈部肿瘤患者MAGE-A3特异性CTL反应频率

图4 38例头颈部肿瘤患者MAGE-A3特异性CTL反应强度
3 讨论
在肿瘤抗原中,CTA具有较强的免疫原性,它能够诱导机体产生细胞免疫应答和体液免疫应答[8],相关研究已在黑色素瘤、肺癌、肝癌、胃癌、食管癌、乳腺癌和头颈部肿瘤等恶性肿瘤中深入开展。虽然CTA基因在多种组织学来源的肿瘤组织中都有表达,但其表达频率不尽相同,在同一类型的肿瘤中表达频率存在很大差异[4,7]。SALL4和MAGE-A3在头颈部肿瘤中的研究相继开展,但少有使用Cultured ELISPOT方法进行研究。本课题组既往比较了Cultured ELISPOT与普通ELISPOT方法检测头颈部肿瘤睾丸抗原SALL4、MAGE-A3特异性CTL免疫反应情况,Cultured ELISPOT可以引较强免疫反应,该方法更有利于CTL检测[9],因此,我们使用该方法,进一步分析这两个蛋白免疫应答水平与患者临床特征的相关性。
研究证实,SALL4是调控SALL基因家族表达的主要因子,能通过多个信号通路细胞周期调控及细胞凋亡中起重要作用[10]。SALL4在多种肿瘤中具有高敏感性和特异性,所以对于恶性肿瘤的诊断、评价预后和治疗中有很大应用的价值[11]。Featherston等[12]通过免疫组化研究了石蜡包埋的颊粘膜鳞状细胞癌组织,结果发现SALL4在巢内细胞上高表达。Rad等[13]研究者使用定量即时聚合酶链式反应(quantitative real time-polymerase chain reaction,qRT-PCR)、免疫组织化学法检测食管鳞癌组织,发现SALL4与患者临床特征、肿瘤高侵袭性及不良预后有关,进一步发现SALL4的下调增强了食管鳞癌细胞对顺铂的敏感性。国内的刘思强等[14]采用PCR和Western blotting方法检测50例口腔鱗状细胞癌组织中SALL4表达情况,结果显示癌组织表达水平高于其在癌旁正常组织,差异有统计学意义。另一项在头颈部喉癌的研究中发现,SALL4在喉鳞状细胞癌组织中的阳性表达率与肿瘤分化程度、临床分期及局部淋巴结转移相关,表明其可能与喉鳞状细胞癌的发生、发展密切相关[15]。
本课题组既往报道了Cultured ELISPOT方法检测头颈部和食管癌患者外周血中多种CTA特异性CTL免疫反应情况,结果显示SALL4的反应频率和平均强度分别为76.5%和3 515.47 SFC/106PBMCs,是免疫反应最强的指标[9]。我们研究通过Cultured ELISPOT方法检测头颈部鳞癌患者外周血中SALL4特异性CTL反应频率和平均强度分别为47.37%(18/38)和4 233.11 SFC/106PBMCs,尽管该方法的判读较前改进,但结果仍表明患者对该抗原具有较强的免疫反应,与既往的报道一致。与患者的临床特征相比,在年龄、性别、病灶位置、病理分型、N分期、M分期、临床分期、病例分型之间比较,差异无统计学意义。肿瘤分期中T1与T2~4期患者SALL4 特异性CTL反应频率和强度比较差异有统计学意义。既往的研究报道 SALL4与肿瘤分期相关,随着肿瘤逐渐进展,SALL4在肿瘤组织的表达量增加,而出现患者外周血CTL反应能力上升,其中具体的机制如何,还需要深入研究。
MAGE家族最早在黑色素瘤中发现,而后研究者对MAGE-A等分子进行深入研究。研究发现,MAGE-A基因去甲基化和肿瘤的临床特征、转移、复发和预后相关,并与细胞信号转导通路有关[16]。国外的研究者通过 RT-PCR分析了头颈部鳞癌中MAGE-A3的表达情况,结果表明在肿瘤组织中高表达[17]。另有研究纳入453例头颈部鳞癌患者,通过免疫组化检测 MAGE-A3的表达情况,结果显示MAGE-A3蛋白的表达与患者预后差相关[18]。另一项研究,同样使用免疫组化检测头颈部腺样囊性癌患者组织中MAGE-A3的表达水平,结果发现MAGE-A3高表达患者预后较差[19]。国内的研究者发现MAGE-A3是喉癌相关性抗原,与临床分期、肿瘤大小和淋巴转移呈正相关,MAGE-A3阳性的患者的总生存期比阴性患者者低。进一步通过甲基化检测了106例喉鳞状细胞癌和22例癌旁组织MAGE-A3甲基化水平,结果显示该基因可能成为喉鳞状细胞癌患者外周血循环肿瘤细胞的标记,作为监测患者预后的重要指标[20]。
前期董丹宁等[9]研究者使用Cultured ELISPOT方法检测头颈部肿瘤和食管癌26例患者外周血中MAGE-A3特异性CTL反应频率和强度分别为64.7%,2 353.60 SFC/106PBMCs。本研究中MAGE-A3特异性CTL反应频率和平均强度分别为47.37%(18/38)和2 453.59 SFC/106PBMCs,前者的免疫反应频率较高,可能与判读方法、入组病种不同有关。进一步与患者的临床特征相比,在肿瘤T分期中,T1与T2~4期患者相比MAGE-A3 特异性CTL反应强度低,差异有统计学意义,在其它临床特征比较中未见统计学差异。其中原因可能是T1期患者样本量小,MAGE-A3特异性CTL反应阳性率低,还需扩大样本量进一步统计分析。
目前,SALL4和MAGE-A3已有多肽疫苗已被尝试应用于以黑素瘤、肝癌和肺癌为主的多种恶性肿瘤的临床治疗中,并取得了初步疗效。本研究通过初步了解头颈部鳞癌患者中SALL4和MAGE-A3抗原多肽特异性免疫反应与临床特征之间的关系,为可能在头颈部肿瘤中免疫治疗提供实验室数据。

