食管鳞癌SALL4和MAGE-A1的特异性免疫反应
冯亚宁, 张典刚, 闫 超, 王若峥,
(1中国医学科学院肿瘤免疫与放疗研究重点实验室, 乌鲁木齐 830011; 2新疆医科大学附属肿瘤医院放疗中心, 乌鲁木齐 830011)
食管癌(esophageal carcinoma,EC)的发病率位于全球恶性肿瘤的第八位,死亡率则居第六位[1]。该病通常在发现时多为中晚期。治疗食管癌的传统的方法包括手术和放化疗,但疗效不佳[2]。随着肿瘤免疫治疗的兴起,一些很有潜力的治疗模式取得了令人瞩目的成就,具有越来越重要的地位,筛选合适的肿瘤抗原靶点是这一研究的关键。肿瘤睾丸抗原(cancer testis antigen,CTA)属于肿瘤特异性抗原,其表达于多种肿瘤组织中,但却在滋养层细胞、胎盘及睾丸以外的其它正常组织中不表达[3]。肿瘤睾丸抗原由多个基因家族及基因组成,如黑色素瘤抗原 (MAGE)家族、纽约食管鳞状上皮癌抗原1(NY-ESO-1)家族、滑膜肉瘤X断裂点基因(SSX)家族和婆罗双树样基因 4(SALL4)等[4]。随着组织及器官逐渐成熟,人类婆罗双树样基因(SALL4)的表达数量也逐渐减少,文献报道SALL4和MAGE-A1的表达在多种非生殖细胞恶性肿瘤中上调的特点,符合肿瘤免疫治疗对于抗原分子表达的要求[5-8]。基于以上特点,探讨SALL4和MAGE-A1在食管鳞癌中的表达,具有重要临床价值。
酶联免疫吸附斑点法(ELISPOT)是一种定量测定 T 细胞活化相关参数的方法,该方法的一大特点是灵敏度高。最常用ELISPOT方法检测干扰素-γ(IFN-γ),为 CD8+CTL 激活的标志物[9]。本研究采用上述方法,使用人工合成的 SALL4和MAGE-A1 抗原多肽,检测食管鳞癌患者外周血中淋巴细胞对特异性抗原的免疫应答水平及其与临床特征的相关性,以期能够为食管鳞癌的免疫治疗提供实验相关依据。
1 资料与方法
1.1研究对象收集食管鳞癌并有明确病理诊断的初治患者51例,于2015年4月-2016 年10月在新疆医科大学附属肿瘤医院放疗中心接受治疗,年龄为40~82岁,中位年龄63岁。其中,男性28例,女性23例。依据WHO病理分型,低分化鳞癌13例,中分化鳞癌37例,高分化鳞癌1例。依据第7版食管癌TNM分期,Ⅰ期1例,Ⅱ期13例,Ⅲ期28例,Ⅳ期9例,51例食管鳞癌患者的一般资料见表1。该研究通过本院伦理委员会,并且所有研究对象均签署知情同意书。纳入标准:(1)病理明确诊断并未行放化疗的食管鳞癌患者;(2)临床分期采用 2010第七版 UICC/AJCC 标准分期;(3)卡氏(KPS)评分≥70者。排除标准:既往接受过放化疗、免疫治疗、免疫功能受到影响的,合并严重的全身性系统疾病、有任何恶性肿瘤病史者,合并其他类型恶性肿瘤的患者。

表1 51 例食管鳞癌初治患者的基本临床特征/例(%)
1.2试剂ELISPOT 试剂盒(英国牛津大学 MRC 人类免疫学实验室),SALL4和MAGE-A1 抗原肽由英国牛津大学 MRC 人类免疫学实验室馈赠,96 孔板(美国 Millipore 公司),胎牛血清、RPMI 1640细胞培养基、人淋巴细胞分离液、植物血凝素(PHA)、磷酸盐缓冲液(PBS)和细胞刺激因子(H10/IL2)均购自美国 Sigma 公司;青链霉素和台盼蓝购自上海生工生物技术有限公司。
1.3外周血单核细胞采集在患者治疗前,首先采集肘静脉血标本10 mL(EDTA抗凝),其次采用密度梯度离心法分离外周血单核细胞(peripheral blood mononuclearcells,PBMC),随后使用台盼蓝染色计数并将细胞重悬,进行培养 ELISPOT 实验。
1.4ELISPOT实验板包被在实验开始的24 h前进行:每份血标本对应设置6重孔,1个阴性对照孔,1个阳性对照孔,每孔加10 mg/L抗体,体积为50 μL/孔,用封板膜密封后置于 4℃ 冰箱过夜;洗涤:第2天用无菌 PBS 溶液洗涤包被好的96孔板6次;封闭:每孔加入含有10%胎牛血清的细胞培养液200 μL ,在 37℃、5% CO2培养箱中静置1 h;弃封闭液,调整PBMCs 为4×104/L, 以50 μL/孔的体积加入96孔板,在37℃、5% CO2培养箱中静置培养30 min,随后在对应的不同的孔中加入50 μL的肽池溶液,阳性对照 PHA 1 μL;于 37℃、5% CO2的培养箱中静置过夜;在实验第3天弃反应体系,用PBS溶液洗涤每孔,一抗溶液50 μL/孔,加盖,37℃ 静置2 h;用PBS溶液洗涤每孔6次,加入二抗,加盖后室温下静置45~60 min;显色:用PBS溶液洗涤每孔6次,显色液10 mL/孔,加盖,室温静置15 min;弃显色液,用去离子水冲洗每孔6次,在室温下待96孔板晾干;通过 AIDvSpot Reader Spectrum计数。
1.5实验结果的判定标准96孔板上显示的每一个斑点,即意味着存在一个分泌细胞因子的CTL,称作斑点形成细胞(spots forming cell,SFC),结果采用 SFC/106PBMCs 表示,即为反应强度。阳性判断标准:阳性对照孔SFC≥25个/106PBMCs,阴性对照孔 SFC<30个/106PBMCs,阳性对照孔SFC≥阴性对照孔SFC的3倍。
1.6统计学处理用SPSS 17.0软件包对数据进行处理,对于计量资料,采用t检验的方法进行比较,对于不符合正态性检验的数据,采用秩和检验;计数资料的比较,则采用 Fisher确切概率法或卡方检验,以P<0.05时为差异有统计学意义。采用Graph Pad Prism5.0 软件绘制统计图。
2 结果
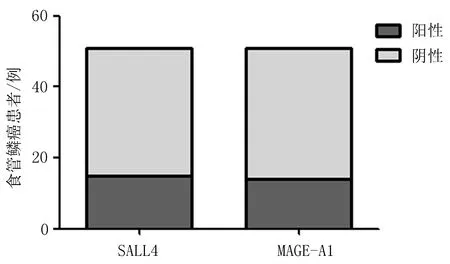
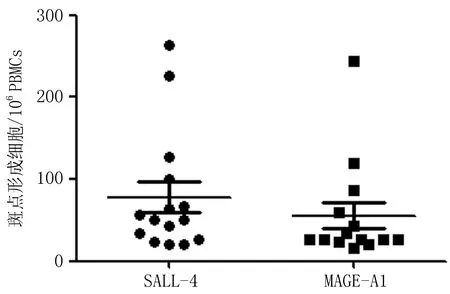
2.1初治食管鳞癌患者SALL4和MAGE-A1特异性CTL免疫反应频率及强度食管鳞癌患者外周血中 SALL4和MAGE-A1 特异性 CTL 反应频率分别为 29.4%(15/51)和 27.5%(14/51),反应强度分别为78.0和55.7 SFC/106PBMCs(图1、2)。
2.2初治食管鳞癌患者SALL4特异性CTL反应频率及反应强度与临床特征的关系SALL4 特异性 CTL 反应频率及强度在年龄、病灶位置、病灶长度、T 分期、N 分期、M分期、临床分期和病例分型之间差异无统计学意义(P>0.05)(表2)。
2.3初治食管鳞癌患者MAGE-A1特异性CTL反应频率及反应强度与临床特征的关系N0~1组MAGE-A1特异性CTL反应频率为37.5%,明显高于N2~3 组(10.5%),其差异有统计学意义(P=0.037),在年龄、病灶位置、病灶长度、T分期、M分期、临床分期和病理分型之间差异无统计学意义(P>0.05);MAGE-A1特异性CTL反应强度在年龄、病灶位置、病灶长度、T分期、N分期、M分期、临床分期和病理分型之间差异也无统计学意义(P>0.05)(表3)。
2.4初治食管鳞癌患者外周血中SALL4与MAGE-A1特异性CTL免疫应答相关性的分析有35例初治食管鳞癌患者外周血中的T细胞对SALL4和MAGE-A1 2种抗原肽其中之一发生特异性CTL反应,有15例能与2种抗原肽发生反应(表4)。
表2 初治食管鳞癌患者SALL4特异性CTL反应频率及强度比较

表3 初治食管鳞癌患者MAGE-A1特异性CTL反应频率及强度比较

表4 初治食管鳞癌患者外周血中SALL4与MAGE-A1特异性CTL反应相关性分析/例
Spearman相关分析后结果显示,食管鳞癌患者外周血中SALL4特异性CTL免疫反应频率与MAGE-A1特异性CTL免疫反应频率呈现弱相关(r=0.471,P=0.000),差异有统计学意义。SALL4和MAGE-A1的特异性CTL免疫反应强度之间没有明显相关性(r=0.239,P=0.338)。
3 讨论
大量的肿瘤相关抗原(tumor-associated antigen,TAA)逐渐被发现,其中肿瘤睾丸抗原(CTA)被认为最具有前景的肿瘤相关抗原之一。
SALL4 是果蝇Spalt 基因的同源异型基因家族中的成员之一,在维持胚胎干细胞的自我更新、多向分化潜能以及器官形成等方面有举足轻重的作用[10]。在完全分化的细胞中,SALL4 基因的表达被沉默或者下调,而在多种非生殖细胞恶性肿瘤中,该基因的激活、表达上调及其表达水平常常与疾病的进程、治疗效果及预后相关。SALL4 也是一种癌基因,癌基因若通过突变、转位等机制被激活,随后产生的表达产物可促进细胞发生病变,故SALL4 基因与多种恶性肿瘤的发生有关。文献报道,在造血系统恶性肿瘤、生殖恶性肿瘤、恶性横纹肌肉瘤和乳腺癌中,均可检测到 SALL4 的高表达[11-14]。本课题组前期应用 ELISPOT 法检测头颈部肿瘤患者外周血中 NY-ESO-1、SSX2和SALL4 3种 CTA 特异性 CTL 免疫反应,其中 SALL4 特异性 CTL 反应频率及反应强度最高[15]。本研究应用 ELISPOT 方法检测 51 例食管鳞癌患者外周血中 SALL4 特异性 CTL 反应频率为 29.4%,提示食管鳞癌患者外周血中可检测到 SALL4 特异性CTL反应,与头颈部肿瘤患者的研究结果相似[15]。
MAGE家族广泛表达于黑素瘤细胞系以及其他组织学类型的部分肿瘤细胞中,但是在睾丸及滋养层细胞外几乎在任何正常的成人组织中都没有被检测到[8],MAGE-A1由 HLA分子呈递,CTL通过识别 MAGE-A1抗原肽,可以特异性地识别并杀伤肿瘤细胞,因此其在肿瘤特异性免疫治疗的研究中备受关注。Zamuner等[16]采用 RT-PCR 的方法对89例初治的头颈部鳞癌(HNSCC)组织进行了检测,测得HNSCC中MAGE-A1的阳性率为44.9%。本研究结果显示,51例食管鳞癌患者外周血中MAGE-A1特异性CTL反应频率为27.5%,提示食管鳞癌患者外周血中可检测到 MAGE-A1特异性CTL反应。本研究中N0~1组MAGE-A1特异性CTL反应频率明显高于N2~3 组,其差异有统计学意义(P=0.037),考虑可能与肿瘤进展导致MAGE-A1诱导的特异性CTL反应降低有关。有文献报道,随着淋巴结逐渐转移,肿瘤患者病情逐渐进展,患者体内 T 细胞功能逐渐丧失,耗竭的 T 细胞逐渐失去效应能力,削弱 T 细胞对肿瘤的有效控制,使患者的免疫功能低下[17]。
在研究中分析同一患者外周血中,T细胞对SALL4和MAGE-A1 2种抗原肽的反应,有35例至少与二者其中之一发生特异性CTL反应,占总数的 68.6% (35/51),有15例同时与2种抗原发生反应,占总数的 29.4% (15/51)。文献显示,疫苗一般由一个或多个肿瘤抗原物质和免疫佐剂组成[18],治疗性癌症疫苗又是肿瘤免疫治疗的重要组成部分,单价的疫苗用于免疫治疗存在疗效单薄的弱点,这一结果提示,制备SALL4和MAGE-A1抗原二价疫苗用于食管鳞癌患者的免疫治疗,不仅可能增加食管鳞癌临床免疫治疗的潜在靶点,而且二价疫苗的制备可能提高免疫效果。本研究还发现,食管鳞癌患者 T 细胞对于 SALL4和MAGE-A1 2种特异性抗原肽的反应频率之间呈现出了弱的正相关性,提示可能是这两种肿瘤抗原有着潜在的共同表位,值得深入研究。
本研究使用的ELISPOT法,不仅可检测特异性抗原活化后分泌细胞因子(如 INF-γ、TNF-α 等)的单个效应细胞的频数,并可探讨外周血中特异性CTL细胞的数量和功能,具有较高的特异性和敏感性[9],本方法灵敏度远超细胞染色或ELISA 法,在研究肿瘤的发病机制、筛选能增强 T 细胞免疫的抗肿瘤活性的抗原表位肽以及疫苗的开发和评价方面发挥重要作用。

