聚多曲霉菌对Cd胁迫下芥菜种子萌发、生长和Cd吸收的影响
王 涛, 张海利, 邹路易, 郁红艳, 黄振兴,2, 滕 跃,①
(1. 江南大学环境与土木工程学院 江苏省厌氧生物技术重点实验室, 江苏 无锡 214122;2. 江苏省水处理技术与材料协同创新中心, 江苏 苏州 215009)
随着国内工农业的发展,大量重金属被排放到土壤中,造成土壤污染。根据2014年环境保护部和国土资源部发布的全国土壤污染状况数据,土壤的无机污染物中镉(Cd)污染最为严重[1],并且,土壤中的Cd具有毒性大和难降解等特点,不仅能破坏土壤的生态结构,而且可通过食物链的累积作用威胁人类身体健康,因此,对Cd污染土壤进行修复越来越受到人们的关注。利用植物尤其是重金属超积累植物吸收土壤中的重金属元素以修复重金属污染土壤是目前学术界的研究热点,该方法具有投资少、操作方便和无二次污染等优点。然而,许多重金属超积累植物的生物量较小,生长周期较长,且对难溶态重金属元素吸收困难,因此,很难利用重金属超积累植物广泛进行重金属污染土壤修复[2]。相关研究结果[3-4]表明:部分微生物不但具有抵抗重金属污染的能力,而且能够促进植物生长,提高植物对土壤中重金属元素的富集能力,因此,筛选有效菌株增强植物对土壤中重金属元素的积累能力具有重要的现实意义。
芥菜〔Brassicajuncea(Linn.) Czern.〕隶属于十字花科(Brassicaceae)芸苔属(BrassicaLinn.),为一年生草本植物,具有很强的Cd富集能力[5]。聚多曲霉菌〔Aspergillussydowii(Bain. et Sart.) Thom et Church〕隶属于曲霉属(AspergillusMich. ex Link: Fr.),来源广泛,易培养,对Cd抗性较强,并能够提高土壤中重金属元素的生物有效性[6]。Khan等[7]认为,具有一定重金属抗性的曲霉属真菌具有强化植物修复重金属污染土壤的潜能,但关于该属真菌的实际应用情况尚未明确。
作者从污染土壤中筛选出具有一定Cd抗性的聚多曲霉菌菌株DJ515-2,对1 mmol·L-1Cd胁迫下接菌组(接种浓度为1.0×108CFU·mL-1的DJ515-2菌悬液)和对照组(未接种DJ515-2菌悬液)芥菜种子萌发状况进行了比较分析,并采用盆栽法对不同水平Cd污染土壤中接菌组和对照组芥菜单株地上部和地下部的鲜质量和干质量、地上部和地下部的Cd含量、单株Cd吸收量及根际土壤有效态Cd含量进行了比较研究,以期明确聚多曲霉菌对芥菜种子萌发和生长的影响,并探究其对芥菜修复Cd污染土壤的促进效果,为超积累植物-微生物联合修复Cd污染土壤的实践应用提供理论指导。
1 材料和方法
1.1 材料
供试芥菜种子购自江苏省花中之王销售基地,将芥菜种子先用无水乙醇和体积分数30%H2O2的等体积混合液灭菌15 min,再用无菌水冲洗干净后备用;供试聚多曲霉菌菌株分离自山东省临沂市某化工厂附近以Cd污染为主的土壤;供试土壤为江苏省无锡市滨湖区太湖岸边0~20 cm的表层土壤,风干后研磨,过孔径2 mm筛,混匀。土壤中的有机质含量为13.8 g·kg-1,全氮含量为0.1 g·kg-1,有效磷含量为56.5 mg·kg-1,速效钾含量为99.0 mg·kg-1,阳离子交换量为21.3 cmol·kg-1,Cd含量为0.2 mg·kg-1,pH 6.73。
1.2 方法
1.2.1 供试菌株和菌悬液的制备 称取1 g以Cd污染为主的土壤,加入9 mL无菌水,振荡20 min;取1 mL悬浮液,采用10倍梯度稀释法进行逐级稀释;量取稀释1 000、10 000和100 000倍的稀释液各200 μL,分别涂布在含质量浓度30 mg·L-1Cd的PDA固体培养基上,置于28 ℃恒温培养箱中培养。选取优势单菌落,逐步提高PDA固体培养基的Cd质量浓度,分离并纯化获得具有较强Cd抗性的菌株(最小抑菌Cd质量浓度为1 500 mg·L-1)。经ITS序列测序和分析,该菌株为聚多曲霉菌,命名为DJ515-2,GenBank登录号MF359934。
将DJ515-2接种到PDA液体培养基中,置于28 ℃恒温气浴摇床上150 r·min-1振荡培养24 h;于4 ℃条件下8 000 r·min-1离心15 min;沉淀用质量分数0.9% NaCl溶液清洗3次,重悬于无菌水中,制成浓度为1.0×108CFU·mL-1的菌悬液。
1.2.2 种子萌发实验 将供试种子平均分成2组,一组用浓度为1.0×108CFU·mL-1的DJ515-2菌悬液浸泡4 h,作为接菌组种子;另一组用超纯水浸泡4 h,作为对照组种子。取接菌组种子30粒,平均放入3个铺有无菌滤纸的灭菌培养皿中,每个培养皿加入浓度为1.0×108CFU·mL-1的DJ515-2菌悬液5 mL;取对照组种子30粒,平均放入3个铺有无菌滤纸的灭菌培养皿中,每个培养皿加入超纯水5 mL。接菌组和对照组的培养皿均喷洒1 mmol·L-1CdSO4溶液5 mL,置于28 ℃条件下暗培养7 d,观察种子发芽状况(以胚芽露出种皮作为判断种子发芽的标准),根据公式“种子发芽率=(发芽种子数/供试种子数)×100%”计算种子发芽率;同时,用游标卡尺(精度0.01 cm)测量根长和茎长,其中,根长为胚根到胚轴的长度,茎长为胚轴到胚芽的长度。根据公式“种子活力指数=种子发芽率×(根长+茎长)”[8]计算种子活力指数。
1.2.3 盆栽实验 于2017年4月1日,在江南大学温室花房进行盆栽实验。取一定量CdCl2固体粉末,倒入供试土壤中,加水并搅拌混匀,使土壤的Cd质量浓度分别为0、28、56和112 mg·kg-1;3周后于121 ℃条件下高温灭菌20 min,冷却后装盆,每盆装入模拟Cd污染土壤1.5 kg。将供试种子平均分成2组,一组用浓度为1.0×108CFU·mL-1的DJ515-2菌悬液浸泡4 h,作为接菌组种子;另一组用超纯水浸泡4 h,作为对照组种子。采用直播方式进行播种,每组播种6盆,每盆10粒种子,各3个重复。种子发芽1周后进行间苗,每盆保留长势良好的幼苗5株;植株长势稳定后,接菌组每盆加入浓度为1.0×108CFU·mL-1的DJ515-2菌悬液5 mL,对照组每盆加入超纯水5 mL。实验期间,保持自然通风,光照充足,每天早晚各浇超纯水1次。
1.2.4 植物样品采集及指标测定 培养3周后,沿土壤表面剪下样株,将样株分成地上部和地下部2个部分,并将同一盆的样品放在一起。样品用蒸馏水洗净后,用吸水纸吸干表面水分,使用精度0.000 1 g的电子天平分别称量每盆植株地上部和地下部的总鲜质量;置于105 ℃烘箱内杀青0.5 h,并于65 ℃条件下烘干至恒质量,分别称量每盆植株地上部和地下部的总干质量。根据上述测量结果分别计算接菌组和对照组单株地上部和地下部的鲜质量和干质量。
将烘干的地上部和地下部样品粉碎,各取0.2 g样品,加入V(硝酸)∶V(高氯酸)=4∶1的混合溶液,使用Multiwave PRO高通量微波消解仪(奥地利Anton Paar公司)进行微波消解;使用AA-7000火焰原子吸收分光光度计(日本Shimadzu公司)分别测定地上部和地下部的Cd含量。根据公式“单株Cd吸收量=(地上部Cd含量×单株地上部干质量)+(地下部Cd含量×单株地下部干质量)”计算单株Cd吸收量。
1.2.5 根际土壤有效态Cd含量测定 在植株取样后,挖取植株根际周围的土壤,自然风干后,过60目尼龙筛,按照固液比1∶10的比例加入0.1 mol·L-1HCl溶液;使用AA-7000火焰原子吸收分光光度计测定根际土壤有效态Cd含量。
1.3 数据处理及统计分析
采用EXCEL 2007软件计算相关数据的平均值和标准差,采用Origin 8软件作图,采用SPSS 19.0统计分析软件进行LSD单因素方差分析。
2 结果和分析
2.1 聚多曲霉菌对Cd胁迫下芥菜种子萌发的影响
种子萌发实验结果(表1)表明:在相同Cd胁迫条件下,接菌组(接种浓度为1.0×108CFU·mL-1的DJ515-2菌悬液)芥菜种子发芽率、根长、茎长和种子活力指数均高于对照组(未接种DJ515-2菌悬液),分别较对照组升高了20.0%、52.4%、56.3%和83.7%,但与对照组间的差异均不显著,说明聚多曲霉菌对Cd胁迫下芥菜种子萌发有一定的促进作用,但其促进作用并不显著。
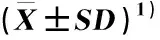


处理组2)Treatment group2)种子发芽率/%Seed germination rate根长/cmRoot length茎长/cmStem length种子活力指数Seed vigor indexCK50.0±10.0a0.82±0.29a0.16±0.05a49.00±22.59aT60.0±10.0a1.25±0.81a0.25±0.08a90.00±54.99a
1)同列中不同的小写字母表示差异显著(P<0.05) Different lowercases in the same column indicate the significant difference (P<0.05).
2)CK: 对照组(未接种DJ515-2菌悬液) The control group (not inoculating DJ515-2 fungal suspension); T: 接菌组(接种浓度为1.0×108CFU·mL-1的DJ515-2菌悬液) Inoculation group (inoculating DJ515-2 fungal suspension with concentration of 1.0×108CFU·mL-1).
2.2 聚多曲霉菌对Cd胁迫下芥菜单株质量的影响
聚多曲霉菌对不同质量浓度Cd胁迫下芥菜单株质量的影响见图1。
2.2.1 对单株地上部鲜质量的影响 由图1可以看出:0、28、56和112 mg·kg-1Cd胁迫下接菌组(接种浓度为1.0×108CFU·mL-1的DJ515-2菌悬液)芥菜的单株地上部鲜质量均高于对照组(未接种DJ515-2菌悬液),分别较对照组升高了125.4%、121.9%、40.8%和14.2%,其中,0和28 mg·kg-1Cd胁迫下接菌组的单株地上部鲜质量显著 (P<0.05)高于对照组。随着Cd质量浓度的提高,对照组和接菌组的单株地上部鲜质量总体上逐渐降低;并且,在0和28 mg·kg-1Cd胁迫下对照组和接菌组的单株地上部鲜质量总体上显著高于56和112 mg·kg-1Cd胁迫。

: 对照组(未接种DJ515-2菌悬液) The control group (not inoculating DJ515-2 fungal suspension); : 接菌组(接种浓度为1.0×108 CFU·mL-1的DJ515-2菌悬液) Inoculation group (inoculating DJ515-2 fungal suspension with concentration of 1.0×108 CFU·mL-1). 不同大写字母表示在相同质量浓度Cd胁迫下接菌组和对照组间同一指标差异显著(P<0.05) Different capitals indicate the significant difference in the same index between inoculation group and the control group under the same mass concentration of Cd stress (P<0.05); 不同小写字母表示在不同质量浓度Cd胁迫下接菌组或对照组的同一指标差异显著(P<0.05) Different lowercases indicate the significant difference in the same index in inoculation group or the control group under different mass concentrations of Cd stress (P<0.05).图1 聚多曲霉菌对不同质量浓度Cd胁迫下芥菜单株质量的影响Fig. 1 Effect of Aspergillus sydowii (Bain. et Sart.) Thom et Church on weight per plant of Brassica juncea (Linn.) Czern. under different mass concentrations of Cd stress
2.2.2 对单株地下部鲜质量的影响 由图1还可以看出:0、28、56和112 mg·kg-1Cd胁迫下接菌组芥菜的单株地下部鲜质量均高于对照组,分别较对照组升高了25.1%、54.2%、11.7%和62.4%,其中,0、28和112 mg·kg-1Cd胁迫下接菌组的单株地下部鲜质量显著高于对照组。随着Cd质量浓度的提高,对照组的单株地下部鲜质量波动变化,接菌组的单株地下部鲜质量在0~28 mg·kg-1Cd胁迫下升高、在28~112 mg·kg-1Cd胁迫下降低,并在28 mg·kg-1Cd胁迫下达到最高值,其中,在0、28和56 mg·kg-1Cd胁迫下对照组和接菌组的单株地下部鲜质量差异不显著,但显著高于112 mg·kg-1Cd胁迫。
2.2.3 对单株地上部干质量的影响 由图1还可以看出:0、28、56和112 mg·kg-1Cd胁迫下接菌组芥菜的单株地上部干质量均高于对照组,分别较对照组升高了133.6%、114.9%、39.0%和6.7%,其中,0、28和56 mg·kg-1Cd胁迫下接菌组的单株地上部干质量显著高于对照组。随着Cd质量浓度的提高,对照组和接菌组的单株地上部干质量总体上逐渐降低,其中,0、28、56和112 mg·kg-1Cd胁迫下对照组的单株地上部干质量差异不显著,而0和28 mg·kg-1Cd胁迫下接菌组的单株地上部干质量则显著高于56和112 mg·kg-1Cd胁迫。
2.2.4 对单株地下部干质量的影响 由图1还可以看出:0、28、56和112 mg·kg-1Cd胁迫下接菌组芥菜的单株地下部干质量均高于对照组,分别较对照组升高了51.7%、82.4%、31.3%和21.4%,其中,0和28 mg·kg-1Cd胁迫下接菌组的单株地下部干质量显著高于对照组。随着Cd质量浓度的提高,对照组和接菌组的单株地下部干质量均逐渐降低,其中,28、56和112 mg·kg-1Cd胁迫下对照组和接菌组的单株地下部干质量总体上差异不显著,但显著低于0 mg·kg-1Cd胁迫。
2.3 聚多曲霉菌对Cd胁迫下芥菜Cd含量的影响
聚多曲霉对不同质量浓度Cd胁迫下芥菜Cd含量的影响见图2。
2.3.1 对地上部Cd含量的影响 由图2可以看出:0、28、56和112 mg·kg-1Cd胁迫下接菌组(接种浓度为1.0×108CFU·mL-1的DJ515-2菌悬液)芥菜的地上部Cd含量均高于对照组(未接种DJ515-2菌悬液),分别较对照组升高了33.7%、4.3%、19.5%和35.7%,其中,不同质量浓度Cd胁迫下接菌组和对照组的地上部Cd含量差异均不显著。随着Cd质量浓度的提高,对照组和接菌组的地上部Cd含量均逐渐升高;并且,0和28 mg·kg-1Cd胁迫下对照组和接菌组的地上部Cd含量差异显著(P<0.05),并显著低于56和112 mg·kg-1Cd胁迫。

: 对照组(未接种DJ515-2菌悬液) The control group (not inoculating DJ515-2 fungal suspension); : 接菌组(接种浓度为1.0×108 CFU·mL-1的DJ515-2菌悬液) Inoculation group (inoculating DJ515-2 fungal suspension with concentration of 1.0×108 CFU·mL-1). 不同大写字母表示在相同质量浓度Cd胁迫下接菌组和对照组间同一指标差异显著(P<0.05) Different capitals indicate the significant difference in the same index between inoculation group and the control group under the same mass concentration of Cd stress (P<0.05); 不同小写字母表示在不同质量浓度Cd胁迫下接菌组或对照组的同一指标差异显著(P<0.05) Different lowercases indicate the significant difference in the same index in inoculation group or the control group under different mass concentrations of Cd stress (P<0.05).图2 聚多曲霉菌对不同质量浓度Cd胁迫下芥菜Cd含量的影响Fig. 2 Effect of Aspergillus sydowii (Bain. et Sart.) Thom et Church on Cd content in Brassica juncea (Linn.) Czern. under different mass concentrations of Cd stress
2.3.2 对地下部Cd含量的影响 由图2还可以看出:0、28、56和112 mg·kg-1Cd胁迫下接菌组芥菜的地下部Cd含量均高于对照组,分别较对照组升高了29.2%、49.8%、55.8%和30.6%,其中,28、56和112 mg·kg-1Cd胁迫下接菌组的地下部Cd含量显著高于对照组。随着Cd质量浓度的提高,对照组和接菌组的地下部Cd含量总体上逐渐升高;并且,0、28和56 mg·kg-1Cd胁迫下对照组和接菌组的地下部Cd含量差异不显著,但显著低于112 mg·kg-1Cd胁迫。
2.4 聚多曲霉菌对Cd胁迫下芥菜单株Cd吸收量的影响
聚多曲霉对不同质量浓度Cd胁迫下芥菜单株Cd吸收量的影响见图3。由图3可以看出:0、28、56和112 mg·kg-1Cd胁迫下接菌组(接种浓度为1.0×108CFU·mL-1的DJ515-2菌悬液)芥菜的单株Cd吸收量均高于对照组(未接种DJ515-2菌悬液),分别较对照组升高了121.8%、107.8%、45.2%和84.7%;0和28 mg·kg-1Cd胁迫下接菌组的单株Cd吸收量显著(P<0.05)高于对照组,而56和112 mg·kg-1Cd胁迫下接菌组的单株Cd吸收量略高于对照组。随着Cd质量浓度的提高,对照组和接菌组的单株Cd吸收量总体上呈逐渐升高的趋势;并且,56和112 mg·kg-1Cd胁迫下对照组的单株Cd吸收量显著高于0 mg·kg-1Cd胁迫,28、56和112 mg·kg-1Cd胁迫下接菌组的单株Cd吸收量显著高于0 mg·kg-1Cd胁迫。

: 对照组(未接种DJ515-2菌悬液) The control group (not inoculating DJ515-2 fungal suspension); : 接菌组(接种浓度为1.0×108 CFU·mL-1的DJ515-2菌悬液) Inoculation group (inoculating DJ515-2 fungal suspension with concentration of 1.0×108 CFU·mL-1). 不同大写字母表示在相同质量浓度Cd胁迫下接菌组和对照组间单株Cd吸收量差异显著(P<0.05) Different capitals indicate the significant difference in Cd uptake per plant between inoculation group and the control group under the same mass concentration of Cd stress (P<0.05); 不同小写字母表示在不同质量浓度Cd胁迫下接菌组或对照组的单株Cd吸收量差异显著(P<0.05) Different lowercases indicate the significant difference in Cd uptake per plant in inoculation group or the control group under different mass concentrations of Cd stress (P<0.05).图3 聚多曲霉菌对不同质量浓度Cd胁迫下芥菜单株Cd吸收量的影响Fig. 3 Effect of Aspergillus sydowii (Bain. et Sart.) Thom et Church on Cd uptake per plant of Brassica juncea (Linn.) Czern. under different mass concentrations of Cd stress
2.5 聚多曲霉菌对Cd胁迫下芥菜根际土壤有效态Cd含量的影响
由于0 mg·kg-1Cd胁迫下根际土壤中的有效态Cd几乎完全被芥菜吸收,导致芥菜根际土壤的有效态Cd含量极低(接近0 mg·kg-1),因此,仅对28、56和112 mg·kg-1Cd胁迫下接菌组(接种浓度为1.0×108CFU·mL-1的DJ515-2菌悬液)和对照组(未接种DJ515-2菌悬液)芥菜根际土壤的有效态Cd含量进行了统计分析,结果见图4。由图4可以看出:28、56和112 mg·kg-1Cd胁迫下接菌组芥菜根际土壤的有效态Cd含量均高于对照组,分别较对照组升高了36.3%、26.7%和4.3%,其中,28 mg·kg-1Cd胁迫下接菌组的根际土壤有效态Cd含量显著(P<0.05)高于对照组,而56和112 mg·kg-1Cd胁迫下对照组和接菌组的根际土壤有效态Cd含量差异不显著。随着Cd质量浓度的提高,对照组和接菌组的根际土壤有效态Cd含量逐渐升高;并且,28、56和112 mg·kg-1Cd胁迫下对照组和接菌组的根际土壤有效态Cd含量差异显著。

: 对照组(未接种DJ515-2菌悬液) The control group (not inoculating DJ515-2 fungal suspension); : 接菌组(接种浓度为1.0×108 CFU·mL-1的DJ515-2菌悬液) Inoculation group (inoculating DJ515-2 fungal suspension with concentration of 1.0×108 CFU·mL-1). 不同大写字母表示在相同质量浓度Cd胁迫下接菌组和对照组间根际土壤有效态Cd含量差异显著(P<0.05) Different capitals indicate the significant difference in available Cd content in rhizosphere soil between inoculation group and the control group under the same mass concentration of Cd stress (P<0.05); 不同小写字母表示在不同质量浓度Cd胁迫下接菌组或对照组的根际土壤有效态Cd含量差异显著(P<0.05) Different lowercases indicate the significant difference in available Cd content in rhizosphere soil in inoculation group or the control group under different mass concentrations of Cd stress (P<0.05).图4 聚多曲霉菌对不同质量浓度Cd胁迫下芥菜根际土壤有效态Cd含量的影响Fig. 4 Effect of Aspergillus sydowii (Bain. et Sart.) Thom et Church on available Cd content in rhizosphere soil of Brassica juncea (Linn.) Czern. under different mass concentrations of Cd stress
3 讨论和结论
种子活力指数能够综合反映植物种子的发芽和生长状况,是能够较全面评价植物种子活力的重要指标。本研究中,在1 mmol·L-1Cd胁迫下,接菌组(接种浓度为1.0×108CFU·mL-1的DJ515-2菌悬液)芥菜的种子活力指数较对照组(未接种DJ515-2菌悬液)升高了83.7%,说明聚多曲霉菌菌株DJ515-2能够提高芥菜种子的生命力,增强其对复杂土壤环境的适应能力,利于盆栽期间芥菜的生长和发育。通常情况下,重金属元素对植物根部的细胞分裂具有抑制作用,从而阻碍植株根系生长[9]。真菌能够分泌一些多胺类物质,利于植物根部细胞分裂,从而促进根的伸长生长[8]。本研究中,接菌组芥菜的根长明显高于对照组,较对照组升高了52.4%,这可能是由于聚多曲霉菌菌株DJ515-2能够分泌一些多胺类化合物,从而促进芥菜幼苗根的伸长生长,具体作用机制有待进一步深入研究。
杨榕[10]的研究结果表明:植物生长直接影响重金属污染土壤的修复效果。与对照组相比,接菌组芥菜单株地上部和地下部的鲜质量和干质量均不同程度升高,且在0和28 mg·kg-1Cd胁迫下显著(P<0.05)升高;但是,随着Cd质量浓度的提高,对照组和接菌组的单株地上部和地下部的鲜质量和干质量总体上逐渐下降,说明聚多曲霉菌菌株DJ515-2对芥菜生长有一定影响,且该菌株利于芥菜修复低浓度(28 mg·kg-1)Cd污染土壤。相关研究结果表明:真菌通过自身产生的吲哚乙酸、铁载体、溶磷能力和1-氨基环丙烷-1-羧酸脱氨酶(ACC脱氨酶)等促进植物生长[11],并且能够分泌一些特殊物质提高植物对胁迫环境的抗性[12],从而确保植物正常生长,关于聚多曲霉菌菌株DJ515-2对芥菜是否也有这种作用尚不清楚,有待进一步研究。
目前,关于曲霉属真菌在植物修复重金属污染土壤中的作用存在很大争议。Xie等[13]认为,曲霉属真菌能够将土壤中的重金属元素固定,抑制重金属元素迁移;而Li等[14]和Liu等[15]认为,曲霉属真菌能够提高植物体内的Cd含量,促进植物对Cd的吸收。本研究中,不同质量浓度Cd胁迫下接菌组芥菜地上部和地下部的Cd含量均高于对照组,并且,28、56和112 mg·kg-1Cd胁迫下接菌组的地下部Cd含量显著高于对照组,说明聚多曲霉菌菌株DJ515-2能够促进芥菜对土壤中Cd的吸收。
单株重金属元素吸收量是评价植物修复污染土壤效果的重要指标[16]。本研究中,不同质量浓度Cd胁迫下接菌组芥菜的单株Cd吸收量均高于对照组,并且,28 mg·kg-1Cd胁迫下接菌组的单株Cd吸收量显著高于对照组,较对照组升高了107.8%,明显高于接种相关菌株后其他植物单株Cd吸收量的增幅[17-18],说明聚多曲霉菌菌株DJ515-2对芥菜吸收土壤中的Cd具有明显的促进作用。
一般情况下,重金属元素通常以不同化学形态存在于土壤中,然而重金属元素只有转化成有效态才能够被植物吸收[19],因此,可利用有效态重金属元素含量评价重金属污染土壤的环境风险、生物有效性和毒性,进而判定土壤的污染状况[20]。相关研究结果表明:真菌被接种到土壤后,可通过分泌的有机酸及自身的代谢活动来提高土壤中重金属元素的生物有效性[21-22]。本研究中,28、56和112 mg·kg-1Cd胁迫下接菌组芥菜根际土壤的有效态Cd含量均高于对照组,其中,28 mg·kg-1Cd胁迫下接菌组根际土壤有效态Cd含量显著高于对照组,较对照组升高了36.3%,说明聚多曲霉菌菌株DJ515-2能够显著提高芥菜根际土壤中的有效态Cd含量。土壤中有效态Cd含量的增加可导致植物吸收更多的Cd2+,从而抑制植株生长,这可能是芥菜单株地上部和地下部的鲜质量和干质量随Cd质量浓度提高而逐渐降低的主要原因。
综上所述,聚多曲霉菌菌株DJ515-2能够提高芥菜的种子活力,促进其种子萌发。在不同质量浓度Cd胁迫下,该菌株对芥菜的生长和Cd吸收均有一定的促进作用,并能够提高土壤中Cd的生物有效性,对芥菜修复低浓度(28 mg·kg-1)Cd污染土壤具有明显的促进效果。

