UPLC-MS/MS同时测定菟丝子中6种黄酮类成分的含量
张威,付之恬,刘宸光,王博伦,刘润东,范荣华
(1.沈阳医学院公共卫生学院预防医学专业2015级,辽宁 沈阳 110034;2.药学专业2017级;3.预防医学专业2014级;4.卫生检验教研室)
传统中药菟丝子为旋花科植物菟丝子(Cuscuta chinensis Lam.)的干燥成熟种子。传统用于阳痿遗精、尿有余沥、遗尿尿频、腰膝酸软、目昏耳鸣、肾虚胎漏、胎动不安、脾肾虚泻,外治白癜风等[1]。现代药理学研究表明,菟丝子具有壮阳、提高垂体对促性腺激素释放激素(LRH)及卵巢对促黄体生成素(LH)反应性、降压、增强心脏收缩力、延缓白内障形成等作用[2-4]。
菟丝子主要包含黄酮类、糖苷酸类、木脂素类与多糖类成分[5-8]。其中黄酮类化合物为菟丝子的主要活性成分,主要有紫云英苷、金丝桃苷、槲皮苷、槲皮素等[9]。药理研究表明,菟丝子黄酮类成分具有抗衰老、增强机体免疫、促进成骨细胞活性、保护血管与调节内分泌等作用[10-12]。其中的槲皮苷具有抗氧化清除自由基、镇静催眠、抗动脉粥样硬化[13-15]等多种生物学活性,槲皮素对去甲肾上腺促人血管平滑肌细胞增殖有抑制作用[16]。由此可见,对菟丝子中黄酮类成分进行质量控制对其合理应用具有重要意义。目前对紫云英苷、金丝桃苷等黄酮类成分的检测主要包括高效液相色谱法及液相色谱-质谱联用法,但检测时间较长,灵敏度不高。因此,本文建立了菟丝子中的6种黄酮类成分含量的高效快速的超高效液相色谱-串联质谱法(UPLC-MS/MS),检测快速、灵敏度高,将为菟丝子中药材的质量控制提供方法依据。同时我省是菟丝子药材的主产地,随着近年来不断发掘的菟丝子新的药理活性,建立准确、高效的菟丝子质量评价方法,使得我省对提高菟丝子的安全性评价研究方法水平,进一步优化菟丝子品种,促进菟丝子的临床合理应用具有重要意义。
1 仪器与材料
1.1 仪器 超高效液相色谱-串联质谱联用仪(美国Waters公司);万分之一天平(德国Sartorius公司,BSA124S);数控超声波清洗器(昆山市超声仪器有限公司,KQ5200DV);电子数显恒温水浴锅(上海宜昌仪器纱筛厂);旋涡混合器(SilentShake,HYQ-2121A);高速离心机(安徽中科中佳科学仪器有限公司,HC-2062)。
1.2 材料 金丝桃苷(Hyperoside)、紫云英苷(Astragalin)、异槲皮苷(Isoquercitrin)、槲皮苷(Quercitrin)、山萘酚(Kaempferol)购自中国食品药品检定研究所;槲皮素(Quercetin,自制,HPLC归一化法测得质量浓度大于98%),同时通过核磁共振和质谱数据确证为槲皮素单体成分。菟丝子购买于沈阳市天益堂大药房。甲醇、甲酸(美国Sigma公司,HPLC级),实验用水为娃哈哈纯净水。
2 方法与结果
2.1 质谱条件 采用电喷雾离子源(ESI),负离子扫描模式下多反应离子检测模式(multiple reaction monitoring,MRM);毛细管电压为3.0 kV,离子源温度为150℃,脱溶剂温度为400℃,脱溶剂气流量为700 L/h,锥孔气流量为50 L/h;碰撞气为氩气,压力为2.95×10-3mbar;准确质量校正采用NaCsI进行校正。
各化合物根据质谱数据确定待测物的定量参数见表1,二级质谱图见图1。
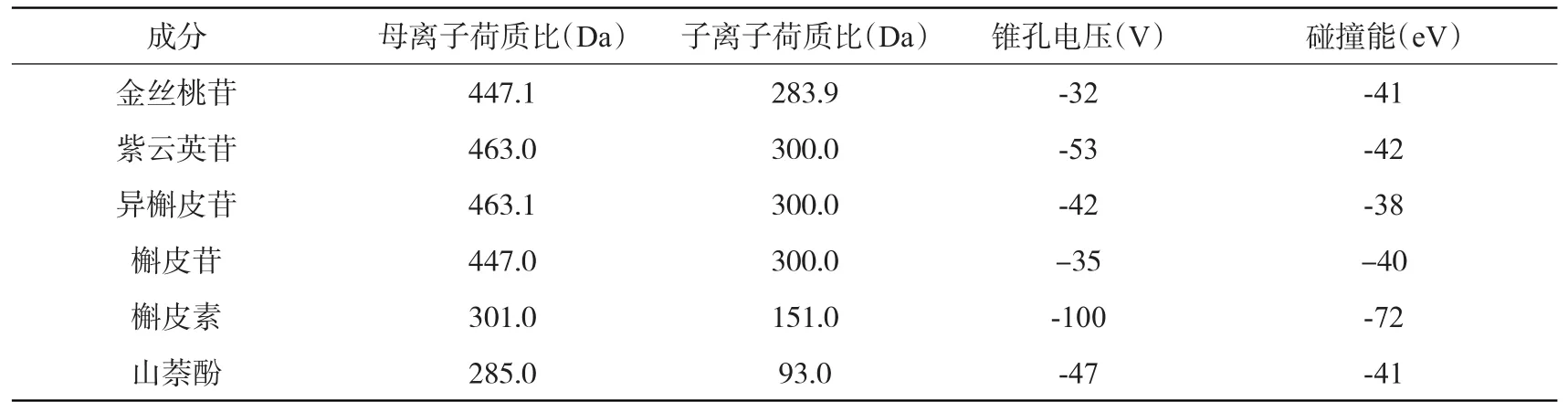
表1 6种黄酮类成分的质谱参数
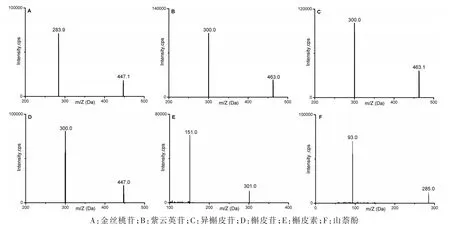
图1 6种黄酮类成分的二级质谱图
2.2 色谱条件 色谱柱:Waters UPLC BEH C18色谱柱(50 mm×2.1 mm,1.7 μm);流动相:A相:甲醇;B相:0.1%甲酸-水。梯度洗脱程序:0~5 min:55%B~20%B;5~5.01 min:20%B~55%B;5.01~6.5 min:55%B,流速:0.3 ml/min。进样量:5 μl;柱温:30℃。各峰与相邻峰的分离度均大于1.5,理论板数测得成分峰计算均不低于3 000。
2.3 对照溶液的制备 取各对照品适量,精密称定,加甲醇制成每1 ml分别含各对照品0.5 mg的混合储备液Ⅰ。精密量取混合储备液1.0 ml,置100 ml量瓶中,加甲醇稀释至刻度,摇匀,得混合5μg/ml对照溶液Ⅱ。
2.4 供试溶液的制备 将菟丝子种子粉碎,取粉末约1.0 g,精密称定,置圆底烧瓶中,精密加入水25 ml,称定重量,浸泡过夜,振摇混匀,加热回流1.5 h,放冷,再称定重量,用水补足减失的重量,涡旋混匀,取上清液经0.22μm微孔滤膜滤过,取续滤液5μl,UPLC-MS/MS进样分析。
2.5 标准曲线的制备 精密量取混合储备液Ⅱ制成浓度为 5、10、50、100、250、500 ng/ml的系列标准溶液,分别UPLC-MS/MS自动进样5μl,以标准溶液浓度(c)为横坐标,色谱峰面积(A)为纵坐标,绘制标准曲线。
结果表明,各化合物在各自的质量浓度范围内线性关系良好。见表2。

表2 6种黄酮类成分的线性范围、标准曲线及相关系数
2.6 精密度试验 UPLC-MS/MS自动进样对照溶液5μl,重复进样6次,记录色谱图,读取各色谱峰峰面积,得到6种黄酮化合物的峰面积RSD%分别 为 1.3%、0.8%、1.4%、0.9%、1.2%、1.7%,表明仪器精密度良好。
2.7 重现性试验 取菟丝子药材粉末,按“2.4供试溶液的制备”项下方法平行制备6份供试品溶液,进样UPLC-MS/MS,记录色谱图,读取各色谱峰峰面积,计算6种黄酮化合物含量的RSD%分别为1.5%、1.8%、1.7%、1.6%、1.9%、1.4%,表明方法重现性良好。
2.8 稳定性试验 按“2.4供试溶液的制备”项下方法制备1份供试品溶液,分别在室温放置0、2、4、6、8、12 h后进样,记录色谱图,读取各色谱峰峰面积,6种黄酮化合物峰面积的RSD%分别为1.2%、1.1%、1.2%、1.4%、1.3%、1.2%,结果表明供试溶液在室温放置12 h内稳定。
2.9 加样回收率试验 称取已知量的菟丝子样品(产地:辽宁沈阳)9份,每份0.5 g,精密称定,分别加入对照品溶液0.5、1.0、2.0 ml,每个样品平行3份,按“2.4供试溶液的制备”项下的方法操作,在上述色谱条件下进样分析,计算6种黄酮化合物的含量,计算加样回收率,各化合物的加样回收率实验结果分别为95.8%、98.2%、94.9%、97.1%、95.1%和95.7%(RSD分别为2.1%、2.2%、2.5%、2.4%、2.7%和2.2%)。
2.10 样品测定 取不同批次的菟丝子样品(产地:辽宁沈阳),按“2.4供试溶液的制备”项下的方法操作,UPLC-MS/MS自动进样供试溶液5μl,在上述色谱条件下进样分析,以标准曲线法计算各成分的含量,结果见表3。
3 讨论
3.1 质谱条件的选择 对待测物质6种黄酮化合物成分进行质谱条件优化,实验发现6种黄酮类化合物在正负离子监测下都能测定,但是在负离子条件下检测响应强于正离子条件,因此选择负离子反应监测。
3.2 液相条件的选择 为了获得更好色谱峰峰形,保留时间和灵敏度,分别对甲醇-水、乙腈-水的等度与梯度条件进行考察,结果表明以甲醇-水梯度洗脱系统色谱峰峰形好,响应高,背景噪音小,同时加入甲酸到水相系统中可以使色谱峰峰形对称性得到提高,通过考察不同含量的甲酸(0.1%、0.2%、0.3%、0.5%),最终确定液相系统为甲醇-0.1%甲酸水梯度洗脱,可达到理想的分离度。
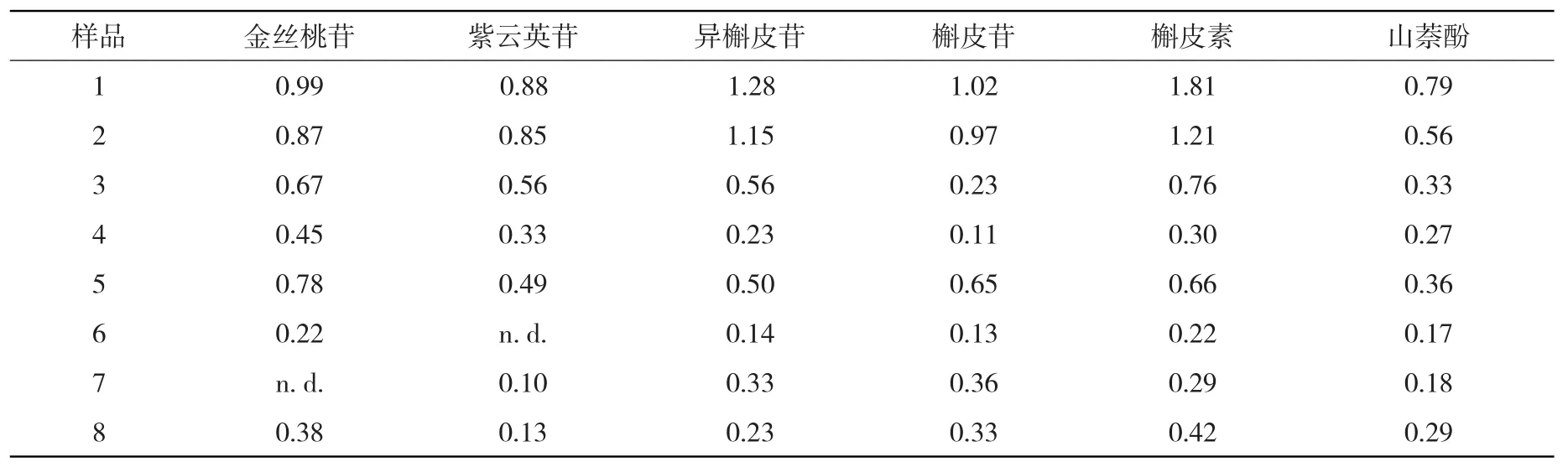
表3 6种黄酮类成分的样品含量(n=3,×10-3mg/g)
因此本研究采用高效灵敏的UPLC-MS/MS技术对不同批次的菟丝子中6种黄酮类化合物成分进行了含量测定,该研究方法将为菟丝子中药材的质量控制提供方法依据,对提高菟丝子的临床合理应用具有重要作用。

