抑制蛋白激酶D1表达水平对高糖诱导心肌细胞凋亡的影响及作用机制
杨佳伟 胡 沛 谢 进 唐 冰
糖尿病心肌病是糖尿病患者发生心力衰竭的重要原因,发病机制十分复杂,与心肌细胞凋亡有关,炎症反应、代谢紊乱、神经功能紊乱等均参与其中[1,2]。糖尿病患者持续的高血糖会引起心肌细胞凋亡增加,造成心肌损伤,引发心血管系统疾病[3]。蛋白激酶D1(Protein Kinase D1,PKD1)是PKD蛋白家族成员之一,是一种钙离子依赖的蛋白激酶,在信号转导、蛋白运输、核膜转位、细胞凋亡、细胞分化等方面均具有生物学作用,参与心血管系统疾病的发生,上调其表达后可以促进大鼠心功能恶化[4,5]。内分泌因子、代谢异常、高血糖等都可以激活糖尿病患者体内PKD1的表达,PKD1可能参与糖尿病心肌病心肌细胞凋亡过程[6,7]。本实验通过检测高糖作用后心肌细胞中PKD1的表达水平,并通过siRNA下调心肌细胞中PKD1的表达,探讨PKD1在高糖诱导的心肌细胞凋亡中的作用,为明确糖尿病心肌损伤发生机制提供实验依据。
1 材料与方法
1.1 主要材料
PKD1引物由南京金斯瑞合成;qRT-PCR试剂盒购自大连宝生物(批号:639652);心肌细胞H9c2购自中科院细胞库;DMEM购自北京Macgene(生产商美国Sigma,批号:D0422);Annexin V-FITC/PI凋亡试剂盒购自上海联科生物(批号:70-AP101-100);32132ECL发光试剂盒购自美国Thermo Fisher公司(批号:32132);p38丝裂原活化蛋白激酶(p38 Mitogen-activated Protein Kinases,p38MAPK)信号通路抑制剂SB203580购自美国Sigma公司(批号:S32132);11668019 Lipfectamine 2000购自美国Invitrogen公司(批号:116688019);p38丝裂原活化蛋白激酶(p38MPAK)抗体、磷酸化p38MAPK(p-p38MAPK)抗体、PKD1抗体、 Bcl-2相关X蛋白(Bcl-2 Associated X Protein,Bax)抗体购自美国Cell Signaling Technology公司(批号分别为:9219、8632、90039、2774)。
1.2 细胞转染和分组
采用10%胎牛血清的DMEM培养基培养大鼠心肌细胞H9c2,细胞接种密度为1×105个/ml,培养细胞浓度为60%时,用0.25%的胰蛋白酶消化传代至第3代细胞,在细胞中分别转染PKD1 siRNA和siRNA control,转染方法按照Lipfectamine 2000转染试剂说明书,转染后12h,用高糖培养液(含有33mmol/L的葡萄糖)培养细胞24h,记为si-PKD1组、si-NC组。转染PKD1 siRNA 12h后加入p38MAPK信号通路抑制剂SB203580,再加高糖培养液培养24h为si-PKD1+SB203580组。同时用高糖培养液培养的未行转染的H9C2细胞记为HG组,正常培养糖浓度5.6mmol/L的未转染心肌细胞为Control组。每组3个复孔,均培养24h。
1.3 qRT-PCR测定心肌细胞PKD1 mRNA水平
Control、HG、si-NC和si-PKD1组细胞条件培养24h后,以RNA提取试剂盒提取细胞总RNA,采用分光光度计法测定OD260nm/OD280nm值介于1.8-2.0。反转录合成cDNA,进行qRT-PCR,步骤同试剂盒说明书。PKD1引物序列如下:上游5’-GCA TGA GCT AGC CTA CAG CC-3’,下游 5’-ATG CCG TGG ATA CTT GGA-3’。内参基因为GAPDH。采用2-△△Ct法计算各组细胞PKD1 mRNA相对表达水平。
1.4 Western blot测定心肌细胞中PKD1蛋白水平
各组细胞培养24h后,加入200μl细胞裂解液,超声破碎后,4℃、12 000g离心10min。用Bradford法测定蛋白浓度,-80℃保存待检。检测前室温复融,蛋白样品(30μg)与上样缓冲液混合后,100℃作用10min。选用5%的浓缩胶和10%的分离胶,在浓缩胶中电压用80V,在分离胶中电压用120V。电泳160min后,取出凝胶进行转膜,80V转膜120min。转膜后将NC膜于5%牛血清白蛋白室温孵育120min。随后于PKD1(1∶400)抗体4℃孵育过夜。再与二抗(1∶2 000)室温孵育120min,ECL显色,X光片曝光。对蛋白灰度值进行分析,以GAPDH为参照,用Image J软件分析PKD1蛋白水平,用PKD1灰度值与GAPDH灰度值的比值表示PKD1蛋白水平。
1.5 流式细胞术测定细胞凋亡
通过Annexin V-FITC/PI检测细胞凋亡,具体步骤如下:Control、HG、si-NC、si-PKD1及si-PKD1+SB203580组细胞条件培养24h后加入0.25%的胰蛋白酶,1 000g离心5min。PBS洗涤2次,在细胞中加入200μl含2.5μl Annexin V-FITC缓冲液,室温孵育15min。再加入5μl PI,室温孵育10min后,立即用流式细胞仪检测。Annexin V-FITC用于检测凋亡和坏死细胞,PI染料用于区分早期、晚期凋亡细胞。
1.6 Western blot测定细胞中p38MAPK磷酸化和Bax蛋白表达水平
参照上述1.4中步骤,采用Western blot法检测Control、HG、si-NC、si-PKD1及si-PKD1+SB203580组细胞中p-p38MAPK、p38MAPK和Bax蛋白表达水平,p-p38MAPK、p38MAPK抗体以1∶600稀释,Bax抗体以1∶800稀释。
1.7 统计学处理

2 结果
2.1 各组心肌细胞PKD1 mRNA和蛋白水平比较
HG组PKD1 mRNA和蛋白水平均高于Control组,差异均有统计学意义(t=11.13、3.74,P<0.01)。si-NC组与HG组心肌细胞PKD1 mRNA和蛋白水平差异无统计学意义(t=0.27、0.98,P>0.05)。si-PKD1组心肌细胞PKD1 mRNA和蛋白水平均低于HG组细胞,差异均有统计学意义(t=12.25、5.51,P<0.01)。见图1和表1。
2.2 各组心肌细胞凋亡率及Bax蛋白表达水平比较

图1 各组心肌细胞PKD1蛋白水平(Western blot)
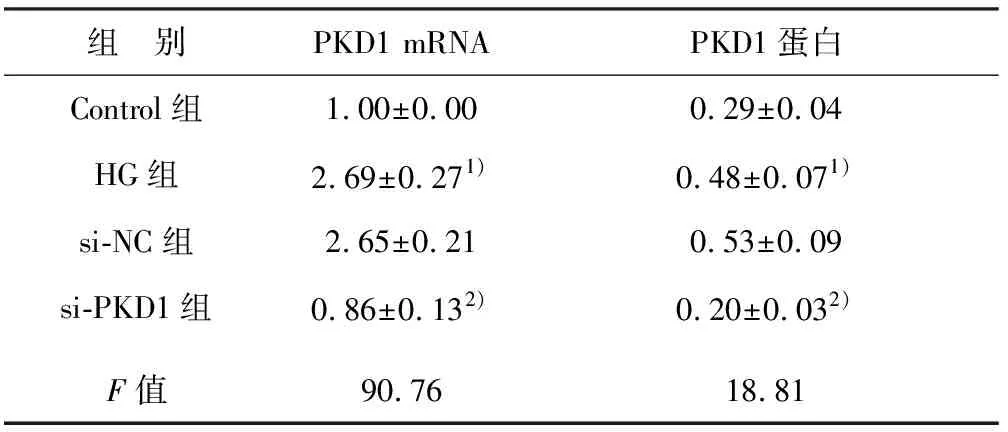
组 别PKD1 mRNAPKD1蛋白Control组1.00±0.000.29±0.04HG组2.69±0.271)0.48±0.071)si-NC组2.65±0.210.53±0.09si-PKD1组0.86±0.132)0.20±0.032)F值90.7618.81
注:与Control组比较,1)P<0.01;与HG组比较,2)P<0.01
各组心肌细胞凋亡率及Bax蛋白水平差异有统计学意义(P<0.01)。HG组细胞凋亡率和Bax蛋白水平均明显高于Control组(t=16.76、11.18,P<0.01),si-NC组与HG组细胞凋亡率和Bax蛋白水平差异无统计学意义(t=0.71、0.89,P>0.05);si-PKD1组细胞凋亡率和Bax蛋白水平均明显低于HG组(t=0.31、5.81,P<0.01)。见图2、图3、表2。

图2 各组心肌细胞凋亡(流式细胞术)

图3 各组心肌细胞Bax蛋白表达(Western blot)

组 别凋亡率(%)Bax蛋白Control组5.17±0.630.18±0.03HG组32.42±2.491)0.43±0.061)si-NC组33.58±4.650.41±0.05si-PKD1组22.16±3.212)0.32±0.042)si-PKD1+SB203580组10.36±1.063)0.20±0.063)F值61.80826.660
注:与Control组比较,1)P<0.01;与HG组比较,2)P<0.01;与si-PKD1组比较,3)P<0.01
2.3 各组心肌细胞p38MAPK、p-p38MAPK蛋白水平比较
各组p-p38MAPK和p-p38MAPK/p38MAPK水平差异有统计学意义(P<0.01),各组间p38MAPK水平差异无统计学意义(P>0.05)。与Control组比较,HG组p-p38MAPK、p-p38MAPK/p38MAPK水平均升高(t=6.90、6.84,P<0.01);与HG组比较,si-NC组p-p38MAPK、p-p38MAPK/p38MAPK水平差异无统计学意义(t=0.38、0.38,P>0.05),si-PKD1组p-p38MAPK、p-p38MAPK/p38MAPK水平均降低。与si-PKD1组比较,si-PKD1+SB203580组p-p38MAPK、p-p38MAPK/p38MAPK水平进一步降低,差异有统计学意义(t=6.52、4.18,P<0.01)。见图4和表3。

图4 各组心肌细胞中p-p38MAPK、p38MAPK蛋白水平(Western blot)
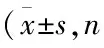
表3 各组心肌细胞中p-p38MAPK/p38MAPK水平均=3)
注:与Control组比较,1)P<0.01;与HG组比较,2)P<0.01;与si-PKD1组比较,3)P<0.01
3 讨论
PKD1属于胞浆丝/苏氨酸蛋白酶激酶,与细胞膜上的相应受体结合后被激活,通过影响下游靶基因和信号的转导发挥不同的生物学特性[8]。目前研究表明,PKD1具有促进细胞凋亡以及抑制细胞生长的作用,参与细胞内转录因子的激活、抗氧化蛋白的表达、高尔基复合体功能维持等[9]。敲除PKD1的小鼠心肌肥厚程度降低,心功能得到改善[10,11];在糖尿病心肌病大鼠模型中发现PKD1过度表达,而厄贝沙坦可以通过下调PKD1的表达发挥保护心功能的作用[12];黄芪提取物具有保护心肌细胞的作用,并且能够下调心肌细胞中PKD1 mRNA的表达[13];这些研究报道均说明,PKD1促进心肌损伤,并且可能与促心肌细胞凋亡有关。本实验的研究报道显示,高糖作用后心肌细胞PKD1表达水平升高,与上述报道结果相符合。
糖尿病心肌病的发病机制与心肌细胞的能量代谢和脂代谢、肾素-血管紧张素-醛固酮系统激活、钙离子超载、氧化应激等有关,而心肌细胞凋亡是糖尿病心肌病的重要病理变化,在糖尿病心肌病患者、糖尿病心肌病大鼠模型中均发现有心肌细胞过度凋亡,心肌细胞中促凋亡蛋白Bax表达水平升高[14,15]。很多研究报道表明PKD1参与心肌肥厚发生过程,并且其表达水平的高低与心肌细胞的凋亡水平呈正相关[16]。本实验采用流式细胞术检测发现,高糖作用后的心肌细胞凋亡率升高,并且心肌细胞中促凋亡蛋白Bax的表达水平也升高,而下调PKD1后的心肌细胞凋亡率降低,细胞中Bax的蛋白水平也降低,下调PKD1通过减少Bax的表达抑制高糖诱导的心肌细胞凋亡。
p38MAPK是MAPK信号通路的亚类之一,有研究显示,p38MAPK在心肌组织损伤中过度磷酸化,在心肌缺血再灌注、糖尿病心肌病、心力衰竭等过程已经得到证实,抑制p38MAPK信号通路激活可以抑制糖尿病心肌病大鼠心肌细胞凋亡,黄芪改善糖尿病大鼠损伤的同时可以降低p38MAPK信号通路激活的激活水平[17-20]。本次实验结果显示,高糖诱导心肌细胞中p38MAPK磷酸化,下调PKD1可以降低细胞中p38MAPK的磷酸化水平,并且p38MAPK信号通路抑制剂可以协同下调PKD1减少高糖环境下的心肌细胞凋亡,下调PKD1通过抑制p38MAPK信号通路减少高糖诱导的心肌细胞凋亡。
综上所述,PKD1参与糖尿病心肌病发生过程,下调其表达可以减少高糖诱导的心肌细胞凋亡,其作用机制可能是通过抑制p38MAPK信号通路实现的。对于PKD1是如何靶向调控p38MAPK信号通路还需进一步研究和探讨。
◀