原花青素B1与B2抑制脂多糖诱导的BV-2细胞炎症反应作用的比较*
王 青, 宋丽娟, 李艳花, 杨智超, 王 婧, 刘建春, 姜维佳, 马存根△
(1山西中医药大学国家中医药管理局多发性硬化益气活血重点研究室, 山西 太原 030024;2山西医科大学第一临床医学院神经科, 山西 太原 030001;3大同大学脑科学研究所, 山西 大同 037009)
原花青素(proanthocyanidins/procyanidins,PC)是广泛存在于葡萄籽、松树皮、莲房、苹果、蓝莓、黑枸杞和蔷薇果等植物组织器官中的、由不同数目黄烷-3-醇类化合物(儿茶素、表儿茶素或没食子酸)缩合而成的多酚类化合物。根据缩合数量的多少,将其二至四聚体称为原花青素低聚体(oligomeric proanthocyanidins,OPCs),五聚体以上的称为原花青素高聚体(polymeric proanthocyanidins,PPCs)。PC由于其强大的抗氧化活性而被人们发现和研究,其对氧自由基有很强的清除能力,抗氧化能力远远强于维生素C和维生素E。除此之外,药理学研究发现,PC在防治肿瘤、心血管疾病、抗炎及调节免疫等方面具有显著功效[1],且相对于PPCs和OPCs具有更强的生物活性。
目前的研究主要关注PC的作用机制,而其效应主要通过哪些成分起作用尚不知道。OPCs中研究最多的是PC二聚体。组成二聚体的单体,由于分子构象和键合部位的不同,存在着多种异构体,其中关于原花青素B1 (PC-B1)和B2 (PC-B2)的研究最为广泛。它们是由C4→C8键合的同分异构体,是活性较强的二聚体,能透过血脑屏障,顺利到达中枢神经系统,都具有强大的抗氧化和抗炎的作用[2-3]。但作为同分异构体,它们的药理活性的区别和对比研究却很少,只有Shilpi等[4]报道PC-B2具有更强的抗恶性肿瘤活性。本研究以脂多糖(lipopolysaccharide,LPS)激活的小胶质细胞系BV-2炎症模型为研究对象,试图从抗炎方面观察比较PC-B1和PC-B2活性的强弱,为其作用于神经炎症提供理论依据。
材 料 和 方 法
1 材料与仪器
CO2培养箱(Thermo);全波长酶标仪(Molecular Devices);垂直电泳槽、小型湿法转膜仪和基础通用电源(Bio-Rad);凝胶成像系统(Tanon)。DMEM培养基(Gibco);BV-2细胞(武汉大学细胞库);脂多糖和Lysis细胞裂解液(Sigma);胎牛血清(Gibco);MTT(碧云天);MMK-1(Tocris Bioscience);PVDF膜(Milipore);BCA和ECL(Thermo);抗β-actin、p-NF-κB p65(S536)和NF-κB p65抗体(Bioworld);白细胞介素1β(interleukin-1β,IL-1β)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α) ELISA测定试剂盒(R&D);DAPI(碧云天);辣根过氧化酶标记的羊抗兔 II 抗(Abcom)。
2 实验方法
2.1MTT实验 高糖DMEM培养液(含10% 胎牛血清)培养BV-2细胞,调整细胞密度为5×108/L,接种于96孔细胞培养板,每孔100 μL,隔夜培养后,各孔分别加入浓度为2.5、5、10、20、30、50和100 mg/L的PC-B1和PC-B2,孵育24 h、48 h和72 h后,各孔加入5%的MTT 10 μL,37 ℃孵育4 h后,弃去培养液,每孔加入100 μL DMSO溶解,在490 nm处检测,测定其吸光度。空白对照(0 mg/L)组加入的是等体积的含有10% 胎牛血清的高糖DMEM。
2.2ELISA法检测IL-1β和TNF-α 取对数生长期的BV-2细胞悬液,调整细胞密度为5×108/L,接种于96孔细胞培养板,每孔100 μL,培养12 h后,加入1 mg/L的 LPS 孵育6 h,再分别加入5、10、20和50 mg/L的PC-B1和PC-B2。设空白对照(control)组、LPS组、LPS+PC-B1组和LPS+PC-B2组,每组3个复孔,继续培养18 h,用ELISA法检测IL-1β和TNF-α的水平。
2.3Transwell趋化实验 取对数生长期的BV-2细胞悬液,接种于35 mm培养皿,设空白组和LPS组,LPS作用6 h后,2组细胞用含有10% 胎牛血清的高糖DMEM重悬,且细胞数分别调整为5×108/L。LPS组被0、20和20 mg/L的PC-B1和PC-B2孵育1 h后,再分别取200 μL细胞置于Transwell小室上室。设空白组、LPS组、LPS+PC-B1组和LPS+PC-B2组,下室以20 μmol/L的MMK-1为趋化剂。在CO2培养箱继续培养24 h,去除培养液,用PBS洗3次,甲醇固定10 min,5 mg/L的DAPI室温孵育20 min后,PBS洗3次,正置荧光显微镜下观察拍照。
2.4Western blot 实验 BV-2细胞接种于60 mm培养皿,用1 mg/L的LPS孵育6 h后,分别再加入20 mg/L的PC-B1和PC-B2, 培养24 h,收集细胞,用RAPI裂解液,提取BV-2细胞总蛋白,采用BCA法检测蛋白浓度。蛋白上样量为20~40 μg,行10% SDS-PAGE分离蛋白,湿法转膜,5%脱脂奶粉封闭,加入I 抗4 ℃过夜,TBST洗3次,室温孵育 II 抗2 h,ECL法检测。
3 统计学处理
应用GraphPad Prism 5.0统计软件进行统计学分析。实验数据用均数±标准误(mean±SEM)表示。单因素方差分析(one-way ANOVA)后,用Dunnett’s test比较实验组与单一对照组间的差异;用SNK-q检验多组间多重比较差异的统计学显著性。以P<0.05为差异有统计学意义。
结 果
1 PC-B1与PC-B2对BV-2细胞活力的影响
不同浓度的PC-B1和PC-B2分别孵育BV-2细胞24 h、48 h和72 h,中、高浓度(30、50和100 mg/L)的药物可显著促进BV-2细胞增殖;随着作用时间延长,低浓度的药物(10和20 mg/L)亦能显著促进BV-2细胞活力(P<0.05或P<0.01),见图1。这表明PC-B1和PC-B2的给药浓度在100 mg/L之内对BV-2细胞的活力随浓度的增加而增强,为后续实验药物浓度的确定提供了依据。
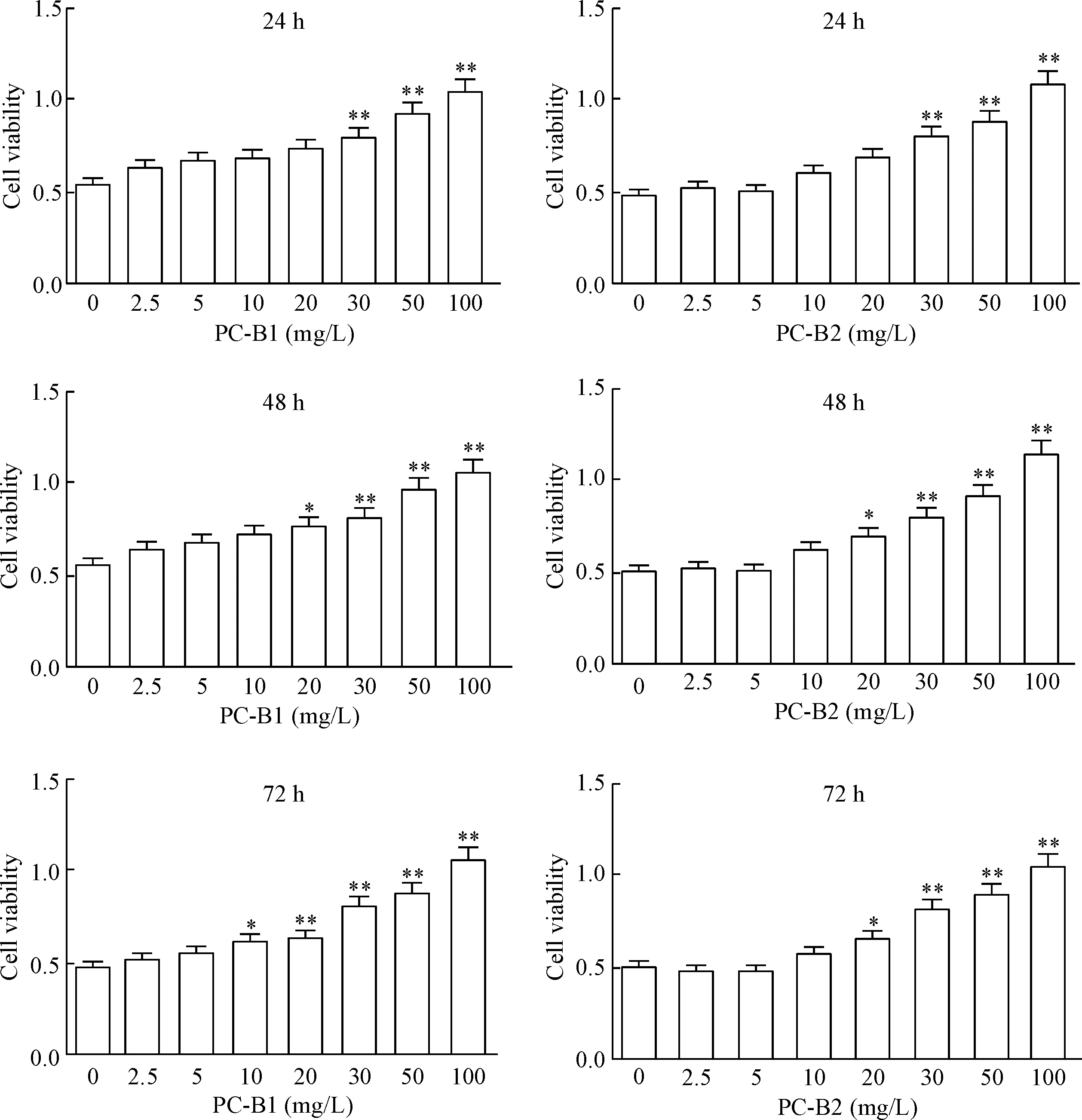
Figure 1. The viability of BV-2 cells incubated with proanthocyanidins B1 and B2 (PC-B1 and PC-B2) for 24 h, 48 h and 72 h. Mean±SEM.n=3.*P<0.05,**P<0.01vs0 mg/L group.
2 PC-B1与PC-B2对BV-2细胞炎症因子分泌的影响
与空白组相比,LPS孵育BV-2细胞后,使细胞上清液中IL-1β和TNF-α的浓度显著升高(P<0.01);不同浓度的PC-B1和PC-B2孵育BV-2细胞后,与LPS组相比较,2种药物均可显著抑制IL-1β和TNF-α的分泌,其中20 mg/L的药物浓度效应最强(P<0.01),见图2。
3 PC-B1与PC-B2对BV-2细胞趋化能力的影响
用甲酰肽受体2(formyl peptide receptor 2,FPR2)特异性的激动剂MMK-1作为趋化剂,考察BV-2细胞的趋化行为。结果表明,MMK-1可诱导LPS刺激的BV-2细胞趋化(P<0.05)。前期实验证明PC-B1和PC-B2最佳作用浓度是20 mg/L,因此趋化实验采用20 mg/L的PC-B1和PC-B2孵育BV-2细胞,结果表明,与LPS组相比较,PC-B1和PC-B2均可显著减少MMK-1诱导的BV-2细胞趋化(P<0.05),见图3。
4 PC-B1与PC-B2对BV-2细胞NF-κB磷酸化的影响
经LPS刺激后,BV-2细胞中NF-κB p65的S536磷酸化增加(P<0.05),而PC-B1和PC-B2(20 mg/L)可显著下调其磷酸化水平(P<0.05),见图4。
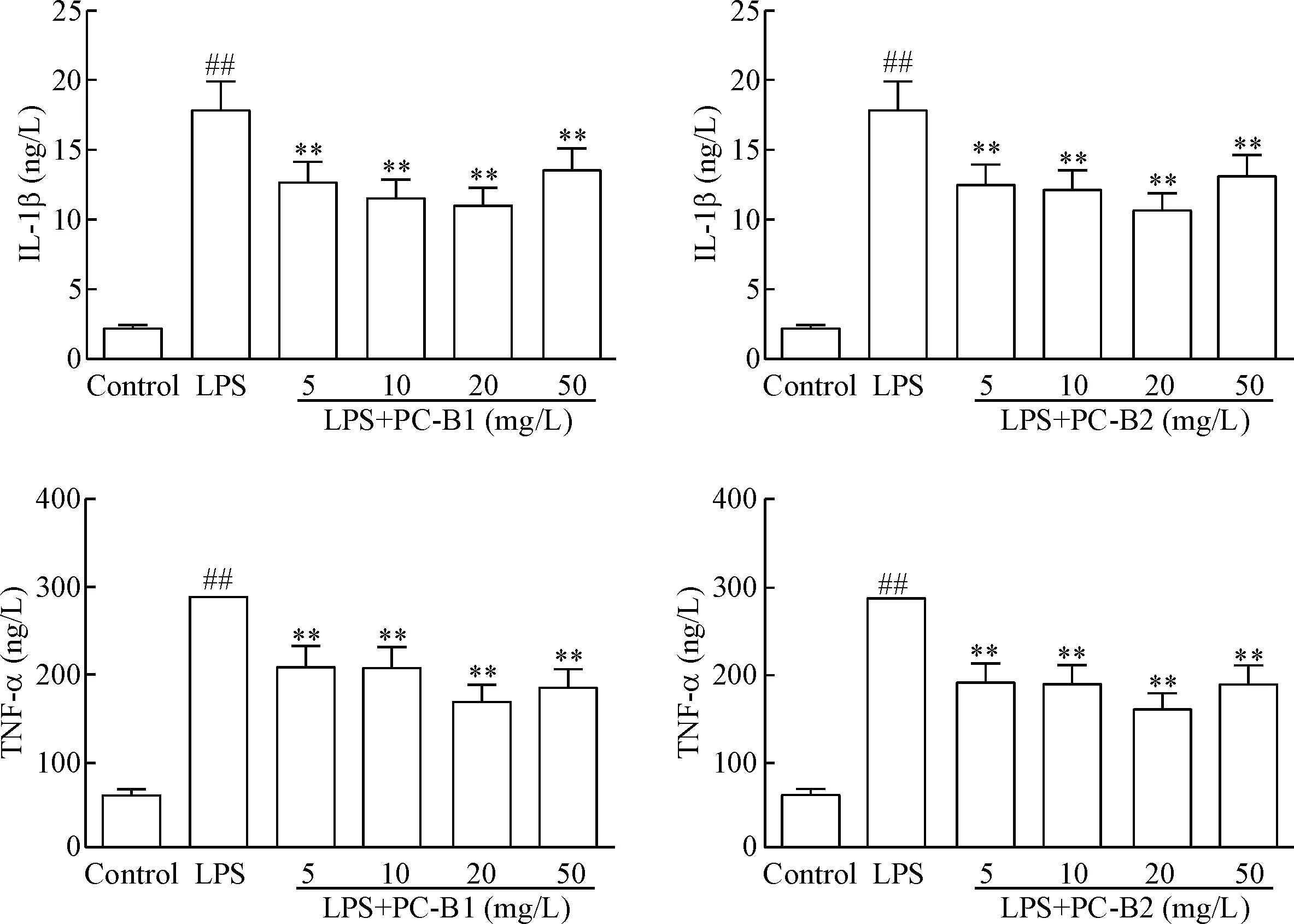
Figure 2. The inhibitory effects of proanthocyanidins B1 and B2 (PC-B1 and PC-B2) on secretion of IL-1β and TNF-α in BV-2 cells induced by LPS. Mean±SEM.n=3.##P<0.01vscontrol group;**P<0.01vsLPS group.
图2原花青素B1和B2对LPS诱导的BV-2细胞炎症因子IL-1β和TNF-α释放的影响
讨 论
神经炎症主要由小胶质细胞介导,小胶质细胞是中枢神经系统的固有免疫细胞,识别异物和有害刺激后,其细胞膜表面与免疫和炎症相关的受体表达急剧增加,如FPR2、晚期糖基化终产物受体(receptor for advanced glycation end products,RAGE)和CD36等[5-6],具有促进宿主防御和修复以及神经毒性的双重作用[7]。异常激活的小胶质细胞,可通过释放大量的炎症因子,趋化更多的炎症细胞进入中枢,引发严重的神经炎症,从而对正常的神经组织造成损伤,加重神经退行性疾病的进展[8]。LPS可诱导BV-2细胞FPR2表达增加,FPR2是G蛋白偶联受体中趋化受体家族中的一员,具有复杂的功能,能通过与不同起源和高度结构多样性的配体结合介导炎症和免疫反应[9-10]。其激动剂MMK-1可通过FPR2趋化和激活中性粒细胞、单核细胞和T细胞,促进IL-1β、IL-6和TNF-α的分泌,促进细胞趋化,发挥促炎的作用[9-10]。因此本研究以MMK-1为趋化剂,考察药物对细胞趋化行为的影响,结果发现MMK-1可以显著趋化LPS刺激的BV-2细胞,而PC-B1与PC-B2可拮抗此效应,表明PC-B1与PC-B2可通过抑制小胶质细胞表面的受体功能,减少免疫细胞的趋化,进而缓解炎症。
此外,研究表明,经LPS诱导的BV-2细胞与原代小胶质细胞非常相似,可激活NF-κB信号转导通路,调控NO生成,促进炎症因子IL-1β和TNF-α的分泌,与T细胞和神经元相互作用,并能刺激其它的神经胶质细胞分泌促炎因子[11]。NF-κB信号通路完全激活与NF-κB p65的磷酸化是分不开的,因此本研究采用LPS激活BV-2细胞的体外神经炎症模型,考察了NF-κB p65中与细胞趋化和炎症因子分泌相关的S536的磷酸化[12],结果表明,LPS诱导的BV-2细胞的炎症反应,有NF-κB的参与,且PC-B1和PC-B2可以抑制NF-κB信号通路的活化。
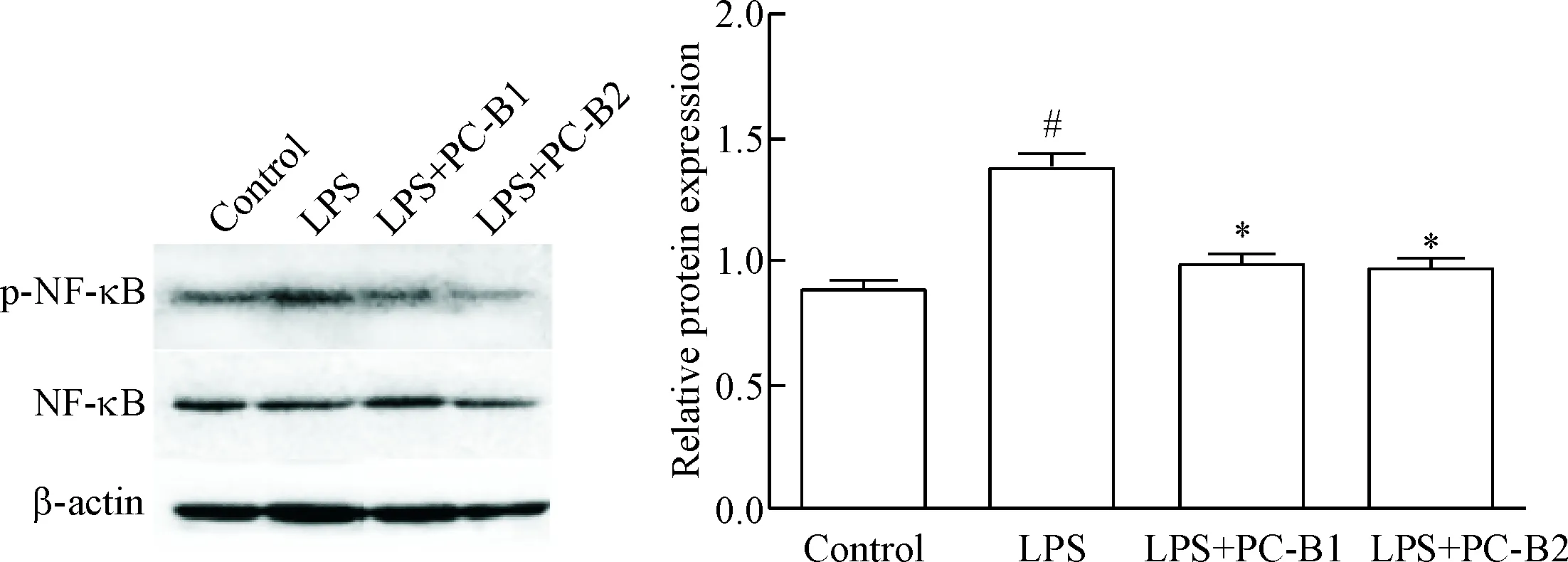
Figure 4. The inhibitory effect of proanthocyanidins B1 and B2 (PC-B1 and PC-B2) on phosphorylation of NF-κB in LPS-induced BV-2 cells. Mean±SEM.n=3.#P<0.05vscontrol group;*P<0.05vsLPS group.
PC-B1与PC-B2均为单一组分,是PC的主要成分。研究它们的药理活性,一方面可以明确PC发挥作用的主要活性成分;另一方面,作为同分异构体,研究PC-B1和PC-B2的药理活性,有利于通过其生物学效应,找到它们相应的作用靶点。本研究发现,PC-B1和PC-B2均具有较强的抑制LPS诱导的BV-2细胞炎症反应的作用,它们都可以显著抑制IL-1β和TNF-α的分泌、BV-2细胞的趋化和NF-κB磷酸化。体外实验证明了PC-B1和PC-B2可以抑制小胶质细胞异常活化所致的神经炎症,它们都是PC发挥药理活性的主要成分,提示PC-B1和PC-B2可能通过抗神经炎症发挥神经保护作用。下一步实验可通过对炎症相关功能蛋白的筛选来研究它们可能的作用靶点,明确它们抑制小胶质细胞异常活化的机制,以期为其成为中枢神经系统疾病的临床防治药物提供可靠依据。

