三七根系分泌物中几种成分对根腐病原菌生长的影响
罗丽芬 江冰冰 邓琳梅 梅馨月 黄惠川 刘屹湘 杨敏 朱书生


摘要:【目的】探究三七根系分泌物對根腐病原菌生长的影响,为解析三七根系分泌物介导的植物与土传病原菌互作机制提供理论依据。【方法】通过根系与病原菌孢子互作的方式研究三七根系对根腐病原菌茄腐镰刀菌F3(Fusarium solani)和恶疫霉菌D-1(Phytophthora cactorum)孢子萌发及芽管生长方向的影响;收集三七根系分泌物并利用气相色谱—飞行时间质谱联用仪(GC-TOF-MS)分析根系分泌物中的成分;通过菌丝生长速率法测定三七根系分泌物中部分糖类、氨基酸类和长链有机酸对三七根腐病原菌生长的影响。【结果】三七根系能显著促进茄腐镰刀菌和恶疫霉菌孢子萌发且对芽管生长方向具有明显的吸引作用。三七根系分泌物中主要含有酸类、醇类、糖类、氨基酸类、胺类、嘌呤嘧啶类、酯类、酮类和酚类等9类物质。其中酸类、醇类、糖类和氨基酸类是根系分泌物中的主要成分,且长链有机酸类(苯甲酸、邻苯二甲酸和月桂酸)对根腐病原菌具有低促高抑效应,糖类(纤维二糖和麦芽三糖)和天冬氨酸可作为唯一碳源和氮源促进病原菌菌丝生长,且纤维二糖和麦芽三糖能促进根腐病原菌孢子萌发,对镰刀菌孢子萌发的芽管具有趋化作用。【结论】三七根系分泌物对根腐病原菌的生长具有促进作用,且对芽管的生长方向具有吸引作用。
关键词: GC-TOF-MS;趋化;孢子萌发;镰刀菌;根腐病
中图分类号: S435.672 文献标志码: A 文章编号:2095-1191(2020)12-2952-10
Abstract:【Objective】The effect of Panax notoginseng(Bark)F. H. Chen root exudates on root rot pathogens was studied to provide a theoretical basis for analyzing the mechanism of interaction between plant and soil-borne pathogens mediated by root exudates. 【Method】The effects of root of P. notoginseng on spore germination and germ tube growth direction of Fusarium solani and Phytophthora cactorum were studied by root-spore interaction method. The root exudates were collected and the components of root exudates of P. notoginseng were analyzed by gas chromatography-time-of-flight mass spectrometer(GC-TOF-MS), and then determined the effects of some metabolites(sugars, amino acids and long-chain organic acids) in root exudates on the growth of root rot pathogens by mycelium growth rate method. 【Result】The results showed that the spore germination rate of F. solani and P. cactorum was significantly increased around the root and the germ tubes had chemotaxis activity towards roots of P. notoginseng. Root exudates of P. notoginseng contained nine kinds of substances, including acids, alcohols, sugars, amino acids, amines, purines, esters, ketones and phenols. Among them, acids, alcohols, sugars and amino acids were the main components in root exudates of P. notoginseng. Long-chain organic acids (benzoic acid, pathalic acid, palmitic acid and lauric acid) could promote and inhibite the growth of root rot pathogen according to the condition. Sugars(cellobiose and maltotriose) and aspartic acid could promote the mycelium growth of pathogen as the sole carbon source and notrogen source respectively. Cellobiose and maltotriose also promoted the germination of root rot pathogen spores and had a chemotaxis on the growth of germ tube of Fusarium. 【Conclusion】Root exudates of P. notoginseng can promote the growth of root rot pathogens, and has attraction effect on the growth direction of germ tube.
Key words: GC-TOF-MS; chemotaxis; spore germination; Solani; root rot
Foundation item: National Natural Science Foundation of China(31772404, 31660605); Young and Middle-aged Academic and Technical Talent Reserve Program in Yunnan(202005AC160045); Yunnan Academician Workstation of Chinese Academy of Engineering(2018IC063)
0 引言
【研究意义】三七[Panax notoginseng(Burk.) F. H. Chen]为五加科人参属植物,是我国独具特色的大宗药用作物,具有散瘀止血、消肿定痛等功效,对心脑血管系统疾病具有显著疗效(张玉军,2009)。三七的种植和加工已成为地方经济发展的重要支柱产业(郭旭初,2007)。三七根腐病是三七生产中的一类重要病害,严重影响三七的产量和质量。三七根腐病的病原极为复杂,目前已报道的病原包括镰孢属真菌(Fusarium solani、F. oxysporum、F. moniliform var. intermecliumt和F. solani f. radicicola等)、柱孢属真菌(Cylindrocarpon destructans和C. didynum)、草茎点霉(Phoma herbarum)、立枯丝核菌(Rhizoctonia solani)、恶疫霉(Phytophthora cactorum)、假单胞菌(Pseudomonas spp.)和线虫(Meloidogyne spp.)等(陈昱君等,2002;缪作清等,2006;王勇等,2007;蒋妮等,2011)。生产中三七根腐病的防治措施主要包括农业防治、化学防治和生物防治等,但由于根腐病的复杂性以及各防治措施自身的局限性,根腐病的防治已成为三七生产中急需解决的问题。明确三七根腐病发生的根本原因,可为制定合理有效的防治措施提供理论参考。【前人研究进展】植物可通过根系分泌物有选择地募集有益或有害微生物。有研究表明,植物根系分泌的碳水化合物(如果糖、葡萄糖、半乳糖等)、氨基酸类(如谷氨酸、色氨酸、鸟氨酸等)、芳香族化合物(如香豆素、水杨酸和4-羟基苯甲酸等)及其他许多化合物既能为微生物生长提供所需的养分,又能作为信号物质影响微生物向根际积聚(Bais et al.,2004;Rudrappa et al.,2008;Huang et al.,2014;Canarini et al.,2019)。Xie等(2012)研究表明,植物根尖分泌的阿拉伯半乳聚糖蛋白能吸引有益微生物,但排斥病原菌向根际聚集;Carvalhais等(2015)发现,茉莉酸无论是外源添加还是植株合成突变均能显著改变土壤微生物的群落结构。植物根系分泌物的组成和含量決定了根际微生物的种类和丰度,并对微生物的生长和代谢产生一定影响(何欢等,2011;Peiffer et al.,2013;Tur-ner et al.,2013)。Badri等(2013)从离体培养的拟南芥中收集分泌物混合物,在没有植物的情况下施用于土壤中,发现酚类化合物对细菌的生长和吸引作用影响最大,其次是氨基酸和糖。研究表明,拟南芥在其发育的前期和后期会影响放线菌、拟杆菌和蓝藻的丰度以及微生物的活性(Chaparro et al.,2014)。三七根系分泌物中的皂苷对土壤微生物群落结构具有显著影响,其原因是土壤中的微生物对皂苷的利用能力存在显著差异(Luo et al.,2020)。这些研究表明,植物具有通过根系分泌物调控根际微生物的特性,且同种物质可能对不同的微生物具有不同的功能。另外,根系分泌物中许多成分还具有促进土传病原菌生长的功能。番茄根系分泌物可刺激番茄病原菌F. oxysporum f. sp. lycopersici和F. oxysporum f. sp. radicis-lycopersici小型分生孢子的萌发,且刺激程度受植物生长发育阶段的影响(Steinkellner et al.,2005);西瓜根系分泌物中的酚酸、糖和游离氨基酸能显著提高F. oxysporum f. sp. niveum的产孢能力,促进孢子的萌发(Hao et al.,2010);十字花科植物根系分泌的烯丙基异硫氰酸能刺激土壤中根肿病菌休眠孢子囊的萌发(Hwang et al.,2015)。【本研究切入点】前期研究发现三七生长过程中通过根系分泌或残体降解释放到根际土壤中的皂苷类物质一方面会对三七根系产生自毒作用,另一方面会改变根际土壤微生物结构和功能,促进病原菌而抑制有益微生物的生长,从而使当茬和下茬三七发生严重的根腐病,加重连作障碍的程度(杨敏等,2014;Yang et al.,2015)。然而三七根系分泌物中是否还有其他物质参与了植物与根际病原菌之间的互作目前尚不清楚。【拟解决的关键问题】观察三七根系与主要根腐病菌的互作效应,收集根系分泌物并利用气相色谱—飞行时间质谱联用仪(GC-TOF-MS)分析三七根系分泌物中的成分,同时测定部分糖类、氨基酸类和长链有机酸对三七主要根腐病菌生长的影响,为解析三七根系分泌物介导的植物与土传病原菌互作机制提供理论依据。
1 材料与方法
1. 1 试验材料
一年生健康三七种苗来自云南农业大学寻甸大河桥教学实验基地。试验所用化合物标准品分别购自上海麦克林生化科技有限公司、贵州迪大科技有限责任公司和美国Sigma公司,化合物详细信息见表1。
供试病原菌为茄腐镰刀菌F3(F. solani)、尖孢镰刀菌Z4(F. oxysporum)、毁灭柱孢菌CD9(C. destructans)和恶疫霉菌D-1(P. cactorum),均由云南农业大学生物多样性与病害控制实验室从三七根腐病病株中分离获得,并经过形态和致病性鉴定。
1. 2 试验方法
1. 2. 1 三七根系对根腐病原菌孢子萌发和芽管生长方向的影响 参考刘屹湘(2011)的方法,略有改进。以直径1 mm的毛细管在载玻片上围成一个U形管,形成一个一端开口的槽(长×宽×高=50 mm×25 mm×1 mm)。在槽中分别加入浓度为1×105个孢子/mL的菌株F3或D-1孢子悬浮液,盖上盖玻片;以插入一端封口的直径1 mm毛细管作为对照。选择完整无损伤的三七根系,分别插入菌株F3和D-1孢子悬浮液中。在倒置显微镜(Leica DM 2000,德国)下观察三七根围菌株D-1孢子的行为,并每隔5 min拍照一次,比较不同时间根系周围游动孢子休止和萌发的数量、芽管朝向根系伸长孢子的数量,每处理10个重复。菌株F3孢子于28 ℃恒温箱中放置24 h后,在倒置显微镜下观察三七根围分生孢子的分布情况并拍照,比较孢子萌发和芽管朝向根系的数量,每处理10个重复。
孢子萌发率、休止率和向根率计算公式:萌发率(%)=萌发孢子数/孢子总数×100;休止率(%)=休止孢数/孢子总数×100;向根率(%)=芽管朝向根系的孢子数/孢子总数×100。
1. 2. 2 三七根系分泌物收集 参照Neumann等(2009)的方法收集三七根系分泌物。取生长健康的一年生三七苗,自来水冲洗干净后用0.3%次氯酸钠消毒3 min,注意不要损伤根系,保持根系完整。将准备好的三七苗放入底部连接有阀门的玻璃瓶,保持根系舒展,缓慢加入75 g石英砂,每瓶种植1棵三七苗。设4个重复,每重复30瓶,共120瓶。无菌水培养2周后,在玻璃瓶阀门下端连接干净的三角瓶即可开始收集根系分泌物,收集时缓慢加入无菌水6 mL,多余液体顺着通气阀口流入收集瓶,每3 d收集1次。将每次收集到的根系分泌物用0.22 ?m滤膜过滤后取250 mL于方形铁盘中,-80 ℃冰箱中冷冻至固体后取出置于冷冻干燥仪(Alpha 1-2 LD plus,Christ,德国)-76 ℃下进行冷冻干燥。冷冻干燥后的根系分泌物为粉末状,用离心管收集后于-20 ℃保存备用。
1. 2. 3 三七根系分泌物GC-TOF-MS鉴定
1. 2. 3. 1 根系分泌物萃取 取8.5 mg根系分泌物冻干粉末于2 mL EP管中,加入0.2 mL甲醇—水提取试剂(体积比3∶1)漩涡混匀,4 ℃,12000 r/min离心15 min;取0.18 mL上清液于2 mL进样瓶中。
1. 2. 3. 2 根系分泌物衍生化 在真空浓缩器中干燥提取物;向干燥后的代谢物加入40 μL甲氧胺盐试剂(甲氧胺盐酸盐,溶于20 mg/mL吡啶),轻轻混匀后放入烘箱中80 ℃孵育20 min;向每个样品中迅速加入80 μL双(三甲基硅烷基)三氟乙酰胺(BSTFA)[含有1% N-甲基三甲基硅基三氟乙酰胺(TCMS),v/v],将混合物70 ℃孵育1 h;混匀后上机检测。
1. 2. 3. 3 根系分泌物GC-TOF-MS鉴定 Agilent 7890气相色谱—飞行时间质谱联用仪配有Restek Rxi-5Sil MS毛细管柱(30 m×250 μm×0.25 μm)。GC-TOF-MS分析条件:进样量:1 μL,不分流模式;载气:氦气;前进样口吹扫流速:3 mL/min;柱流速:1 mL/min;柱温:60 ℃保持1 min,以10 ℃/min的速率上升至330 ℃,保持10 min;前进样口温度:280 ℃;传输线温度:280 ℃;离子源温度:220 ℃;电离电压:-70 eV;扫描范围:85~600 m/z;扫描速率:20 spectra/sec;溶剂延迟:366 s。
1. 2. 3. 4 数据处理 利用LECO公司的Chroma TOF 4.3X和LECO-Fiehn Rtx5进行基线数据过滤、基线校准、峰对齐、解卷积分析、峰定性和峰面积计算,利用保留时间指数方法进行峰定性。
1. 2. 4 三七根系分泌物中不同化合物对根腐病原菌生长速率的影响
1. 2. 4. 1 长链有机酸对三七根腐病原菌生长的影响 采用菌丝生长速率法测定。分别将长鏈有机酸类物质(苯甲酸、邻苯二甲酸、棕榈酸和月桂酸)利用甲醇溶解后添加到已灭菌的PDA培养基中制成终浓度为1、10、100和1000 μg/mL的平板待用,以含有1%甲醇的PDA培养基为对照。在培养基中央接种菌株F3、Z4、CD9和D-1,25 ℃黑暗培养,待对照菌落长至培养皿的2/3时采用十字交叉法测量各处理菌落直径,每处理4次重复。
菌丝生长抑制率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100
1. 2. 4. 2 天冬氨酸和羟胺作为唯一氮源对根腐病原菌生长的影响 准确称量0.20 g KH2PO4、0.20 g MgSO4·7H2O、0.20 g CaSO4·2H2O、5.00 g CaCO3、10.00 g葡萄糖和20.00 g琼脂,定容至1 L,调节pH=7.0~7.2,121 ℃高压灭菌40 min,制成缺氮培养基平板。在缺氮培养基中分别加入10 g/L天冬氨酸和羟胺制成唯一氮源培养基。在培养基中央分别接种菌株F3、Z4、CD9和D-1,于25 ℃黑暗培养,待对照菌落长至培养皿的2/3时采用十字交叉法测量各处理菌落直径,每处理4次重复。
菌丝生长促进率(%)=(处理菌落直径-对照菌落直径)/对照菌落直径×
100
1. 2. 4. 3 纤维二糖和麦芽三糖作为唯一碳源对根腐病原菌生长的影响 准确称量3.00 g NaNO3、1.00 g KH2PO4、0.50 g MgSO4·7H2O、0.01g FeSO4·6H2O、0.50 g KCl和20.00 g琼脂,定容至1 L,调节pH=7.0~7.5,121 ℃高压灭菌40 min,制成缺碳培养基平板。在缺碳培养基中分别加入10 g/L纤维二糖和麦芽三糖制成唯一碳源培养基。在培养基中央分别接种菌株F3、Z4、CD9和D-1,25 ℃黑暗培养,待对照菌落长至培养皿的2/3时采用十字交叉法测量各处理菌落直径,每处理4次重复。菌丝生长促进率计算公式同1.2.4.2。
1. 2. 4. 4 纤维二糖和麦芽三糖对菌株F3孢子萌发和芽管生长方向的影响 (1)孢子悬浮液制备:在培养(28 ℃,12 h光暗交替)7~10 d的菌株F3培养基中加入适量无菌水,然后用玻片轻刮菌丝,使孢子脱落下来,再用纱布过滤,制成105个孢子/mL的悬浮液备用。(2)带糖水琼脂培养基配制:20.00 g琼脂,定容至1 L,分别添加纤维二糖和麦芽三糖到培养基中,配制成浓度为0.01、0.10和1.00 μg/mL的带糖培养基,灭菌冷却后用灭菌的小刀切成1.5 cm×0.8 cm的小块。(3)糖类物质对菌株F3孢子萌发和芽管生长方向的影响:将制成的培养基小块放置在毛细管围成的U形管中间,盖上盖玻片,取200 μL孢子悬浮液沿毛细管边缘缓慢加入U形管内,避免产生气泡,每处理4次重复。将玻片水平放置于28 ℃黑暗培养24 h后进行观察拍照,按照下列公式计算孢子萌发率和向营养源生长率。
萌发率(%)=萌发孢子数/孢子总数×100
向营养源生长率(%)=芽管朝向琼脂块伸长孢
子数/孢子总数×100
1. 3 统计分析
试验数据采用SPSS 18.0进行分析。
2 结果与分析
2. 1 三七根系对菌株D-1和F3孢子萌发和芽管生长方向的影响
三七根系放入菌株D-1孢子悬浮液中5 min开始观察到游动孢子休止,15 min后根系周围游动孢子休止率增加,极显著高于毛细管对照(P<0.01,下同);25 min后,根系周围游动孢子休止率与对照相比无显著差异(P>0.05,下同);到30 min时游动孢子休止率与对照基本相同,游动孢子基本完全休止(图1- A)。三七根系周围的菌株D-1孢子于15 min后开始萌发,同时芽管向三七根系所在方向生长,而毛细管周围的孢子萌发迟缓,到20 min时孢子才开始萌发,且三七根系周围的孢子萌发率极显著高于毛细管周围,芽管朝着三七根系生长的比例显著(P<0.05,下同)(30 min时极显著)高于朝着毛细管生长的比例(图1-B和图1-C)。表明三七根系能显著促进恶疫霉菌游动孢子的休止和休止孢的萌发,并对芽管的生长方向具有明显的吸引作用。
与对照相比,三七根系周围菌株F3孢子萌发率极显著高于对照,孢子萌发后芽管的向根率也显著高于对照(图1-D)。表明三七根系能显著促进茄腐镰刀菌孢子萌发且对芽管生长方向具有明显的吸引作用。
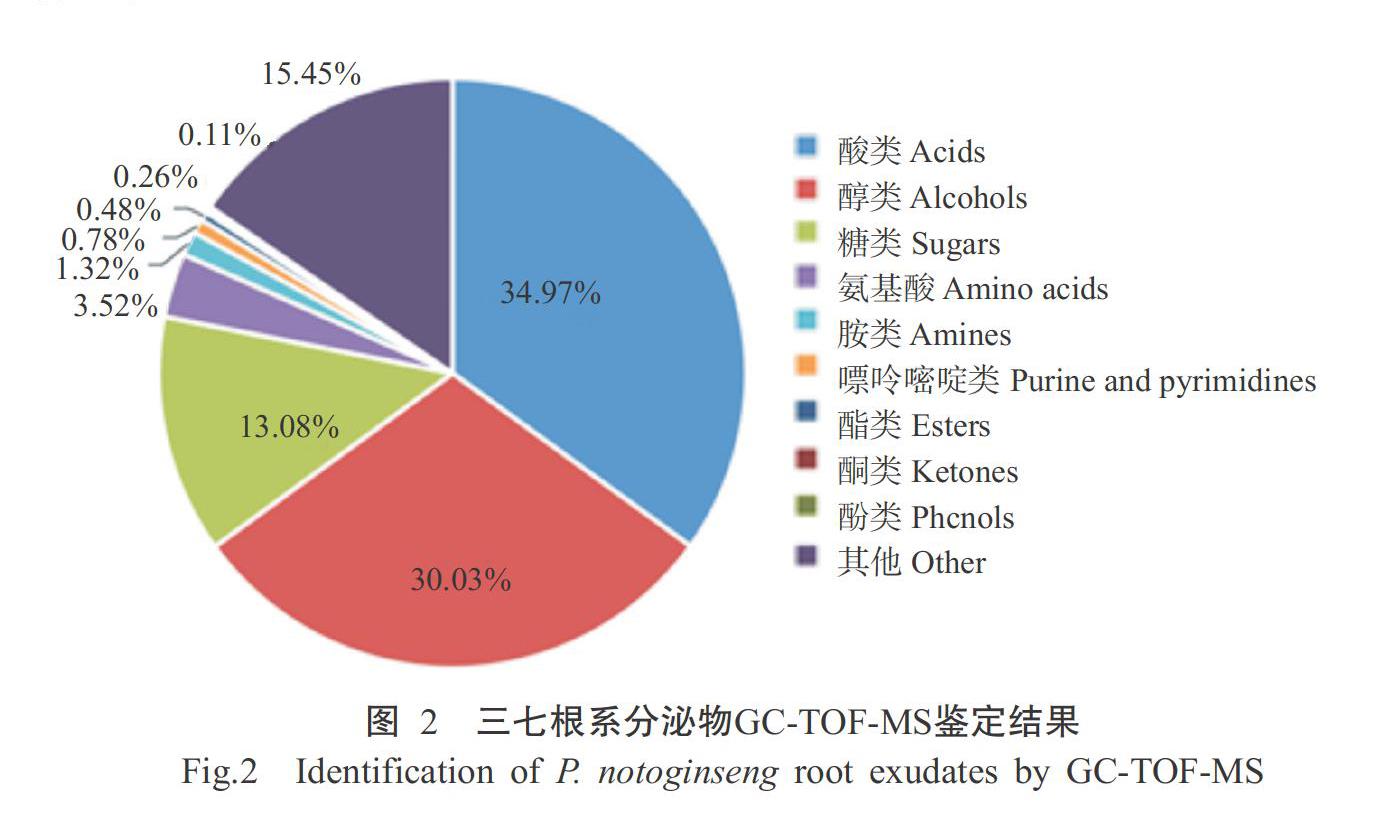
2. 2 三七根系分泌物的GC-TOF-MS鉴定结果
采用GC-TOF-MS对三七根系分泌物进行鉴定,从中共检测出292种物质,主要为酸类、醇类、糖类、氨基酸类、胺类、嘌呤嘧啶类、酯类、酮类和酚类等9类物质(图2)。其中,酸类、醇类、糖类和氨基酸类的相对含量最多,分别达34.97%、30.03%、13.08%和3.52%,其次为胺类(相对含量为1.32%),嘌呤嘧啶类、酯类、酮类和酚类物质的相对含量较低,仅占0.11%~0.78%(表2)。表明三七根系分泌物成分组成复杂,相对含量差异较大,酸类、醇类、糖类和氨基酸类是根系分泌物中的主要成分。
2. 3 三七根系分泌物中不同化合物对根腐病原菌生长的影响
利用菌丝生长速率法进一步测定三七根系分泌物中的长链有机酸(苯甲酸、邻苯二甲酸、棕榈酸和月桂酸)、糖类(纤维二糖和麦芽三糖)、羟胺和天冬氨酸对三七根腐病原菌生长的影响。
2. 3. 1 苯甲酸、邻苯二甲酸、棕榈酸和月桂酸对三七根腐病原菌生长的影响 由图3可看出,浓度为1或10 μg/mL的苯甲酸、邻苯二甲酸和棕榈酸除对菌株F3有轻度抑制效果外,对其他病原菌生长均表现为促进作用;月桂酸在1和10 μg/mL时对菌株F3无抑制效果;当浓度为100 μg/mL时,苯甲酸和月桂酸对三七根腐病原菌开始表现出不同程度的抑制作用;当浓度为1000 μg/mL时,除棕榈酸只对菌株CD9表现为轻度抑制作用外,其他3种酸类物质均对三七根腐病原菌生长表现出明显的抑制作用。说明苯甲酸、邻苯二甲酸和月桂酸对三七根腐病原菌多表现出低促高抑效应。
2. 3. 2 天冬氨酸和羥胺作为唯一氮源对三七根腐病原菌菌丝生长的影响 由图4可知,菌株Z4、F3、D-1和CD9在缺氮及缺氮培养基中添加羟胺的培养条件下均不能生长;天冬氨酸能作为唯一氮源供菌株F3、Z4和CD9菌丝生长,但不能供菌株D-1菌丝生长。表明天冬氨酸可作为唯一氮源供三七根腐病原菌生长,但不同病原菌对天冬氨酸的利用能力存在较大差异。
2. 3. 3 纤维二糖和麦芽三糖对三七根腐病原菌生长的影响
2. 3. 3. 1 纤维二糖和麦芽三糖作为唯一碳源对三七根腐病原菌菌丝生长的影响 由图5可知,纤维二糖和麦芽三糖均能作为唯一碳源供菌株Z4、F3和CD9菌丝生长,但不能供菌株D-1菌丝生长。菌株F3利用纤维二糖的能力最强,其次是麦芽三糖;菌株Z4与CD9菌株间利用纤维二糖和麦芽三糖的能力无显著差异。
2. 3. 3. 2 纤维二糖和麦芽三糖对菌株F3孢子萌发和芽管生长方向的影响 纤维二糖和麦芽三糖处理菌株F3孢子24 h后统计结果表明,纤维二糖对菌株F3孢子萌发具有明显的促进作用,且随着浓度增加,促进作用增强,但对芽管向营养源方向生长无显著促进作用(图6-A);麦芽三糖对菌株F3孢子萌发无显著促进作用,但在低浓度下即能显著促进芽管向营养源生长(图6-B)。
3 讨论
植物可通过释放化合物对根际土壤微生物进行调控(Reinhold-Hurek et al.,2015),在土壤和根际之间形成独特的微生物组合,这种现象被称为“根际效应”(Berendsen et al.,2012)。根系分泌物既能提供微生物生长所需的养分,又能作为信号激活或募集微生物(Canarini et al.,2019)。本研究发现,三七根系能促进根腐病原菌孢子萌发和芽管趋向根系伸长,表明三七根腐病菌能特异性地趋向和识别寄主根系。化学趋向性响应是一些植物病原菌感应到寄主植物信号并侵入寄主的一种重要方式,为根腐病原菌在三七根际大量繁殖成为优势菌群打下了坚实基础。
为明确根系分泌物在三七根系与病原菌互作中的作用,本研究利用GC-TOF-MS鉴定了三七根系分泌物的化学成分。利用GC-MS开展植物根系分泌物的研究已应用于多种作物。王文斌等(2010)检测出橡胶树幼苗根系分泌物由多种有机化合物组成,包括烃类、醇类、有机酸类、酯类、酰胺类、醛类和酚类等物质。张爱华等(2014)发现人参根系分泌物中含有人参皂苷及烷烃类物质、有机酸酯类物质和酚酸类物质。本研究对三七根系分泌物进行鉴定,鉴定结果主要为酸类、醇类、糖类、氨基酸类、胺类、嘌呤嘧啶类、酯类、酮类和酚类等9类物质,其中酸类、醇类、糖类和氨基酸类的相对含量最高,是三七根系分泌物中的主要成分,推测这些物质可能在植物根系与外界环境的互作中发挥重要作用。
本课题组前期研究发现,三七根系分泌物能显著促进引起三七根腐的镰刀菌和锈腐菌在三七根际增殖,抑制木霉菌和芽孢杆菌等有益菌的生长(Luo et al.,2019)。三七根系分泌的人参皂苷在低浓度(0.2~20.0 mg/L)下对三七根腐病原菌如恶疫霉菌、腐霉菌(Pythium irregulare)、镰刀菌(F. solani和F. oxysporum)以及毁灭柱孢菌的生长具有明显的促进作用(Nicol et al.,2003;Yang et al.,2015,2018;匙坤等,2016)。但目前对三七分泌的游离氨基酸和可溶性糖类的作用研究较少(李浩成等,2020)。连作大豆根系分泌的糖类和氨基酸类物质对引起大豆根腐的镰刀菌具有明显的促生长活性(鞠会艳等,2002);与三七同属的人参根系分泌物中的阿拉伯糖、鼠李糖2种糖类物质和赖氨酸、异亮氨酸等6种氨基酸对人参细菌性软腐病菌具有明显的化学趋向性响应(张爱华等,2016)。本研究结果显示,三七根系分泌物中的糖类(纤维二糖和麦芽三糖)和天冬氨酸可作为唯一碳源和氮源促進三七根腐病原菌生长,且2种糖类物质具有促进茄腐镰刀菌F3孢子萌发或在低浓度条件下促进芽管向营养源生长的功能。表明三七根系分泌的糖类和氨基酸类物质可能对土壤中的根腐病原菌具有一定的吸引作用或可作为营养物质促进病原菌生长,从而导致三七根腐病加重发生。
有研究发现,植物根系分泌的长链有机酸可能对土壤中特定微生物具有选择作用(Yuan et al.,2018)。本研究结果显示,苯甲酸、邻苯二甲酸和月桂酸等常见长链有机酸对三七根腐病原菌多表现出低促高抑效应。在三七重茬根际土壤和三七根系分泌物中均存在的苯甲酸及其衍生物对三七根腐菌同样表现为低促高抑效应(赵静等,2018)。其他作物上的研究也发现,邻苯二甲酸和对羟基苯甲酸在一定浓度范围内对尖孢镰刀菌菌丝生长和孢子萌发亦表现低促高抑效应(鞠会艳等,2002;Zhao et al.,2018)。嫁接茄根系分泌物中的棕榈酸对黄萎病菌具有一定的化感抑制作用(Zhou et al.,2010)。上述研究结果进一步说明植物可通过调控根系分泌物中长链有机酸的含量来特异性调控根际土壤微生物。但本研究仅测定了三七根系分泌物中的部分代谢物对根腐病原菌生长的影响,后续亟需对一些相对含量较高的化合物如乳酸和丙三醇等进行深入研究,以明确这些代谢物的功能,以期对三七根系分泌物的功能有更全面解析。
4 结论
三七根系分泌物中的长链有机酸类(苯甲酸、邻苯二甲酸和月桂酸)对根腐病原菌具有低促高抑效应,糖类(纤维二糖和麦芽三糖)和天冬氨酸可作为唯一碳源和氮源促进病原菌菌丝生长,且纤维二糖和麦芽三糖具有促进茄腐镰刀菌孢子萌发或吸引芽管朝向营养源方向生长的功能,可为解析根腐病原菌在三七根际土壤中的异常积累提供理论参考。
参考文献:
陈昱君,王勇,伍忠翠. 2002. 种苗质量与三七根腐病关系[J]. 中药材,25(5):307-308. [Chen Y J,Wang Y,Wu Z C. 2002. Seedling quality and root rot on Panax notoginseng[J]. Journal of Chinese Medicinal Materials,25(5): 307-308.]
匙坤,雷锋杰,许永华,刘芳芳,杨鹤,张爱华,张连学. 2016. 根腐菌和锈腐菌对人参总皂苷的化学趋向性响应研究[J]. 中草药,47(5):821-826. [Chi K,Lei F J,Xu Y H,Liu F F,Yang H,Zhang A H,Zhang L X. 2016. Chemotaxis response of Fusarium solani and Cylindrocarpon destructans on total ginsenoside[J]. Chinese Traditional and Herbal Drugs,47(5):821-826.]
郭旭初. 2007. 新兴绿色产业——文山三七的现状与未来[J]. 生态经济,(1): 116-119. [Guo X C. 2007. New green industry-takes Wenshan panax pseudo-ginseng status and its future as example[J]. Ecological Economy,(1): 116-119.]
何欢,王占武,胡栋,张翠绵,李洪涛,贾楠. 2011. 根系分泌物与根际微生物互作的研究进展[J]. 河北农业科学,15(3): 69-73. [He H,Wang Z W,Hu D,Zhang C M,Li H T,Jia N. 2011. Progress on interactions between root exudates and rhizosphere microorganisms[J]. Journal of Hebei Agricultural Sciences,15(3): 69-73.]
蒋妮,覃柳燕,叶云峰. 2011. 三七病害研究进展[J]. 南方农业学报,42(9):1070-1074. [Jiang N,Qin L Y,Ye Y F. 2011. Research advances in diseases of Panax notoginseng[J]. Journal of Southern Agriculture,42(9):1070-1074.]
鞠会艳,韩丽梅,王树起,丛登立. 2002. 连作大豆根分泌物对根腐病病原菌的化感作用[J]. 应用生态学报,13(6):723-727. [Ju H Y,Han L M,Wang S Q,Cong D L. 2002. Allelopathic effect of root exudates on pathogenic fungi of root rot in continuous cropping soybean[J]. Chinese Journal of Applied Ecology,13(6):723-727.]
李浩成,左应梅,杨绍兵,杨天梅,李纪潮,杨维泽,张金渝. 2020. 三七根系分泌物在连作障碍中的生态效应及缓解方法[J]. 中国农业科技导报,22(8):159-167. [Li H C,Zuo Y M,Yang S B,Yang T M,Li J C,Yang W Z,Zhang J Y. 2020. Ecological effect of root exudates of Panax notoginseng on continuous cropping obstacles and its alleviating methods[J]. Journal of Agricultural Science and Technology,22(8):159-167.]
刘屹湘. 2011. 大蒜辣椒间作控制辣椒疫病的效果及大蒜根系与辣椒疫霉菌的化感互作研究[D]. 云南:云南農业大学. [Liu Y X. 2011. The control effect of garlic and chili pepper intercropping on Phytophthora blight and its allelopathy mechanism[D]. Yunnan: Yunnan Agricultural University.]
缪作清,李世东,刘杏忠,陈昱君,李云华,王勇,郭荣君,夏振远,张克勤. 2006. 三七根腐病病原研究[J]. 中国农业科学,39(7):1371-1378. [Miao Z Q,Li S D,Liu X Z,Chen Y J,Li Y H,Wang Y,Guo R J,Xia Z Y,Zhang K Q. 2006. The causal microorganisms of Panax notoginseng root rot disease[J]. Scientia Agricultura Sinica,39(7):1371-1378.]
王文斌,吴小平,尹玉莲,郭海超,罗雪华. 2010. 水培条件下橡胶树幼苗根系分泌物的GC-MS分析[J]. 热带作物学报,31(12):2281-2286. [Wang W B,Wu X P,Yin Y L,Guo H C,Luo X H. 2010. GC-MS analysis of rubber seedling root exudates with nutrient solution cultivation[J]. Chinese Journal of Tropical Crops,31(12):2281-2286.]
王勇,刘云芝,陈昱君,刘云龙. 2007. 文山三七疫病病原菌的分离与鉴定[J]. 文山师范高等专科学校学报,20(1):104-107. [Wang Y,Liu Y Z,Chen Y J,Liu Y L. 2007. The pathogenic isolation and identification of Phytophthora blight of Panax notoginseng in Wenshan of China [J]. Journal of Wenshan Teachers College,20(1):104-107.]
杨敏,梅馨月,郑建芬,尹兆波,赵芝,张潇丹,何霞红,朱书生. 2014. 三七主要病原菌对皂苷的敏感性分析[J]. 植物保护,40(3): 76-81. [Yang M,Mei X Y,Zheng J F,Yin Z B,Zhao Z,Zhang X D,He X H,Zhu S S. 2014. Sensitivity of the pathogens of Panax notoginseng to ginsenosides[J]. Plant Protection,40(3): 76-81.]
张爱华,安宁波,雷锋杰,马文丽,匙坤,张连学. 2016. 细菌性软腐菌对人参根系分泌物中糖类和氨基酸类的化学趋向性响应[J]. 中国中药杂志,41(21):3937-3941. [Zhang A H,An N B,Lei F J,Ma W L,Chi K,Zhang L X. 2016. Chemotaxis response of Erwinia carotovora on sugars and amino acids of root exudates of Panax ginseng[J]. China Journal of Chinese Materia Medica,41(21):3937-3941.]
张爱华,彭洪利,雷锋杰,张连学. 2014. 人参根系分泌物的提取及鉴定[J]. 西北农林科技大学学报(自然科学版),42(7): 191-196. [Zhang A H,Peng H L,Lei F J,Zhang L X. 2014. Extraction and identification of ginseng root exu-dates[J]. Journal of Northwest A&F University(Natural Science Edition),42(7): 191-196.]
張玉军. 2009. 三七总皂苷的药理研究进展[J]. 广西医学,31(4): 589-591. [Zhang Y J. 2009. Advances in pharmacological research of Panax notoginseng saponins[J]. Guang-xi Medical Journal,31(4): 589-591.]
赵静,张晓东,王连春,郑丽君,王志远. 2018. 三七重茬根际土壤中化感物质的测定及其对三七根腐菌的生长作用[J]. 中国微生态学杂志,30(2):146-149. [Zhao J,Zhang X D,Wang L C,Zheng L J,Wang Z Y. 2018. Detection and allelopathic effect of allelochemicals in the rhizosphere soil of continuously cropped Panax notoginseng(BurK.) F. H. Chen[J]. Chinese Journal of Microeco-logy,30(2): 146-149.]
Bais H P,Park S W,Weir T L,Callaway R M,Vivanco J M. 2004. How plants communicate using the underground information superhighway[J]. Trends in Plant Science,9(1): 26-32.
Badri D V,Chaparro J M,Zhang R F,Shen Q R,Vivanco J M. 2013. Application of natural blends of phytochemicals derived from the root exudates of Arabidopsis to the soil reveal that phenolic-related compounds predominan-tly modulate the soil microbiome[J]. Journal of Biological Che-mistry,288(7):4502-4512.
Berendsen R L,Pieterse C M J,Bakker P A H M. 2012. The rhizosphere microbiome and plant health[J]. Trends Plant Science,17(8):478-486.
Canarini A,Kaiser C,Merchant A,Richter A,Wanek W. 2019. Root exudation of primary metabolites: Mechanisms and their roles in plant responses to environmental stimuli[J]. Front Plant Science,10: 157.
Carvalhais L C,Dennis P G,Badri D V,Kidd B N,Schenk P M. 2015. Linking Jasmonic acid signaling,root exudates,and rhizosphere microbiomes[J]. Molecular Plant-Microbe Interaction,28(9): 1049-1058.
Chaparro J M,Badri D V,Vivanco J M. 2014. Rhizosphere microbiome assemblage is affected by plant development[J]. The ISME Journal,8(4):790-803.
Hao W Y,Ren L X,Ran W,Shen Q R. 2010. Allelopathic effects of root exudates from watermelon and rice plants on Fusarium oxysporum f. sp. niveum[J]. Plant Soil,336(1-2):485-497.
Huang X F,Chaparro J M,Reardon K F,Zhang R F,Shen Q R,Vivanco J M. 2014. Rhizosphere interactions: Root exudates,microbes,and microbial communities[J]. Botany-Botanique,92: 281-289.
Hwang S F,Ahmed H U,Zhou Q,Turnbull G D,Strelkov S E,Gossen B D,Peng G. 2015. Effect of host and non-host crops on Plasmodiophora brassicae resting spore concentrations and clubroot of canola[J]. Plant Pathology,64(5): 1198-1206.
Luo L F,Guo C W,Wang L T,Zhang J X,Deng L M,Luo K F,Liu Y X,Huang H C,Mei X Y,Yang M,Zhu S S. 2019. Negative plant-soil feedback driven by re-assemblage of the rhizosphere microbiome with the growth of Panax notoginseng[J]. Frontiers in Microbiology,10:1597.
Luo L F,Yang L,Yan Z X,Jiang B B,Li S,Huang H C,Liu Y X,Zhu S S,Yang M. 2020. Ginsenosides in root exudates of Panax notoginseng drive the change of soil microbiota through carbon source different utilization[J]. Plant and Soil,455(4):139-153.
Neumann G,George T S,Plassard C. 2009. Strategies and methods for studying the rhizosphere-the plant science toolbox[J]. Plant Soil,321(1-2): 431-456.
Nicol R W,Yousef L,Traquair J A,Bernards M A. 2003. Ginsenosides stimulate the growth of soil borne pathogens of American ginseng[J]. Phytochemistry,64(1):257-264.
Peiffer J A,Spor A,Koren O,Jin Z,Tringe S G,Dangl J L,Buckler E S,Ley R E. 2013. Diversity and heritability of the maize rhizosphere microbiome under field conditions [J]. PNAS,110(16): 6548-6553.
Reinhold-Hurek B,Bünger W,Burbano C S,Sabale M,Hurek T. 2015. Roots shaping their microbiome: Global hotspots for microbial activity[J]. Annual Review of Phytopathology,53:403-424.
Rudrappa T,Czymmek K J,Paré P W,Bais H P. 2008. Root-secreted malic acid recruits beneficial soil bacteria[J]. Plant Physiology,148(3): 1547-1556.
Steinkellner S,Mammerler R,Vierheilig H. 2005. Microconi-dia germination of the tomato pathogen Fusarium oxysporum in the presence of root exudates[J]. Journal of Plant Interactions,1(1):23-30.
Turner T R,Ramakrishnan K,Walshaw J,Heavens D,Alston M,Swarbreck D,Osbourn A,Grant A,Poole P S. 2013. Comparative metatranscriptomics reveals kingdom level changes in the rhizosphere microbiome of plants[J]. The ISME Journal,7(12): 2248-2258.
Xie F,Williams A,Edwards A,Downie J A. 2012. A plant arabinogalactan-like glycoprotein promotes a novel type of polar surface attachment by Rhizobium leguminosarum[J]. Molecular Plant-Microbe Interactions,25(2): 250-258.
Yang M,Duan S C,Mei X Y,Huang H C,Chen W,Liu Y X,Guo C W,Yang T,Wei W,Liu X L. 2018. The Phytophthora cactorum genome provides insights into the adaptation to host defense compounds and fungicides[J]. Scientific Reports,8:6534.
Yang M,Zhamg X D,Xu Y G,Mei X Y,Jiang B B,Liao J J,Yin Z B,Zheng J F,Zhao Z,Fan L M,He X H,Zhu Y Y,Zhu S S. 2015. Autotoxic ginsenosides in the rhizosphere contribute to the replant failure of Panax notoginseng[J]. PLoS One,10(2):e0118555.
Yuan J,Zhao J,Wen T,Zhao M L,Li R,Goossens P,Huang Q W,Bai Y,Vivanco J M,Kowalchuk G A,Berendsen R L,Shen Q R. 2018. Root exudates drive the soil-borne legacy of aboveground pathogen infection[J]. Microbiome,6:156.
Zhao Y M,Cheng Y X,Ma Y N,Chen C J,Xu F R,Dong X. 2018. Role of phenolic acids from the rhizosphere soils of Panax notoginseng as a double-edge sword in the occurrence of root-rot disease[J]. Molecules,23(4):819.
Zhou B L,Yin Y L,Zhang F L,Ye X L. 2010. Allelopathic effects of root extracts of grafted eggplants on Verticillium dahliae and their constituentsidentification[J]. Allelopathy Journal,25(2):393-402.
(責任编辑 麻小燕)

