ALK融合基因阳性非小细胞肺癌的研究进展
宋鹏 张力 尚聪聪
肺癌的发病率及致死率在恶性肿瘤中均占首位。根据最新发表在CA:A Cancer Journal for Clinicians杂志的Cancer statistics,2017数据显示,2017年美国新发肺癌病例约11万人,死亡约7万人[1]。约85%的为非小细胞肺癌(non-small cell lung cancer,NSCLC),此类患者就诊时多为晚期,既往含铂两药方案1年生存率不足40%[2]。随着肿瘤信号转导通路研究的发展,分子靶向治疗受到越来越多的关注,其中约5%的NSCLC患者体内存在间变淋巴瘤激酶(naplastic lymphoma kinase,ALK)基因融合,以ALK酪氨酸激酶区与5'末端棘皮动物微管结合蛋白(echinoderm microtubuleassociated protein-like 4,EML4)形成融合基因融合最为常见[3]。美国每年约确认ALK阳性患者1万人[4]。本文就ALK融合基因阳性NSCLC的最新进展进行综述。
1 ALK融合基因的研究背景
ALK基因于1994年在间变性大细胞淋巴瘤(ALCL)中被发现,ALCL中存在的NPM-ALK融合基因具备致癌特性[5]。后续多项研究发现炎性肌纤维母细胞瘤、神经母细胞瘤等均与ALK基因突变相关[6]。2007年日本学者Soda M等[7]通过蛋白组学技术在肺腺癌肿瘤组织中首次发现ALK基因突变:EML4基因的1-13号外显子与ALK基因的20-29号外显子融合形成EML4-ALK融合基因。融合基因的EML4(尤其是Basic区)具有强大的致癌活性,这种活性主要依靠EML4-ALK通过二聚化激活酪氨酸激酶,从而活化下游的JAK/STAT、PL3K/mToR及MAPK等多条通路导致细胞增殖与凋亡失控。转染了EML4-ALK融合基因的NIH-3T3成纤维细胞具备了无限增殖的能力[8]。
截至目前,至少发现了15种EMLK-ALK融合变体亚型,其中,最常见的是EML4的变体1(v1:外显子13与ALK的外显子20融合[E13; A20])和变体3:(v3a/b:外显子6a/b与ALK的外显子20融合[E6a/b; A20])(图1)。两种发生率超过60%。所有的变体都保留了ALK的整个酪氨酸激酶结构域和EML4的N末端卷曲螺旋区域,这对于ALK的二聚化和组成型激活是必不可少[9]。除EML4这一最常见的融合伴侣外,多项研究发现TFG、KLC1、SOCS5、H1P1、TPR、BIRC 6等多种少见的ALK融合伴侣,它们的相关临床研究罕见[10-12]。期待相关数据的出现。
2 ALK融合基因检测方法新进展
现在有4种不同方法来检测ALK融合基因的表达,分别是逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)、免疫组化(immunohistochemistry,IHC)、荧光原位杂交法(fluorescencein situhybridization,FISH)及第二代测序技术(next-generation sequencing,NGS)。FISH法是美国国家综合癌症网(National Comprehensive Cancer Network,NCCN)推荐的ALK融合基因检测金标准。它利用互补DNA探针的3'和5'端,然后用荧光显微镜进行观察ALK基因所在的2p23区域。Vysis ALK FISH探针试剂盒已被FDA批准用于ALK重排的检测,但是FISH荧光信号的快速消减及价格昂贵限制了其应用[13]。RT-PCR技术在实验室中应用更为广泛,但其需要以ALK融合伴侣进行引物设计,石蜡组织标本RNA可能保存不当出现假阳性,且组织用量大,使RT-PCR技术的临床应用受到诸多限制[14]。相对而言,IHC有高效、快速及价格低廉的特点,因而可广泛用于常规的病理实验室,近期由罗氏公司推出的首款全自动VENTANA ALK(D5F3)IHC检测试剂盒已获CFDA及FDA认证,该法检测融合基因的特异性与敏感性分别为98%与100%[15]。但IHC的结果判定存在很大主观性,很大程度上依赖于抗体的质量。2017年11月16日基于二代测序技术(NGS)的癌症基因检测分析平台MSK-IMPACTTM被食品药品监督管理局(Food and Drug Administration,FDA)批准,该平台可以1次对肿瘤的468个基因的基因突变进行快速、灵敏的检测,可对这些基因上所有重要区域进行测序,并能检测基因上所有的拷贝数变化、启动子突变、基因组重排及蛋白编码区突变。该技术不仅可准确检测ALK融合基因,更能准确检测罕见突变及其他的遗传变异,毋庸置疑,该技术将为ALK阳性NSCLC的初始治疗及耐药后治疗策略提供重要参考[16]。
最近Letovanec I等依据欧洲大型胸科肿瘤平台Lungscape队列中切除NSCLC的标本对所有四种技术检测ALK突变的吻合率及一致性进行了探讨,对60个样本同时使用四种方法检测,其中55个样本的检测结果是一致的(43个ALK+,12个ALK-)。如果以IHC和FISH两种技术检测的一致性结果作为标准,则RT-PCR和NGS检测的灵敏度是70%和85%,检测的特异性是87.1%和79%。如果将IHC与RT-PCR或NGS结合起来,其灵敏度没有提示,但是检测的特异性提升至了88.7%和83.9%。因此,为了达到最高的灵敏度和特异性,ALK突变应用两种技术进行检测,而第三种方法则可在以上结果不一致时进行评估[17]。
3 ALK抑制剂的研究进展(图2)
众所周知,EML4-ALK代表了一种NSCLC的分子亚型,多见于不吸烟、年轻女性、腺癌及EGFR野生型患者。因EML4-ALK阳性者的某些特征与EGFR突变者相似,2011年ASCO年会韩国的Kim等对1,100例2003年-2009年期间非鳞IIIb期-IV期NSCLC患者的临床资料进行了分析,研究者将患者分为三组:ALK阳性、EGFR突变型、ALK和EGFR均野生型。结果显示,三组患者一线接受含铂方案化疗的PFS无差异,但接受EGFR-TKI治疗的ALK阳性患者,PFS率低于EGFR突变组(P<0.001)和ALK/EGFR野生型组(P=0.048)。因此EML4-ALK阳性者不能从EGFR-TKI靶向治疗中获益,且接受EGFR-TKI治疗的野生型患者和ALK阳性患者相比后者可能更容易产生耐药。多种ALK激酶抑制剂应运而生。
3.1 第一代ALK抑制剂—克唑替尼(Crizotinib) PROFILE 1001是关于Crizotinib的首个I期临床试验,共149例NSCLC患者入组,客观缓解率(objective response rate,ORR)为60.8%,其中有3例达到完全缓解(complete response,CR)。中位无进展生存期(median progression-free survival,mPFS)为9.7个月,1年生存率为74.8%[18]。PROFILE 1005为多中心、单臂II期临床试验,在可统计的259例患者中,ORR为60%,mPFS为8个月。随后的一项国际多中心、随机、开放III期临床研究PROFILE 1007,比较了Crizotinib与化疗(培美曲塞或多西他赛)的疗效与安全性,两组ORR分别为65%和20%,mPFS为7.7个月和3.0个月[19]。而另一项III期临床研究PROFILE 1014比较了克唑替尼和含铂两药方案对未经治疗的NSCLC的治疗效果。共招募343例患者进入,两组mPFS为10.9个月和7.0个月,两组ORR分别为74%和45%[20]。在2017年欧洲肿瘤医学会(European Society for Medical Oncology,ESMO)大会上,报道了PROFILE 1014再随访36个月后OS的数据,两组中位OS分别为未达到(NR)和47.5个月,校正后的统计分析结果显示,克唑替尼组的OS数据显著改善,有可能超过5年[21]。针对东亚人群的PROFILE 1029研究,得出两组的mPFS为11.1个月和6.8个月,ORR分别为88%与46%,显示亚裔人群使用克唑替尼一线治疗获益更多[22]。基于以上研究结果克唑替尼作为ALK阳性NSCLC患者一线治疗的地位被奠定。
克唑替尼相关不良反应轻微,主要为腹泻、恶心及呕吐等1级-2级胃肠道不良反应及视力障碍,而中性粒细胞减少及转氨酶升高等3级-4级不良反应也比较常见。但大约2.5%的病人在克唑替尼治疗后出现间质性肺疾病,需引起临床医生的警惕。
3.2 第二代ALK抑制剂——Ceritinib ASCEND-1是首次关于Ceritinib的I期临床试验,共招募59例ALK阳性的NSCLC患者,确定最大耐受计量为750 mg/d,后纳入71例患者,这130例患者ORR为58%,其中80例此前接受过克唑替尼治疗[23]。ASCEND-2是1项多中心、单臂II期临床试验,共纳入140名经1线-3线化疗后进展的ALK阳性NSCLC患者,其中71.4%有脑转移,该研究ORR为38.6%(脑转移患者ORR为33%),颅内ORR为45%。mPFS为5.7个月(脑转移病例mPFS为5.4个月,无脑转移病例mPFS为11.3个月)[24]。基于以上结果,2014年4月29日FDA批准Ceritinib用于治疗ALK阳性经克唑替尼治疗后进展或不能耐受的转移性NSCLC(图1)。
ASCEND-4是1项关于Ceritinib对比传统化疗的III期临床试验,其研究结果在2016年WCLC大会上公布。本研究共纳入未经任何治疗的376例患者,经商化独立中心(BIRC)分析,Ceritinib组与化疗组的mPFS为16.6个月与8.1个月(HR=0.55),两组的ORR分别为26.7%与72.5%,中位缓解持续时间(DOR)为23.9个月vs11.1个月。对于存在基线脑转移的患者,Ceritinib组颅内ORR为72.7%,化疗组颅内ORR为27.3%,mPFS为10.7个月与6.6个月(HR=0.70)[25]。ASCEND-5对比了Ceritinib与化疗治疗既往化疗和克唑替尼治疗进展后的患者,Ceritinib组与化疗组mPFS分别为5.4个月vs1.6个月[26]。2017年5月26日,基于ASCEND-4的结果,FDA快速批准了Ceritinib用于ALK阳性初治NSCLC的一线适应症。目前尚未有Ceritinib头对头对比克唑替尼相关的数据。
Ceritinib的不良反应以腹泻、恶心、呕吐及肝酶升高为主,总体安全可控。2017年WCLC大会上,Byoung chal等报道了ASCEND-8的结果,发现450 mg/d Ceritinib的15个月无进展生存率估计值较750 mg/d Ceritinib高,这为临床不能耐受Ceritinib副作用提供了一种有效的剂量调整方案[27]。
3.3 第二代ALK抑制剂——Alectinib AF-001JP是Alectinib的1项I期/II期研究,主要纳入未经ALK抑制剂治疗的患者。I期试验建议300 mg bid为临床研究阶段推荐剂量。II期试验ORR为93.5%。24个月无进展生存率为76%,24个月总生存率达79%[28]。2017年世界肺癌大会(World Conference on Lung Cancer,WCLC)上,Makoto Nishio等公布了AF-001JP长期随访结果,PFS超越4年。AF-002JG是Alectinib的另一项I期/II期研究,纳入47例既往使用过ALK-TKI不耐受或进展患者,ORR为55%(1例达CR)。21例有基线脑转移的患者,ORR为50%,疾病控制率(disease control rate,DCR)为90%,5例达CR[29]。NP28761和NP28763是两项关于Alectinib的II期研究,纳入对克唑替尼耐药的ALK阳性NSCLC,两项研究的ORR为47.8%与49.2%。肿瘤缩小病例对Alectinib持续应答的中位时间为7.5个月与11.0个月。有基线脑转移的患者,ORR为66.8%和55.9%,mPFS为6.3个月与8.9个月。基于以上结果,FDA于2015.12.11批准Alectinib用于ALK阳性的二线治疗[30]。
2016年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)大会上,Alectinib对比克唑替尼初治ALK阳性NSCLC患者的研究结果公布(J-ALEX研究)。共招募207例患者,BIRC评估的两组ORR为91.6%与78.9%,mPFS为NR[20.3-NR]与10.2个月[8.2-12.0](HR=0.34,P<0.000,1)。2017年ASCO大会公布了J-ALEX再随访10个月后的结果,Alectinib组与克唑替尼组相比mPFS为25.9个月与10.2个月,ORR为85%与70%[31]。并同时公布了ALEX研究(比较Alectinib和克唑替尼用于ALK阳性NSCLC一线治疗的疗效与安全性)的主要结果,共纳入303例IIIb期-IV期初治患者,BIRC评估mPFS为25.7个月vs10.4个月(HR=0.50,P<0.000,1),首发中枢神经系统进展比例为Alectinib组12%vs克唑替尼组45%。两组的12个月颅内进展率为9.4%和41.4%(HR=0.16,P<0.000,1)。Alectinib组CNS缓解率和CNS DOR均明显提高,尚未有成熟的OS数据披露[32]。基于ALEX结果,FDA于2017年11月7日批准Alectinib用于一线治疗ALK阳性NSCLC。Alectinib是首个在头对头III期研究中证实优于另一种TKI的靶向治疗药物,也是目前用于一线治疗mPFS最长的药物,III期亚太研究已完成入组,期待早日在国内上市。
根据ALEX研究结果,Alectinib组3级-4级不良事件发生率为32%,克唑替尼组为56.7%,常见的不良反应为疲倦、便秘、水肿及鼻咽炎等,肝酶升高及重度肺炎等严重不良反应少见,表明Alectinib安全性显著优于克唑替尼及Ceritinib。
3.4 第二代ALK抑制剂—Brigatinib(AP26113) Brigatinib是目前唯一的ALK、EGFR双靶点抑制剂,对ALK的抑制作用是克唑替尼的12倍。尤其对ALK G1202R突变具有作用,少见的氢键受体赋予其高度选择性的药效。
NCT01449461是关于Brigatinib的多中心I期研究,纳入患者中包括79例ALK阳性的NSCLC,通过剂量递增确定II期研究的剂量为180 mg qd。统计此前接受过克唑替尼耐药的患者,ORR为72%,颅内反应率为53%,平均无进展生存期为13.4个月,长于ceritinib和alectinib的同期数据[33]。ALTA II期临床试验结果在2017年WCLC大会上公布,本研究分为A组(90 mg/d)和B组(90 mg/d共7天,转为180 mg/d)。分别经过16.8个月与18.6个月的中位随访期,IRC评估的两组ORR分别为51%与55%,DOR为13.8个月与14.8个月,mPFS为9.2个月与16.7个月;两组中位OS为NR和27.6个月。脑转移方面,两组基线脑转移可测量者颅内缓解率为50%与67%,DOR为NR与16.6个月;两组脑转移者(无论是是否为可测量病灶)mPFS为12.8个月与18.4个月,ALTA试验的疗效与安全性数据支持继续采用180 mg/d的给药方案进行III期试验[34]。2017年4月28日基于该结果FDA批准Brigatinib用于二线治疗ALK阳性NSCLC。ALTA-1L研究(Brigatinib对比克唑替尼III期研究)已经启动并于2016年4月开始招募患者,期待这一研究可为一线治疗再添有力武器。
Brigatinib总体安全性较好,最常见不良反应包括血肌酐及磷酸激酶升高、高血压、脂肪酶升高、肺炎及皮疹等,大多在减量或停药后好转。
3.5 第二代ALK抑制剂——Ensartinib(X-396) Ensartinib是美国Xcovery公司研究的ALK、c-MET、ROS-1、ABL、SLK的多靶点抑制剂,体外实验证实ALK抑制活性是克唑替尼的3倍-10倍。对L1196M与C1156Y两个克唑替尼耐药靶点敏感,可有效克服克唑替尼的耐药性。
Ensartinib的I期临床数据在2014年ASCO大会上公布。入组的30例患者有13例子为ALK阳性的NSCLC。常见的不良反应为恶心、水肿、乏力、呕吐及皮疹等,所有18例可评价实体瘤总有效率为56%,8例可评价肺癌中,剂量>200 mg的6例患者总有效率为83%,中位治疗时间达20周,最长已达58周。推荐II期临床剂量为225 mg/d。2016年ASCO大会报道了Ensartinib部分II期临床数据,未经克唑替尼治疗的8例患者有效率为88%,PFS最长已超过32个月,进展患者为c-MET扩增;克唑替尼耐药者ORR为77%,PFS最长为28个月,3例进展患者为T1151M、L1196M及QSLP1188P+R1133Q+S1206F突变[35]。2017年欧洲肺癌大会(European Lung Cancer Congress,ELCC)大会公布了Ensartinib治疗脑转移的疗效,13例具有基线靶病灶的患者ORR为69%,DCR为10%;13例基线有非靶病灶的患者,中位缓解时间为5.8个月,最长达24个月[36]。
基于以上研究结果,Ensartinib头对头对比克唑替尼的III期exalt3研究在2017年ASCO大会上公布了研究设计,中国有25家中心加入该研究,期待数据的早日公布。
3.6 第三代ALK抑制剂-Lorlatinib Lorlatinib是辉瑞公司研发的1种强效ATP-竞争性ALK与ROS-1双重抑制剂,为唯一的三代ALK抑制剂。对已知的所有耐药突变均有效(L1198F突变除外)。2017年4月28日,FDA授予Lorlatinib治疗既往接受ALK抑制剂治疗进展ALK阳性NSCLC突破性药物资格。
2017年ASCO大会,Shaw等人公布了Lorlatinib治疗既往接受过≥1次ALK抑制剂的NSCLC有效性与安全性:I期/II期研究的结果。对既往接受过ALK-TKI治疗后耐药(包括G1202R)患者,Lorlatinib有较好疗效。ORR为46%,颅内ORR为42%,mPFS约9.6个月[37]。2017年第18届WCLC大会公布了Lorlatinib对伴有脑转移的ALK或ROS-1的NSCLC II期研究结果,本研究纳入275例已接受或未接受治疗的脑转移NSCLC患者,根据治疗情况分队列进行分析:①未接受治疗的ALK+患者:ORR为90%(27/30),IC-ORR为75%(6/8)。②接受克唑替尼±化疗的ALK+患者:ORR为69%(41/59),IC-ORR为68%(25/37)。③接受克唑替尼之外ALK抑制剂±化疗的ALK+患者:ORR为33%(9/27),ICORR为42%(5/12)。④接受2-3种ALK抑制剂±化疗ALK+患者:ORR为39%(43/111),IC-ORR为48%(40/83)。表明Lorlatinib有强大临床意义的颅内活性,且与既往治疗线数无关[38]。Lorlatinib对比克唑替尼一线治疗ALK阳性NSCLC III期研究CROWN(NTC03052608)已启动并开始招募患者。
Lorlatinib安全可控,常见不良反应为高脂血症与水肿,其余不良反应有周围神经病变,情绪认知影响,肝酶升高等;减量或停药可恢复。若出现罕见不良反应需永久停药。
4 ALK抑制剂的耐药机制(图3)
4.1 克唑替尼的耐药机制
4.1.1 原发性耐药 目前针对克唑替尼原发性耐药的研究较少,一般定义用药3个月内进展的患者即视为原发性耐药,2017年ASCO大会广东省人民医院报道了克唑替尼原发性耐药的研究结果。通过对171例患者进行分析,发现18例患者存在原发性耐药,主要机制为非常见的ALK融合伴侣(ZC3H8-ALK,ALK-LOC102723854及ALKDTNB-ASXL2)、BIM缺失多态性、PTEN/mTOR突变、ALK G3709A突变及KIT突变的联合等。原发性耐药患者的mPFS较获得性耐药患者明显缩短(2.2个月vs10.8个月,P<0.001)[39]。
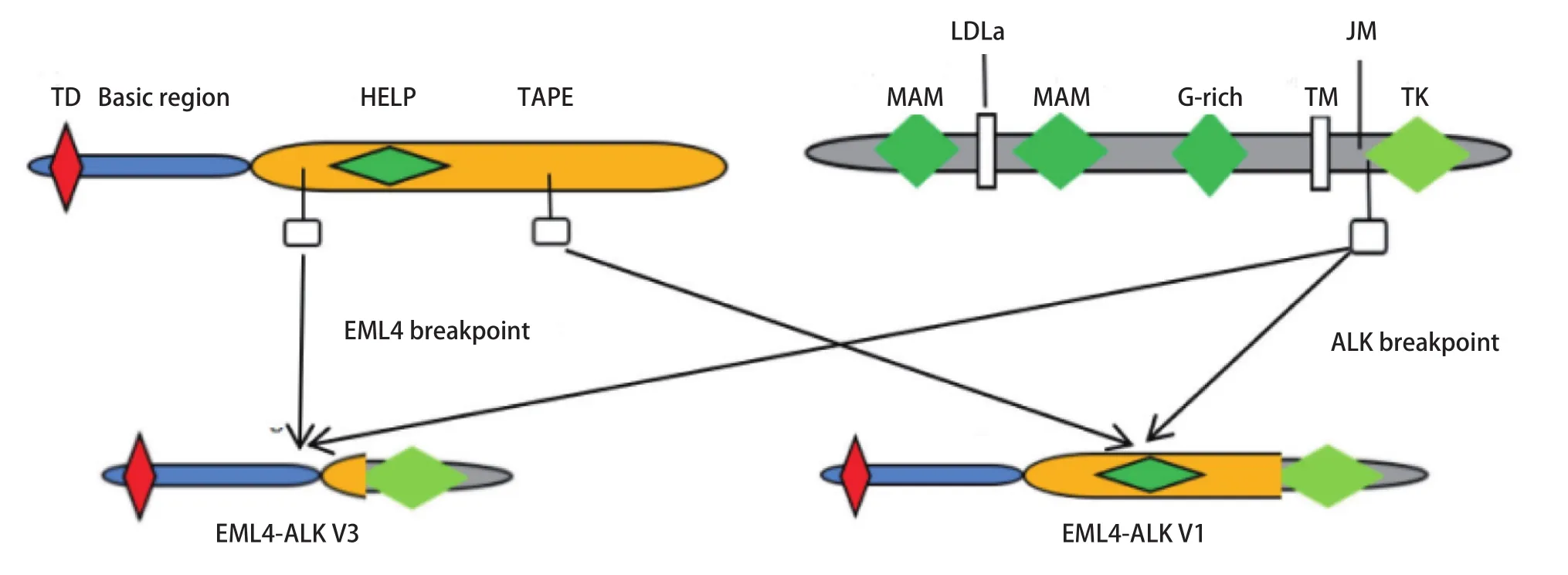
图1 EML4与ALK融合基因常见变体示意图Fig 1 The schematic diagram of EML4 and ALK fusion gene common variants
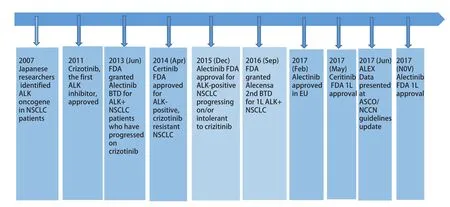
图2 ALK抑制剂的发展历程Fig 2 The development history of ALK-TKI
4.1.2 继发性耐药 克唑替尼继发性耐药突变约占克唑替尼耐药性问题的37%,主要包括ALK激酶区突变和ALK基因拷贝数的扩增,即所谓的ALK通路占优势耐药。
ALK激酶区突变的耐药机制比较明确,突变类型包括:G1269A、F1174L、L1152R、S1206Y、I152Tins、P1203N、V1180L、C1156Y、F1164V、G1202R、G1269S、L1196M,其中G1269A及L1196M最常见[40,41]。最近有报道[42]E1202K可能也是早期药物抵抗的1个点突变。患者发生克唑替尼耐药后,ALK点突变的类型可能有1种或上述几种的组合。
4.1.3 ALK通路不占优势耐药 驱动基因的转换:ALK阳性NSCLC主要依赖ALK及其下游信号通路抑制肿瘤细胞的分裂与转移,当克唑替尼阻断该通路后,由于信号无法向下游传导,肿瘤细胞即可激活其他致癌驱动程序及其信号通路来代替ALK通路,即所谓的ALK通路占优势耐药。图3主要包括EGFR突变、KRAS突变、KIT扩增、ErbB、MET扩增及下游信号通路IGF-1R等[43]。在细胞系研究中发现,EGFR-TKI抑制EGFR磷酸化可以恢复克唑替尼的敏感性,但尚不清楚ALK-TKI与EGFR-TKI的联合是否可提供更好的疗效及阻止ALK-TKI的耐药。现已有经克唑替尼治疗NSCLC转变为小细胞癌的报道[44]。
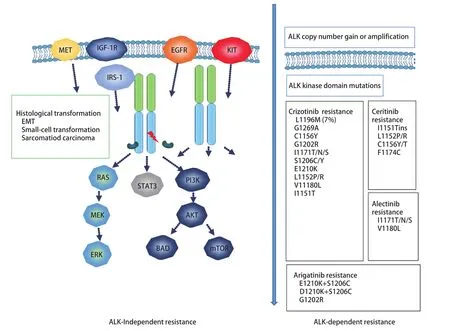
图3 常见ALK抑制剂的耐药机制Fig 3 Common ALK-TKI resistance mechanism
4.1.4 肿瘤的异质性 NSCLC是基因及细胞异质性最强的肿瘤之一,随着分子生物学的进展,目前NSCLC的组织病理、分子遗传及单细胞均有了较高的认识,但NSCLC的真实面貌仍远超目前的认知水平。有研究认为,NSCLC在不同的时间及空间中,可能存在不同的驱动基因。小标本的基因检测是否可代表肿瘤组织全貌目前有待商榷。肿瘤复杂异质性的存在使耐药难以避免,期待早日对肿瘤异质性的起源做出解释。
4.2 下一代ALK抑制剂的耐药机制 克唑替尼耐药后使用二代ALK抑制剂可取得较好效果,但耐药仍无法避免。G1202R与F1174L是Ceritinib最常见的耐药突变[45],C1156Y、1151Tins及L1152R等次级突变也被认为与Ceritinib的耐药性相关[46]。上皮细胞向间充质细胞的转化与E-钙黏连蛋白的减少、vimentin表达的增加有关[47],MEK与SRC信号通路的激活[48],这可能都是Ceritinib的潜在耐药机制。Alectinib常见的点突变包括I1171和V1180L[42],肝细胞生长因子/MET旁路的激活是潜在的Alectinib耐药机制[49]。L1198F是最近报道的Lorlatinib耐药机制[50],Brigatinin、X-396、Entrectinib因尚处于临床研究阶段,尚未有具体耐药机制的阐述。
4.3 EML4-ALK变体亚型对耐药的影响 2018年1月发表在JCO杂志上的1篇文章对127例患者ALK变体亚型与耐药机制的关系进行了研究,结果显示,V3患者在耐药后更容易出现ALK耐药突变,尤其是ALK G1202R突变;V3患者接受Lorlatinib的疗效劣于V1患者,但目前样本量小,期待后续的研究数据进一步证实。这一研究提示,有必要明确ALK阳性患者的变体亚型,可能有助于指导患者后续的治疗选择[51]。
5 展望未来的发展方向
下一代的ALK抑制剂正如雨后春笋般的出现,极大丰富了ALK(+)NSCLC的用药选择。继克唑替尼之后,ceritinib和alectinib都已进入一线治疗序列。但这些药物都没有成熟的OS数据,故目前关于ALK-TKI的一线药物选择上没有明确定论,也不清楚特定的ALK-TKI序列是否会影响肿瘤的生物学特性及特定的耐药机制。目前有两种主流观点:一种是一线使用PFS最长的药物,目前只有alectinib交出了满意答卷,其PFS最长可达24个月-26个月。另一种认为如果治疗初期就用最好的药物,产生耐药之后将面临无药可用的尴尬境地,2017年ESMO大会上法国学者报道了关于ALK抑制剂治疗时间的单中心研究,发现中位OS可达7年,他们认为最好策略是:先用克唑替尼,后续再根据耐药情况选择不同药物(表1)。因此需要进行一项针对OS而不是PFS的临床试验来确定最佳的药物治疗序列,这可为临床选择ALK-TKI提供持久获益。
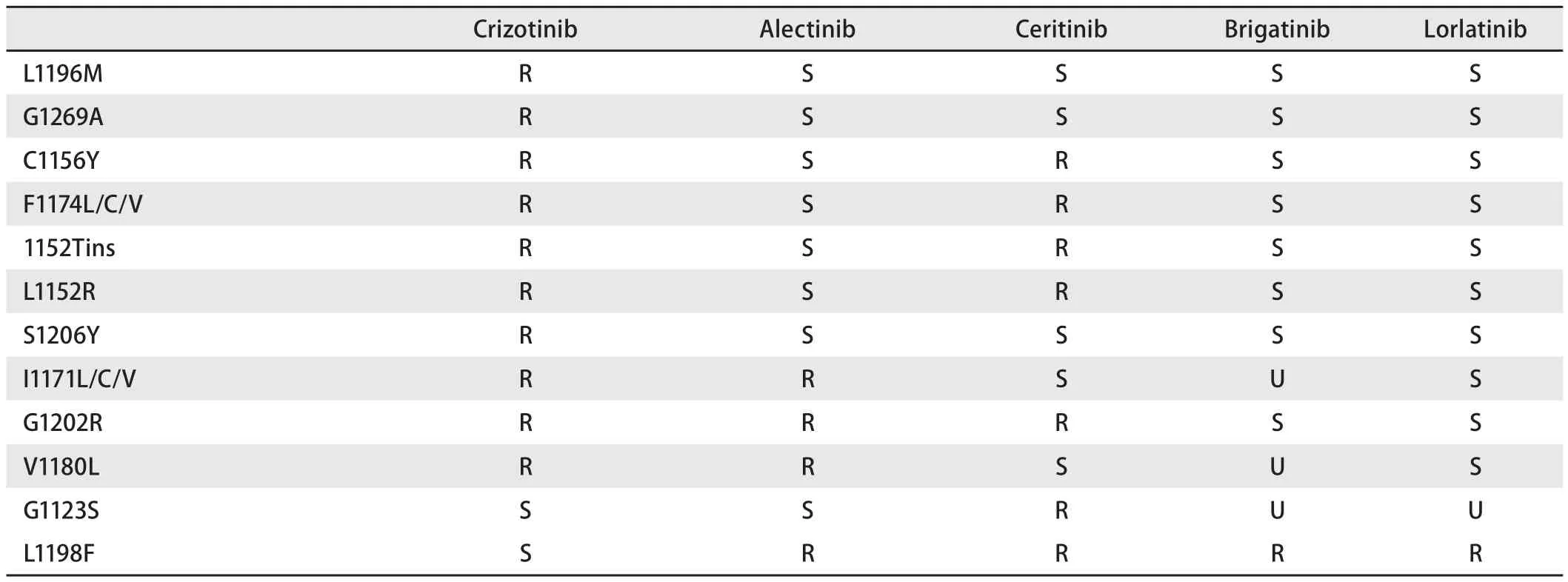
表1 5种ALK抑制剂的耐药和敏感突变(S:敏感,R:耐药,U:不清楚)Tab 1 Resistant and sensitive mutation of 5 ALK inhibitors ( S:sensitive,R:resistant,U:unclear)
另外,除了研发下一代更有效的ALK抑制剂克服耐药之外,ALT-TKI与旁路TKI或PD-1/PD-L1联合可能是克服耐药的新举措。期待相关临床试验的出现。

