关于二羧酸-三羧酸盐载体蛋白负调控黄瓜花叶病毒积累的初步研究
,
(浙江理工大学生命科学学院,杭州 310018)
0 引 言
黄瓜花叶病毒(Cucumbermosaicvirus,CMV)是属于黄瓜花叶病毒属(Cucumovirus)的典型成员,作为模式病毒已用于病毒致病性、病毒与寄主互作和病毒进化等方面的研究[1]。CMV是一种经济型重要的植物病毒,能侵染近1000种植物[2-3]。CMV是一种正义单链RNA病毒,其基因组是由三条正义单链RNA组成,按照大小依次命名为RNA1、RNA2和RNA3。CMV基因组每条RNA链的5’-端均具有帽子结构,且3’-端具有类似tRNA的结构(tRNA-like structure,TLS)[4-5]。RNA1是单顺反子,编码具有甲基转移酶结构域和解旋酶结构域的1a蛋白。RNA2编码含RNA聚合酶活性的2a蛋白,并通过其亚基因组RNA4A编码具有沉默抑制作用的2b蛋白[6-7]。CMV 1a和2a蛋白负责CMV的复制。免疫组化实验显示CMV 1a和2a蛋白定位于植物的液泡膜,由此推断CMV的复制场所为液泡膜[8]。RNA3编码两个开放阅读框(Open reading frame,ORF),其5’端ORF编码移动蛋白(Movement protein,MP),负责病毒的胞间移动和长距离移动[9]。第二个ORF则通过其亚基因组RNA4编码外壳蛋白(Coat protein,CP),负责病毒基因组的包装和参与病毒的长距离移动[10-11]。
植物内源的二羧酸-三羧酸盐载体蛋白(Dicarboxylate-tricarboxylate carrier,DTC)定位于线粒体膜和液泡膜,负责二羧酸盐和三羧酸盐的跨膜转运[12],参与氨基酸的初步合成、脂肪酸的代谢和类异戊二烯的生物合成等代谢途径[13-15]。拟南芥仅编码1个DTC基因,而烟草则编码4个DTC基因,分别为NtDTC1、NtDTC2、NtDTC3和NtDTC4[16]。目前关于DTC蛋白的功能研究较少,尚未见有关该蛋白参与生物胁迫的报道。为了探索DTC蛋白在病毒侵染方面的是否具有一定作用,本文通过烟草脆裂病毒(Tobaccorattlevirus, TRV)诱导的基因沉默和植物中瞬时过表达方法,分析本氏烟中NtDTC2下调表达与过表达对CMV编码蛋白的积累量影响,初步确定NtDTC2在CMV侵染寄主中的作用。
1 材料与方法
1.1 试剂
Q5超保真DNA聚合酶购于New England BioLabs公司、限制性内切酶购于Thermo Fisher Scientific公司、凝胶回收试剂盒及质粒小提试剂盒购于Axygen公司、RT-PCR试剂盒购于天根生物科技有限公司、eGFP抗体购于Santa Cruz biotechnology公司,常规生化试剂购于上海生工生物技术有限公司和Sigma贸易有限公司。
1.2 材料
本氏烟(Nicotianabenthamiana)幼苗于植物生长室中恒温培养,温度为25 ℃,光周期为16 h/8 h(光照/黑暗),待幼苗培养至两周以上用于农杆菌浸润。
CMV基因组RNA1、RNA2、RNA3的侵染性克隆pCB301-R1、pCB301-R2和pCB301-R3为实验室前期构建和保存,构建方法参考文献[17]。增强型绿色荧光蛋白(Enhanced green fluorescent protein, eGFP)替换2b ORF的侵染性克隆pCB301-R2-eGFP和eGFP替换CP ORF的侵染性克隆pCB301-R3-eGFP,由本实验室构建和保存。病毒诱导的基因沉默载体pTRV-RNA1(TRV1)、pTRV-RNA2(TRV2)由清华大学刘玉乐教授实验室提供。
1.3 植物总RNA提取
利用液氮将0.1 g叶组织研磨粉碎,然后加入1.0 mL RNA提取溶液(50 mmol/L pH值5.2 NaAC,10 mmol/L pH值8.0 EDTA 和1%SDS),继续研磨至匀浆。吸取匀浆至RNase-free的1.5 mL离心管中,加入等量的水饱和酚,涡旋混匀;在4 ℃,12000 r/min条件下离心6 min。之后吸取上清,按照3∶2的比例加入苯酚/氯仿混合液(1∶1混合),涡旋混匀;在4 ℃,12000 r/min条件下离心6 min后,吸取上清,然后用3倍体积的无水乙醇和1/10体积的3 mol/L NaAC (pH值5.2)沉淀RNA。最后,用DEPC水溶解RNA,利用Nanodrop测定所提RNA的浓度和纯度。
1.4 质粒的构建
通过常规的克隆方法构建DTC2的VIGS沉默质粒。实验方法为:利用oligo(dT)12作为反转录引物,逆转录合成本氏烟总RNA的cDNA,并用特异的引物进行PCR扩增。RT-PCR具体步骤根据天根生物科技有限公司RT-PCR试剂盒提供的说明。以合成的cDNA作为模板,利用VIGS引物对VIGS Nb-Dtc2 F/VIGS Nb-Dtc2 R(表1)扩增片段DTC2 VIGS,经过BamH I和SmaI消化后克隆至预先用相同限制性内切酶处理的载体pTRV2,经挑取单斑鉴定后提取质粒pTRV2-DTC2。构建瞬时过表达本氏烟DTC2的质粒p35S-DTC2。具体构建方法为:以本氏烟cDNA为模板,利用引物对Dtc2-OE-F/Dtc2-OE-R(表1)扩增DTC2全长编码序列,经EcoRI和BamH I消化后克隆至预先用相同限制性内切酶处理的质粒p35S-Flag-HA,获得重组克隆质粒p35S-DTC2。所有质粒需经序列测定以保证序列的准确性。质粒转化农杆菌,挑斑鉴定后,保存于-80 ℃。

表1 构建质粒的引物序列
1.5 农杆菌浸润接种
取50 μL保存于-80 ℃的农杆菌(含相应的质粒)于含有抗生素利福平(30 mg/L)、庆大霉素(50 mg/L)和卡那霉素(50 mg/L)的5 mL的LB液体培养基中,于28 ℃摇床,220 r/min的条件下培养16 h对菌种进行菌种活化和扩大培养,离心收集各个农杆菌的菌体,最后将菌液悬浮于浸润缓冲液(10 mmol/L MgCl2、10 mmol/L MES和200 mmol/L乙酰丁香酮)中。利用分光光度计测量菌液在600 nm下的OD值,调整TRV1、TRV2-DTC2、TRV2菌液OD值为0.2,调整35S-DTC2、35S-Flag-HA、pCB301-R1、pCB301-R2、pCB301-R3、pCB301-R2-eGFP以及pCB301-R3-eGFP菌液OD值为0.5。按照TRV1与TRV2-DTC2、TRV1与TRV2的组合将菌液等体积混合。混合后的菌液于暗处放置2~3 h,通过注射器接种于4~5叶期本氏烟。CMV注射后5 d,在紫外灯下观察GFP荧光,并拍照保存。
1.6 本氏烟总蛋白提取及Western blot检测
从0.2 g叶组织中提取植物总蛋白,具体操作方法参考文献[18]。蛋白样品需经酶标仪定量后,通过聚丙烯酰胺凝胶电泳分离。利用转膜仪,在电压100 V的条件下转膜1 h,将蛋白质转移至硝酸纤维素膜。为了分析CMV编码的eGFP的积累量,利用eGFP多克隆抗体进行蛋白杂交检测。结合一抗和二抗后,分别在TBST中洗膜三次,每次10 min,之后在TBS中洗膜10 min。利用ECL检测膜并通过X射线胶片的放射自显影来显现蛋白的特异性条带。
2 结果与分析
2.1 pTRV2-DTC2重组克隆的构建
从本氏烟中提取植物总RNA,通过反转录得到本氏烟的cDNA,以cDNA为模板,利用VIGS Nb-Dtc2 F/VIGS Nb-Dtc2 R引物对扩增DTC2 VIGS的DNA片段,片段预期大小约300 bp。PCR产物的电泳结果如图1(a)所示,PCR产物的扩增片段位于略高于250 bp条带的位置处,其大小与预期片段大小相符。将PCR扩增获得的目的DNA片段经BamH I和SmaI酶切,克隆至pTRV2载体,获得pTRV2-DTC2重组质粒,其电泳结果如图1(b)所示。重组质粒经PCR鉴定和测序,确定重组质粒含有目的片段的插入,且序列未见任何的突变。
图1 pTRV2-DTC2质粒的构建
2.2 pDTC2-OE质粒的构建
以本氏烟的cDNA为模板,利用Dtc2-OE-F/Dtc2-OE-R引物对扩增DTC2的全长cDNA,片段大小约800 bp,PCR产物的电泳结果如图2(a)所示。PCR扩增产物位于750~1000 bp条带之间,与预期的片段大小相符。将PCR扩增获得的DTC2-OE片段经限制性内切酶EcoRI和BamH I消化后,克隆至载体p35S-Flag-HA,获得过表达重组质粒p35S-DTC2。电泳检测质粒p35S-DTC2如图2(b)所示,电泳图显示质粒p35S-DTC2的大小与预期相符。质粒经PCR检测和序列测定,确定为含有目的片段的阳性克隆。
图2 p35S-DTC2质粒的构建
2.3 TRV下调的DTC2 mRNA对CMV积累的影响
为了沉默本氏烟体内的DTC2 mRNA,将TRV1和TRV2-DTC2混合注射入本氏烟叶片,并以混合注射TRV1和TRV2作为阴性对照。注射后12 d,在注射叶的上部叶片接种CMVΔ2b-eGFP。接种病毒5 d后,在紫外灯下观察各个处理的绿色荧光,结果如图3所示。与阴性对照组TRV2处理的植株相比,CMVΔ2b-eGFP在TRV2-DTC2处理的叶组织中呈现更强的绿色荧光。在接种病毒后5 d,采取病毒接种叶,并提取其总蛋白;以Rubisco为二磷酸核酮糖氧合酶,作为植物内参蛋白用于确定蛋白的上样量,通过Western blot检测接种叶中eGFP的积累量,结果显示:eGFP的积累量在TRV2-DTC2处理的叶组织中比对照组提高48%(图4),因此DTC2的下调表达促进CMV携带的eGFP蛋白的积累,初步说明DTC2对CMV侵染本氏烟具有负调控作用。

图3 紫外灯下观察DTC2下调后CMVΔ2b-eGFP病毒产生的GFP荧光
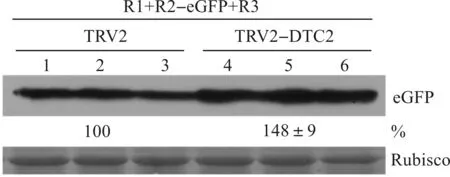
图4 Western杂交检测DTC2下调对后CMVΔ2b-eGFP病毒蛋白积累量
2.4 DTC2的过量表达对CMV积累的影响
为了进一步分析DTC2对CMV积累的负调控作用,本文通过农杆菌介导的瞬时过表达方法,测定DTC2的过表达对CMV积累的影响。在同一叶片上注射3个浸润斑,分别为Mock(只接种浸润缓冲液)、Vector(35S-Flag-HA)和35S-DTC2。浸润3 d后,在原来的浸润斑的位置接种CMVΔCP-eGFP,Mock组仍只接种浸润缓冲液。病毒接种3 d后,在紫外灯下观察绿色荧光的强度,结果如图5所示。在Vector和35S-DTC2处理的区域均出现明显的GFP绿色荧光,表明CMVΔCP-eGFP接种区域已有效地复制和翻译。与对照Vector相比,过量表达DTC2蛋白的注射斑的绿色荧光相对较弱。病毒接种3 d后分别采取每个注射斑的叶片样品,利用Western blot检测eGFP的积累量。结果显示,本氏烟中过量表达DTC2蛋白后,CMV携带的eGFP的积累量与对照组相比减少24%(图6),这表明DTC2对CMV确实具有一定的影响,进一步说明DTC2对CMV有一定的负调控作用。

图5 紫外灯下观察DTC2过表达对CMVΔCP-eGFP产生GFP荧光的影响

图6 Western杂交检测DTC2过表达对CMVΔCP-eGFP产生的GFP蛋白积累量的影响
3 讨 论
就DTC蛋白的功能而言,除了跨膜转运二羧酸盐和三羧酸盐的功能之外[15],尚未有其它功能的报道。本文通过基因沉默和过表达本氏烟DTC2,初步确定DTC2负调控CMV的积累。寄主因子负调控病毒积累的途径包括降低病毒RNA的翻译和复制效率以及降低病毒RNA的体内稳定性。拟南芥编码的RNA结合蛋白APUM5通过结合CMV RNA的3’UTR,抑制病毒RNA的翻译,从而负调控病毒的积累[19]。siRNA介导的抗病毒沉默是降低CMV RNA稳定性的主要途径,但是,CMV通过其编码的RNA沉默抑制子2b蛋白竞争性地结合siRNA,能有效地抑制寄主的抗病毒RNA沉默[20-21]。由于本氏烟DTC2与CMV的复制场所均位于液泡膜,本氏烟DTC2可能参与调控CMV的翻译或复制。除了寄主的蛋白因子之外,膜脂质也参与病毒的复制,并扮演重要的角色。磷脂酰乙醇胺(Phosphatidyl ethanolamine,PE)和卵磷脂(Phosphatidylcholine,PC)分别正调控番茄丛矮病毒(Tomatobushystuntvirus,TBSV)和雀麦花叶病毒(Bromemosaicvirus,BMV)的复制[22-23]。DTC介导的二羧酸盐和三羧酸盐的跨膜转运能够参与脂肪酸的代谢途径[14-15]。因此,本氏烟DTC2的下调表达或过表达有可能影响植物体内脂质的合成代谢,从而间接地影响CMV的积累,关于DTC2调控CMV积累的分子机制仍有待进一步的研究。
4 结 论
本文通过构建DTC2的沉默载体以及过表达载体,在本氏烟中下调表达或过表达DTC2后,Western blot分析CMV编码的GFP量的变化,主要结论如下:
a) 本氏烟DTC2下调表达促进CMVΔ2b-eGFP的积累;
b) 本氏烟DTC2过表达抑制CMVΔCP-eGFP的积累。
基于以上结果,初步确定本氏烟DTC2蛋白在植物中负调控CMV的积累,DTC2调控CMV侵染寄主植物的分子机制有待于进一步研究。

