动情期和动情间期雌性小鼠GR和TH的免疫活性及血清CORT水平的比较
程广超,杨 斌,王建礼,桂长莉
(北方民族大学生物科学与工程学院,宁夏银川 750021)
雌性动物的动情周期分为动情前期(proestrus)、动情期(estrus)、动情后期(metestrus) 和动情间期(diestrus),相应地外周血雌激素和孕激素水平也有一个周期的变化,二者在动情前期处于高峰水平[1]。受到卵巢雌激素和孕激素波动的影响,动情周期会影响雌性动物的行为和情绪。例如,雌性动物的性行为会随动情周期变化,处于动情前期雌性大鼠的气味对雄性最具吸引力,在动情间期最缺乏吸引力;小家鼠(Musmusculus)的配偶选择也依赖于动情状态[2]。动情前期小鼠和大鼠的空间记忆或物体识别能力比动情期和动情间期高[3-4]。动情间期雌性大鼠的焦虑水平和抑郁水平高于动情前期及动情期[5-6],并且一些药物的抗抑郁效应也由此与动情周期有关[7]。应激系统特别是下丘脑-垂体-肾上腺 (hypothalamic-pituitary-adrenal axis,HPA)轴对调控动物行为及情绪至关重要。雌激素可以调节HPA轴对应激的反应[8]。在HPA轴调节的应激反应中,海马糖皮质激素受体(glucocorticoid receptor,GR)是一个关键位点,主要通过与皮质酮(corticosterone,CORT)结合调节应激反应。酪氨酸羟化酶(tyrosine hydroxylase,TH)是儿茶酚胺的限速酶,它标记的神经元包括多巴胺(dopamine,DA)和去甲肾上腺素(norepinephrine,NE)。在神经递质中DA和NE被公认为参与动机活动的调节,与情绪和奖赏有关[9-10]。本试验主要比较了动情期和动情间期CORT水平以及海马中GR神经元和奖赏相关脑区中TH神经元的免疫活性,以期进一步探讨动情周期影响雌性动物行为改变的神经内分泌机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年雌性ICR小鼠,购自宁夏医科大学实验动物中心。饲养于塑料饲养笼(32×21.5×17 cm3),每笼4只,木屑做垫料,饲料和饮水充足。室温25℃,光照周期12 L∶12D,食物、饮水充足。室内适应饲养2周后,开始试验,实验动物分为2组,动情期组(n=6)和动情间期组(n=6)。
1.1.2 主要仪器及试剂 冷冻切片机,德国Leica公司生产;小鼠血清雌二醇(estradiol,E2)和CORT酶联免疫吸附试验试剂盒,苏州卡尔文科技公司产品;TH兔抗多克隆抗体,英国Abcam公司产品;GR兔抗多克隆抗体,美国Santa Cruz公司产品,中杉金桥生物技术有限公司分装;SABC试剂盒和DAB显色剂,武汉博士德生物工程有限公司产品。
1.2 方法
1.2.1 动情周期的检测 用阴道上皮细胞亚甲基蓝染色法检测动情周期。移液枪吸15 μL生理盐水,对小鼠阴道进行反复冲洗。将含有阴道脱落细胞的液体涂抹到载玻片上,干燥,用10 mg/mL亚甲基蓝染色。动情前期涂片显示的主要是有核上皮细胞,偶有少量角化细胞;动情期涂片中则是无核角化细胞或偶有少量上皮细胞;动情后期出现有核上皮细胞、无核上皮细胞和白细胞;动情间期的涂片中存在大量的白细胞(图1)。

A.动情前期;B.动情期;C.动情后期;D.动情间期;NEC.有核上皮细胞;NNEC.无核上皮细胞;WBC.白细胞
A.Proestrus;B.Estrus;C.Eetestrus;D.Diestrus;NEC.Nucleated epithelial cell;NNEC.Non nuclear epithelial cell;WBC.White blood cell
图1雌性ICR小鼠阴道上皮细胞亚甲基蓝染色结果(比例尺=400 μm)
Fig.1 Vascular epithelial cells of female ICR mice stained with methylene blue(Bar=400 μm)
1.2.2 酶联免疫吸附试验(ELISA)检侧 动物经腹腔注射戊巴比妥钠麻醉。通过心脏采血收集血液样本,样本收集20 min后离心,血清在测定前贮存于-20℃冰箱中。通过小鼠血清E2和CORT酶联免疫试剂盒检测,检测方法遵循酶联免疫试剂盒使用说明书。
1.2.3 免疫组织化学染色 动物麻醉后先用40 mg/mL多聚甲醛进行灌注固定,取出脑组织放入40 mg/mL多聚甲醛后固定过夜(4℃),其后4℃下置于300 g/L蔗糖溶液直至组织沉底。用冷冻切片机将脑切片,片厚40 μm。用山羊血清封闭液37℃湿盒内封闭1 h。滴加由抗体稀释液稀释的一抗:TH(1∶1 000)和GR(1∶100)4℃孵育72 h。0.01 mol/L PBS漂洗5 min,漂洗3次。滴加生物素化羊抗兔IgG,37℃湿盒内孵育1.5 h。0.01 mol/L PBS漂洗5 min,漂洗3次。滴加SABC试剂,37℃湿盒内孵育2.5 h。0.01 mol/L PBS漂洗10 min,漂洗4次。DAB显色剂显色。常规酒精脱水,二甲苯透明,中性树胶封片。
各脑区参照文献[11]。每只鼠的各核团选择3张连续的切片量化,利用显微测微尺,计算相同面积内单侧脑区核团的阳性神经元数目,包括海马CA1、CA2/3和齿状回(Dental gyrus,DG)的GR表达以及中脑腹侧被盖区(ventral tegmental area,VTA)、下丘脑室旁核(paraventricular nucleus,PVN)和黑质网状部(substantia nigra reticular part,SNr)的TH表达。
1.2.4 统计方法 所有数据用SPSS13.0软件进行统计分析。One-sample Kolmogorov-Smirnov检测数据正态性。独立样本t检验分析组间差异。显著性水平为P<0.05。
2 结果
2.1 血清E2和CORT水平
与动情间期的雌性小鼠相比,动情期雌性小鼠的血清E2浓度显著增加(P<0.01)(图2),但CORT浓度无显著差异(P>0.05)(图2)。
2.2 GR-IR和TH-IR神经元的表达
与动情间期的雌性小鼠相比,动情期雌性小鼠在海马CA1(P<0.01)和DG(P<0.05)具有更多的GR-IR神经元,但CA2/3的GR-IR神经元数量无显著差异(P>0.05)(图3)。
与动情间期组相比,动情期的PVN内TH-IR神经元数量显著增加(P<0.05);经检验两组VTA的TH-IR样本方差不具有同质性(P<0.05),动情期VTA内TH-IR神经元数量显著增加(P<0.05);SNr脑区内TH-IR神经元数量差异不显著(P>0.05)(图4)。
动情期和动情间期雌性ICR小鼠GR和TH免疫组织化学染色情况见图5。

图2 动情期和动情间期雌性ICR小鼠血清E2 和CORT的浓度

图3 动情期和动情间期雌性ICR小鼠GR-IR神经元的数量
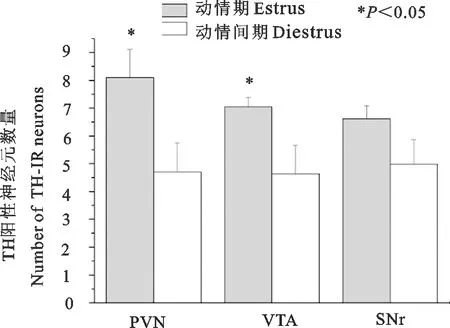
PVN.下丘脑室旁核;VTA.中脑腹侧被盖区;SNr.黑质网状部
PVN.Paraventricular nucleus;VTA.Ventral temental area;SNr.Substantia nigra reticular part
图4动情期和动情间期雌性ICR小鼠TH-IR神经元的数量
Fig.4 The number of TH-IR neurons in female ICR mice in estrus and diestrus
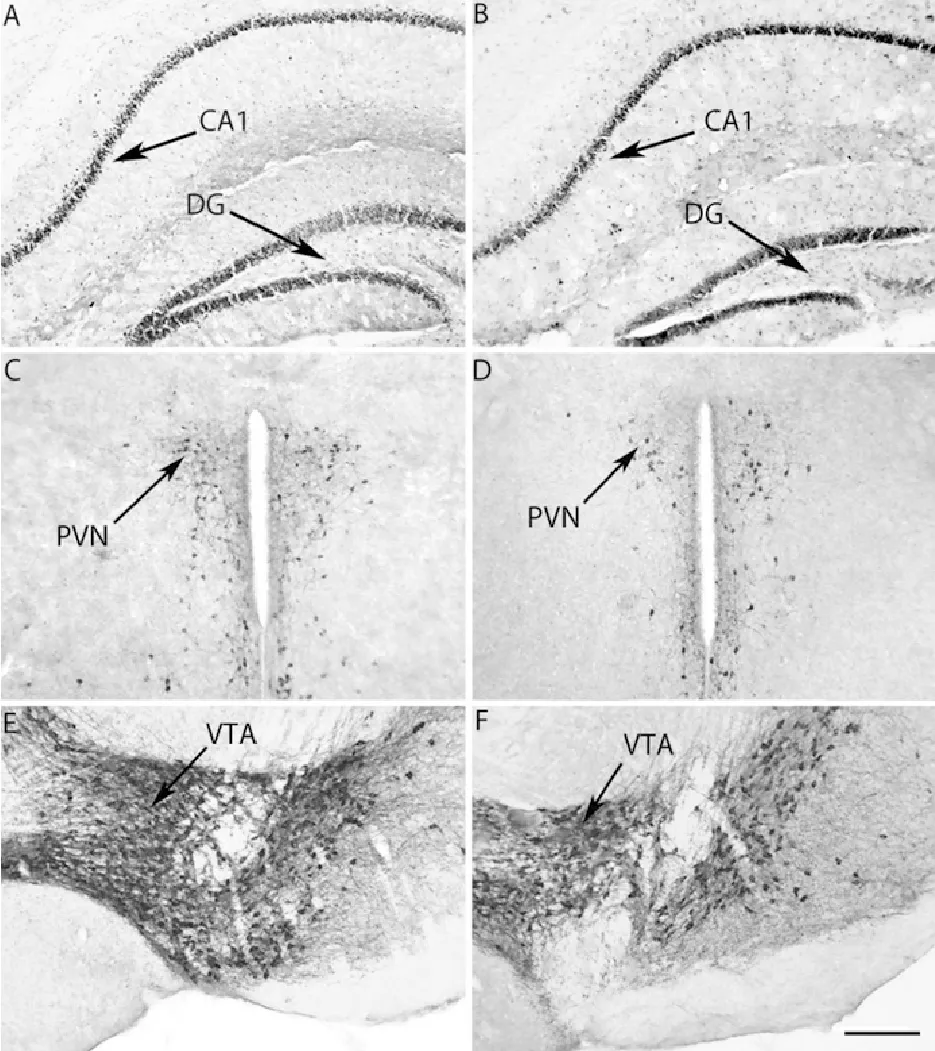
A、C、E.动情期;B、D、F.动情间期;DG.齿状回;PVN.下丘脑室旁核;VTA.中脑腹侧被盖区
A,C,E.Estrous;B,D,F.Diestrous;DG.Dentate gyrus;PVN.Paraventricular nucleus;VTA.Ventral temental area
图5动情期和动情间期雌性ICR小鼠GR(A,B)和TH(C,D,E,F)免疫组织化学染色结果(比例尺=100 μm)
Fig.5 GR (A and B) and TH(C, D, E and F) immunopositive staining in estrus and diestrus female ICR mice(Bar =100 μm)
3 讨论
雌性小鼠在卵巢表现出周期性排卵、雌激素水平表现出周期性变化的同时,其阴道细胞也呈现出周期性变化,因而可通过阴道细胞的变化判断其动情周期。动情前期和动情期是卵巢排卵期,动情后期是分泌孕酮及黄体形成的时期。本试验结果表明,动情期雌性ICR小鼠的血清E2浓度高于动情间期。这已在许多实验动物得到证实,例如,雌性大鼠的雌激素水平在动情期最高[12],恒河猴(Rhesusmacaques) 在排卵期时雌激素水平最高[13]。有研究认为,雌激素能直接或间接地调节HPA轴的活性[14]。雌二醇可以刺激肾上腺皮质细胞分泌CORT,摘除卵巢可降低应激诱导的HPA轴反应水平,再给予雌激素后,可恢复正常水平[15]。本试验中尽管动情期和动情间期血清E2水平有明显差异,但CORT水平没有显著性差异。这与一些研究发现相似,例如,尽管动情前期雌性大鼠的CORT水平比动情间期高,但动情期和动情间期没有差异[16]。有趣的是,我们发现动情期小鼠海马CA1和DG的GR-IR表达高于动情间期。海马是GR含量最高的脑区,主要参与对HPA轴的负反馈抑制,应激状态下过量的糖皮质激素(glucocorticoid,GC)与海马的GR结合,使海马发出负反馈指令,抑制促肾上腺皮质激素释放因子(corticotropic-releasing factor,CRF)的过度释放,从而抑制HPA轴过度激活,降低体内过高的GC水平,使机体的激素水平维持稳态。因此,海马GR的激活对于减少CORT、焦虑和应激至关重要[17]。本试验中动情期小鼠海马GR-IR神经元的高水平表达意味着GR参与了对CORT的反馈调节,尽管没有检测到CORT水平的变化,但它可能是对动情前期CORT水平升高响应的延续;也可能是动情期升高的雌激素水平间接地调节了海马GR的升高[18]。
本研究发现动情期PVN的TH-IR神经元表达高于动情间期。PVN参与对应激反应的调节[19]。血液中雌激素的波动会引起脑区儿茶酚胺水平的改变。丘脑儿茶酚胺减少能够抑制排卵。TH是儿茶酚胺的限速酶,PVN中TH升高更多地与NE释放有关[20]。应激引起生理变化时,NE会升高,因此,它伴随着HPA轴的活动而改变。尽管SNr的TH-IR神经元的表达没有明显差异,但VTA在动情期较动情间期有更多的TH-IR神经元。VTA可以影响动物的社会行为。奖赏是促进动物行为表达的基础,实现天然奖赏的主要神经通路是中脑-边缘-皮质多巴胺系统(mesocorticolimbicdopamine system,MCLDS)。在MCLDS通路中,DA能神经元的胞体主要位于VTA,VTA能够产生DA[21],VTA中TH免疫活性的升高意味动情期较动情间期合成了或释放了更多的DA。DA有效地刺激促卵泡激素释放因子(follicle stimulating hormone releasing factor,FRF)分泌和黄体生成激素释放因子(Iuteinizing hormone releasing factor,LRF)释放[22],LRF可促进排卵。也有研究发现,E2通过DA能神经元减少黄体生成素(Iuteinizing hormone,LH)的脉冲频率会引起母羊不动情。长期注射DA受体拮抗剂舒必利(sulpiride)会诱导不动情的母马和母羊排卵[23]。这些试验暗示DA可从下丘脑-垂体-性腺((hypothalamic-pituitary-gonadal axis,HPG)轴的上游和下游调节动情状态和排卵。研究表明,雌激素对VTA的DA能神经元活动有调制作用,动情期的大鼠DA神经元放电频率增加[24]。因此,动情期VTA中TH免疫活性的增加,可能受到E2升高的影响,通过影响TH的活性,雌激素可以调制DA介导的行为。
总之,在动情期和动情间期雌性ICR小鼠海马GR神经元及PVN和VTA的TH神经元免疫活性不同。由于应激系统及儿茶酚胺在动物的行为和情绪中具有重要作用,因此,本试验的结果有助于进一步解释动情周期对雌性相关行为的影响。

