空气暴露时间对林麝粪便孕酮水平的影响
唐 婕,李晶晶,王 波,索丽娟,王 艳*,严兴荣*
(1.陕西省动物研究所, 陕西西安 710032;2.西北大学生命科学学院陕西省西部资源与生物技术教育部重点实验室,陕西西安 710069;3.陕西省野生动物保育重点实验室,陕西西安 710069)
林麝是我国特有的能产麝香的野生动物。麝香仅雄性林麝产生,其生殖器和肚脐之间有一个产麝香的香囊。麝香是名贵中药材,是多种传统中药方剂的主要原料。为了获取麝香,林麝遭到肆意捕杀,数量急剧减少,被列为国家一级保护动物。林麝一年发情一次,主要集中在秋冬季节,雌麝这个时期错过交配机会或空怀,则需等到第二年发情期。因此,早期林麝妊娠诊断可充分利用林麝现有种质资源,减少空怀数量,进行大量繁育。目前,还没有有效的林麝早期妊娠诊断方法,虽有研究报道,但均处于研究阶段。早期妊娠诊断在人类医学上已经成熟,如利用超声和试纸条技术,胎儿在4周末出现点状的囊腔结构,6周可出现胎儿的心跳搏动,所以超声诊断在人妊娠诊断中准确度较高的时期是第6周[1]。牛的超声早期妊娠诊断可在28 d~30 d就可用胚囊环和胎儿心跳进行确诊,也可通过直肠触摸的方式鉴定是否妊娠[2]。羊的妊娠诊断很少用超声诊断方法[3]。一般的羊场数量较多,用超声的方法操作难度大,通过试情的方法,观察动物返情情况,根据返情行为推测其是否妊娠[4]。野生动物早期妊娠诊断的研究报道较少,圈养野生动物有用超声诊断的报道,但报道较少[5]。除了超声诊断,通过妊娠相关激素检测进行妊娠诊断的方法报道较多,人妊娠试纸条是检测尿液的人绒毛膜促性腺激素( human chorionic gonadotropin,hCG)含量,观察妊娠情况,但由于物种差异,人的妊娠试纸条很难应用到其他动物。孕酮是妊娠早期由黄体分泌的甾体激素,主要涉及动物妊娠的维持。人妊娠诊断用孕酮和hCG来预测妊娠状态。有研究用猪粪便中孕酮含量来诊断其妊娠状态并监测卵巢机能[6]。马鹿不同季节粪便中孕酮也呈周期性变化,同时也可评估动物健康状态,或作为早期妊娠检测的手段[7]。类固醇激素检测方法相关报道较多,如酶联免疫吸附剂试验(enzyme linked immunosorbent assay,ELISA)和高效液相色谱(high performance liquid chromatography, HPLC)。ELISA实用性较广,已经有对林麝、羊、猪、骆驼和猴等动物类固醇激素检测的研究报道[3,8-9]。HPLC也常用于类固醇激素的检测,张立雯等[10]用HPLC检测大鼠血浆和子宫孕酮浓度,同时可对孕酮及其代谢物进行药代动力学研究。也有研究发现,HPLC可对孕酮、丙酸睾酮和苯甲酸雌二醇进行精确定量[11],这些结果对本研究提供了参考。
林麝是新兴的圈养动物,很多饲养技术均来自长期的实践和借鉴其他家养动物的经验。林麝早期妊娠诊断是圈养林麝技术的关键环节。林麝天生孤僻胆小,妊娠早期通过抓捕等手段进行超声诊断有导致流产的可能。因此,粪便类固醇激素的检测是目前首选的诊断方法。目前关于林麝粪便类固醇激素的研究报道较多,类固醇激素在体外保存的时效性,发情周期孕酮的变化均有研究报道[12-14]。本研究在前人研究基础上,利用ELISA和HPLC两种方法检测林麝粪便孕酮含量进行比较;野生动物粪便均在野外和山区进行采集,采集时间的新鲜度难以保证,本研究探索不同新鲜度粪便孕酮的水平变化及确定妊娠和非妊娠林麝粪便孕酮水平,为孕酮用于妊娠诊断奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验用动物 圈养林麝,饲养于凤县周家庄蒋家沟逢春林麝繁育基地,自由饮食,除饲养员外没有其他外界因素干扰。
1.1.2 采样和粪便处理 确定妊娠中期和非妊娠的林麝各3只,每隔1 d采集粪便1次,共采集3次,每次采集后进行激素提取。采集妊娠期的粪便,在空气暴露不同时间,分别于暴露0、2、4、6 d。在不同时间收集粪便,直接提取孕酮。
1.1.3 主要试剂 粪便DNA提取试剂盒,MP Biomedicals公司产品;PCR mix,近岸蛋白质科技有限公司产品;甲醇、乙腈,美国Fisher公司产品;Agilent TC-18(250 mm×4.6 mm,5 μm),安捷伦科技公司产品;磷酸,天津市瑞金特化学品有限公司产品;鹿孕酮检测试剂盒,上海岚派生物公司产品。
1.2 方法
1.2.1 DNA提取和PCR 称取0.3 g新鲜粪便,用粪便DNA提取试剂盒分离粪便总DNA,具体方法按照试剂盒的操作指南进行。以林麝的内参基因GAPDH(forward:3′-TCACCGAGGCTGCTTTTAAT-5′; reverse:3′-GATCTCGCTCCTGAGAGATG-5′)来检测粪便是否来自于林麝,PCR体系为20 μL,引物0.3 μL,模版0.3 μL,无菌双蒸水(ddH2O) 9.4 μL,PCR mix 10 μL,混匀,离心备用,每次做3个重复。PCR条件为:94℃ 5 min;94℃ 30 s,59℃ 30 s,72℃ 1 min,共35个循环;72℃ 10 min,4℃ 10 min。PCR产物用15 g/L琼脂糖凝胶电泳分离目的条带,在凝胶成像系统中观察结果。
1.2.2 孕酮提取 称取0.5 g粪便样本,按照以前报道的方法提取激素。称取0.5 g林麝粪便,每个样本称取2份,1份用于提取激素,另1份在120℃烘干30 min,称取烘干后粪便质量。提取激素的粪便,用提取液(甲醇∶水=9∶1)5 mL与研磨后的粪便充分振荡混匀,在试管中蒸20 min,1 500 r/min离心10 min,取上清,再次加入5 mL提取液振荡混匀,1 500 r/min离心10 min收集溶液,蒸干加入1 mL甲醇充分溶解,用1.5 mL EP管收集后立即检测或置-20℃保存备用。
1.2.3 孕酮含量测定
1.2.3.1 HPLC法 HPLC测定孕酮含量方法参照文献[10]的色谱条件。使用Agela Venusil C8 (4.6 mm ×250 mm,5 μm)色谱柱,乙腈∶水= 60∶40 (水中加1 g/L磷酸), 流速0.8 mL/min, 检测波长240 nm,柱温40℃,进样量10 μL。
标准溶液的配制:混合对照工作液,以甲醇为溶剂配制贮备液,黄体酮浓度为3.2 mg/mL。将贮备液用倍数稀释法稀释成含系列浓度的对照工作液,浓度分别为3.2 mg/mL、320 μg/mL、3.2 μg/mL、320 ng/mL。
测定方法:处理好的样品经0.22 μm的滤膜过滤,吸取预处理所得样品上清液10 μL,注入色谱仪,记录测定组分峰面积,代入随行标准曲线求得样品中所含测定组分的浓度。
1.2.3.2 ELISA法 用ELISA检测甲醇中的孕酮含量参照文献[15]方法。试剂盒用鹿孕酮检测试剂盒(DM-D10706),具体方法按照试剂盒操作指南进行,先按照说明书制作标准曲线,同时增加样品孔,检测样本孕酮浓度。
1.2.4 统计分析 每个样本检测的结果,用粪便干重进行矫正,即用ELISA检测结果与粪便干重进行计算干重粪便的孕酮含量,单位为ng/g。试验独立重复3次,数据用Spass 13.0软件处理,用t检验进行显著性检测,P<0.05为差异显著。结果用平均值±标准差表示。
2 结果
2.1 粪便空气暴露显著降低粪便水分和改变粪便形态
新鲜粪便表面光泽、平滑,随着空气中暴露时间延长,粪便表面粗糙程度增加,并失去光泽(图1)。
由图2可知,本研究6个粪便样本均来源于林麝。
4 d 和6 d的粪便湿重和干重的比例率显著低于0 d(P<0.05),2 d的水分丢失率与0 d无显著差异(P>0.05) (图3)。且以林麝内参基因GAPDH为引物进行PCR显示有相应条带(图2)。结果表明,林麝颗粒状粪便在体外空气暴露可逐渐失水和表观变化,且可为确定采集林麝粪便的排粪时间提供参考。

A.0 d;B.2 d;C.4 d;D.6 d
图1空气暴露不同时间的粪便形态
Fig.1 Morphology of feces in different time of air exposure
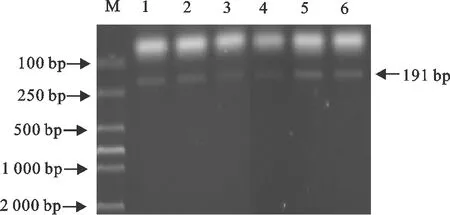
M.DNA 标准DL 2 000;1~6.样品
M.DNA Marker DL 2 000;1-6.Sample
图2粪便PCR检测结果
Fig.2 PCR result of feces
2.2 高效液相不能有效检测粪便孕酮
如图4所示,高效液相检测孕酮最低分析峰的浓度为32 μg/mL,检测粪便样本时没有峰出现,通过孕酮酶联免疫试剂盒分析发现,样本的浓度为460 ng/mL,说明林麝粪便孕酮浓度显著低于高效液相的最低检测限,因此高效液相不适用于林麝粪便孕酮的检测。
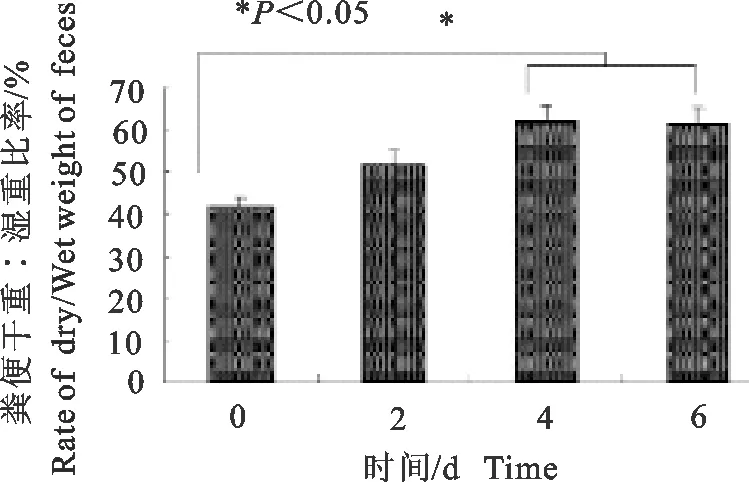
图3 空气暴露不同时间的粪便失水率
2.3 空气暴露对孕酮水平的影响
空气暴露不同时间的粪便提取的孕酮,孕酮含量随时间延长而减少,其中空气暴露4 d和6 d的孕酮含量显著低于0 d(P<0.05)。空气暴露2 d与0 d相比,孕酮含量降低,但差异不显著(P>0.05)(图5)。粪便空气暴露,孕酮也直接与空气接触,同时孕酮在粪便内大量复杂的微生物环境时间也延长,这些因素可能导致孕酮逐渐降解。
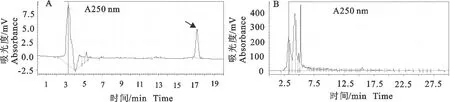
A.最低检测浓度的孕酮色谱峰,箭头指示孕酮色谱峰;B.高效液相检测林麝粪便样本,无分析峰出现
A.Chromatographic peak was detected at lowest concentration of progesterone,arrow indicats the chromatographic peak;B.Sample from feces of forest musk deer was detected by HPLC,chromatographic peak no appears
图4高效液相检测孕酮含量
Fig.4 Detection of progesterone level by HPLC
2.4 妊娠期孕酮保持较高水平
连续采集5 d的粪便样本提取孕酮,发现连续5 d妊娠林麝粪便孕酮含量显著高于非妊娠林麝,如1 d(P<0.05 )、3 d(P<0.05)和5 d(P<0.05) (图6)。结果发现,妊娠中期的孕酮含量均高于150 ng/g,而非妊娠个体低于150 ng/g。这证明妊娠着床后,胎盘逐渐代替黄体成为孕酮分泌的主要器官,早期所分泌的孕酮显著高于非妊娠个体,为后续孕酮诊断方法的优化奠定基础。

图5 林麝粪便空气暴露不同时间与孕激素水平

图6 妊娠林麝粪便孕酮水平
3 讨论
林麝是我国特有的经济动物,也是我国一级濒危保护动物,同时也是我国新兴的圈养动物。林麝是秋冬季发情的动物,在发情季节交配,如果交配失败或中途妊娠终止,需要等到下一年的发情期[16]。因此对林麝妊娠的鉴定具有重要意义。确定是否交配成功,除了饲养过程观察是否发生性行为,就是人为判定发生了交配行为。如果这个发情季节没有交配成功,则又耽误了林麝的繁殖机会。林麝的人工授精技术虽然有研究报道,但林麝数量少,市场价值高,这项技术很难进行广泛应用。因此,对林麝早期妊娠的鉴定,提高繁殖效率尤为重要。孕酮是排卵后颗粒细胞分化而来的黄体细胞分泌的激素,是维持哺乳动物妊娠的重要激素,因此,孕酮是鉴定妊娠的候选因子之一[17]。粪便采集尤其是野外场地的采集,不能及时进行冷冻保存。因此,需要检测粪便在空气暴露时间过长是否会影响孕酮含量的检测。
有研究将新鲜采集的粪便置于甲醇溶液中,置-20℃保存备用。也有研究将提取的孕酮溶解在甲醇中,在-20℃保存不同时间,发现在1个月内没有显著降解。也有研究将粪便直接在-20℃保存,孕酮可在相当长的时间保持不变,但反复冻融能影响其浓度[18]。孕酮能在低温下长期保持与本研究的结果相反,本研究发现,在野外条件下,空气暴露不同时间,孕酮含量在第4天后显著下降。关于这方面的研究报道较少,这可能是由于孕酮在粪便复杂微生物及空气氧化的作用下降解加速[19]。
孕酮用于动物妊娠诊断具有广阔的应用前景,根据孕酮含量和持续时间可判断动物的生理状态。李咏梅[9]用外周血孕酮含量诊断双峰驼早期妊娠取得了良好效果,诊断成功率达100%。有研究用母猪粪便为材料,用酶联免疫的方法检测孕酮含量预测母猪妊娠[20]。有研究认为粪便孕酮浓度大于200 ng/g为妊娠,小于这个浓度为非妊娠[21],这与我们测定的数据相似(90 ng/g~360 ng/g)。本研究孕酮可作为妊娠检测的证据,但同时本研究也发现,通过单次检测粪便孕酮水平评价妊娠状态误差较大,需要连续多次检测。胚胎着床前孕酮主要由黄体分泌,着床后主要由胎盘分泌[22]。正常繁殖周期,孕酮水平也发生周期性变化,受精后孕酮水平不会发生周期性变化,同时还会由于胎盘的分泌补充,孕酮水平增高[23-24]。因此,孕酮作为妊娠鉴定候选因子,主要将妊娠持久黄体分泌孕酮与周期性黄体分泌孕酮区分,这就需要多次检测,监控孕酮水平,可提高妊娠检测的准确性。除了妊娠检测,孕酮水平也可反映繁殖季节野生种群雌性动物的繁殖状态,这是评价野生动物生态学健康的指标之一[25]。
综上所述,林麝是新兴的圈养经济动物,林麝早期妊娠诊断是人工繁育的重要环节,目前虽然有研究报道,但技术不成熟,检测结果不稳定。孕酮是重要的妊娠检测候选因子,有待继续探索稳定高效孕酮检测方法,用于林麝等动物的非损伤性妊娠诊断。

