经皮穿刺法构建新西兰兔中心静脉置管模型及评价*
沈 娇 赵晓勇 王 晓 魏秀红 孙伟娟 常渝昕 李佳慧
(潍坊医学院护理学院, 潍坊 261053)
中心静脉置管(Central vein catheters,CVC)是指各种静脉导管插入后,尖端达到上、下腔静脉与右心房交汇处[1],为临床常用的静脉给药方式之一,对肿瘤患者化疗至关重要[2-3]。据报道,每年约1 500万患者选择中心静脉置管,15%以上的患者发生了并发症[4]。对此,Pittiruti[5]、李全磊等[6]进行了相关临床研究,但鉴于伦理学因素,尚不能在人体开展活体研究实验。Barraza等[7]认为实验动物中心静脉置管是一个新信息,且具有挑战性。因此,构建实验动物中心静脉置管模型成为解决该问题的桥梁。本研究采用体外经皮穿刺法,构建新西兰兔中心静脉置管模型,并做出相关评价,报告如下:
1 材料和方法
1.1 动物
普通新西兰兔,10只,雌雄不拘,体质量为2.0~2.5 kg,术前禁食8 h,禁饮4 h。所有实验动物均由潍坊医学院动物实验中心提供。许可证号:SCXK(鲁)20160002。
1.2 器材
PICC导管(美国BD公司,型号:4Fr),戊巴比妥钠(Sigma公司,生产批号:69020100),盐酸利多卡因(生产批号:1512J08),高敏C-反应蛋白检测试剂盒(潍坊市康华生物技术有限公司,生产批号:170201),离心机(Eppendorf,德国产),盐酸肝素钠,生理盐水,手术常规器械,20 mL空针等。
1.3 建模方法
1.3.1麻醉与固定:2%戊巴比妥钠按照40 mg/kg体质量,肌肉注射进行麻醉。待新西兰兔后肢疼痛反射、角膜刺激反射消失后,将其固定于动物台,保持呼吸道通畅,维持有效的呼吸功能。
1.3.2备皮和消毒:双侧下颌骨以下及颈前区域全部剃毛,充分暴露颈部皮肤,然后用酒精消毒皮肤,再碘伏消毒三遍,其范围大于备皮部位。无菌原则铺上洞巾。
1.3.3置管:助手按压颈总静脉近心端,使颈外静脉充分暴露在视野下,操作者左手绷紧穿刺点处皮肤,右手执穿刺针,顺着颈外静脉走向约30°角进针,针尖进入皮下后,进针角度调整约为15°继续穿刺颈外静脉,见穿刺针有回血时,再平行于颈部皮肤轻轻送入约1~2 cm,避免血管回缩致针尖脱出。穿刺成功后,左手固定针鞘,右手轻轻向外抽取针芯,针芯即将完全抽出时,左手食指迅速按住针鞘末端,以免血液溢出。右手持PICC导管缓慢送入7~8 cm[1],左手固定导管,右手拔出针鞘,然后抽出导丝。修剪导管外端留下约3~4 cm长度便于固定。连接导管延长器,连接导管延长管,20 mL空针抽回血,确保导管在血管中,并脉冲式推入5 mL生理盐水,再以10U/mL肝素钠溶液2 mL封管抗凝。
1.3.4固定:PICC导管围绕穿刺点环绕固定。2 mL空针抽取盐酸利多卡因进行局部麻醉,顺导管走向将导管缝于皮肤。无菌纱布覆盖穿刺点和导管,胶布缠绕固定。自制头套固定于脖颈处,以保护导管,避免拔出。
1.3.5模型保留:置管术后动物单笼饲养,室温25 ℃,湿度60%,环境清洁,室内通风,置管后4~6 h恢复饮食、饮水。每天生理盐水5 mL冲管一次,后以10U/mL肝素钠溶液2 mL封管,直至模型终止。
1.4 指标检测
分别于术前12 h,术后24 h,48 h,72 h采集右耳缘静脉血,橘黄色促凝管内放置3~4 h,待析出清亮血清后,移至离心机离心,3 000 r/mim,15 min。取上清液按高敏C-反应蛋白检测试剂盒步骤进行检测。
1.5 评价标准
确定建模成功的指标:①术后2~3 h恢复活动,72 h内生命迹象平稳;②穿刺点处皮肤无红肿、破溃、持续性出血等不良反应;③导管通畅无堵塞。
模型终止条件:①穿刺点处皮肤红肿、破溃、脓液流出等不良反应发生;②导管堵塞;③导管拔出;④动物死亡。
1.6 统计方法
2 结果
2.1 建模结果
本实验共构建10例新西兰兔中心静脉置管模型,术中麻醉耐受性良好,术后24 h模型存活率100%,建模成功率100%。
2.2 指标检测结果
较术前12 h比较,各时点耳缘静脉血中hs-CRP变化差异无统计学意义(P>0.05),且置管对模型产生的差异无统计学意义(P=0.11,α=0.05)。
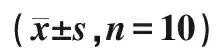
表1 置管前后各时点hs-CRP含量Table 1 before and after catheterization hs-CRP content
注:a表示与术前12 h相比,P>0.05
Note:asaid compared with 12 h before surgery,P>0.05
2.3 生命体征及体质量结果
术前、术后3 d新西兰兔呼吸、体温、体质量相对平稳,手术日体温稍升高,呼吸稍降低,体质量减轻。见图1,图2,图3。
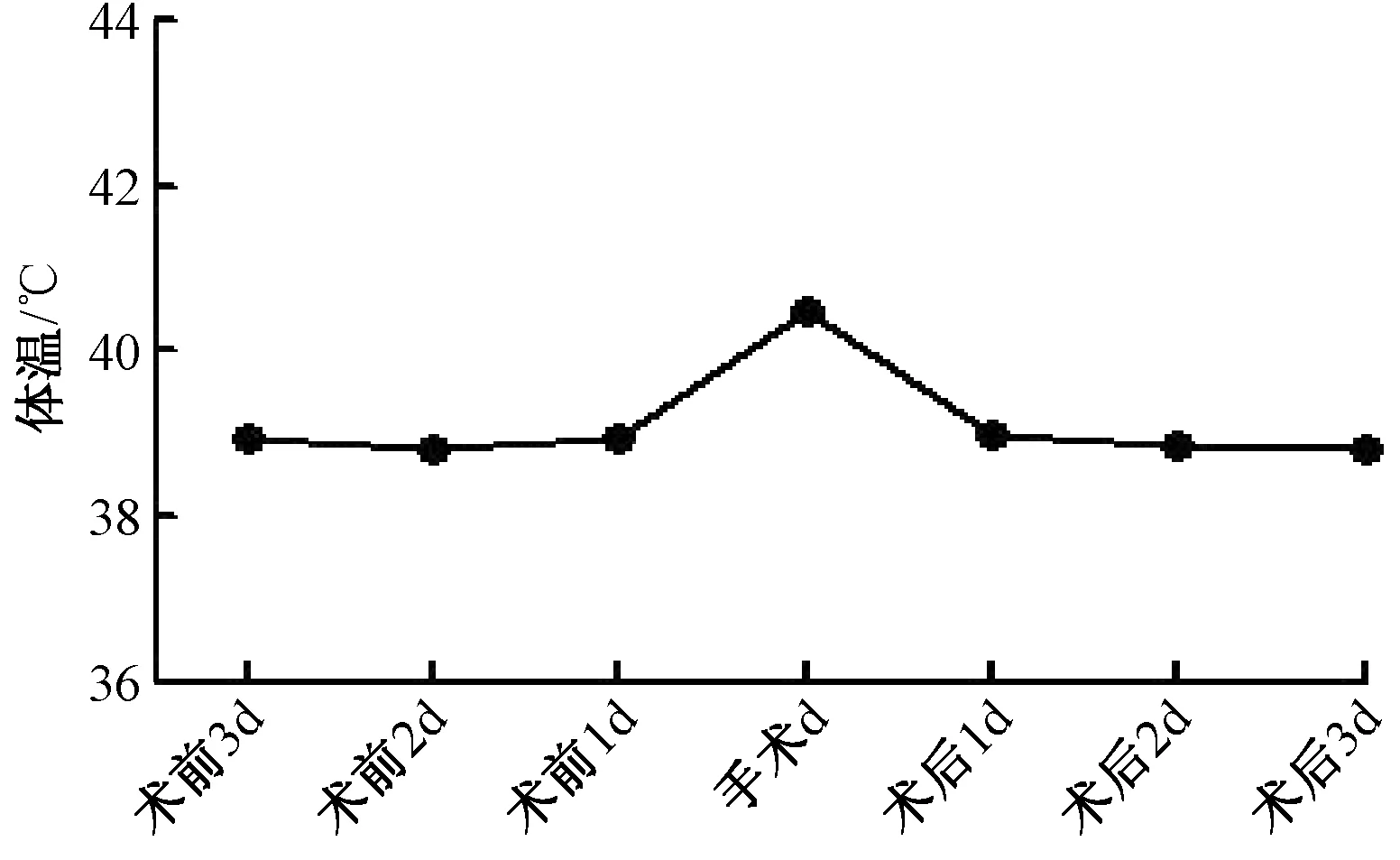
图1 体温在术前、术后3 d的均数分布情况Fig.1 The mean distribution of body temperature atpreoperative and postoperative 3 days

图2 呼吸在术前、术后3 d的均数分布情况Fig.2 The mean distribution of respiration atpreoperative and postoperative 3 days
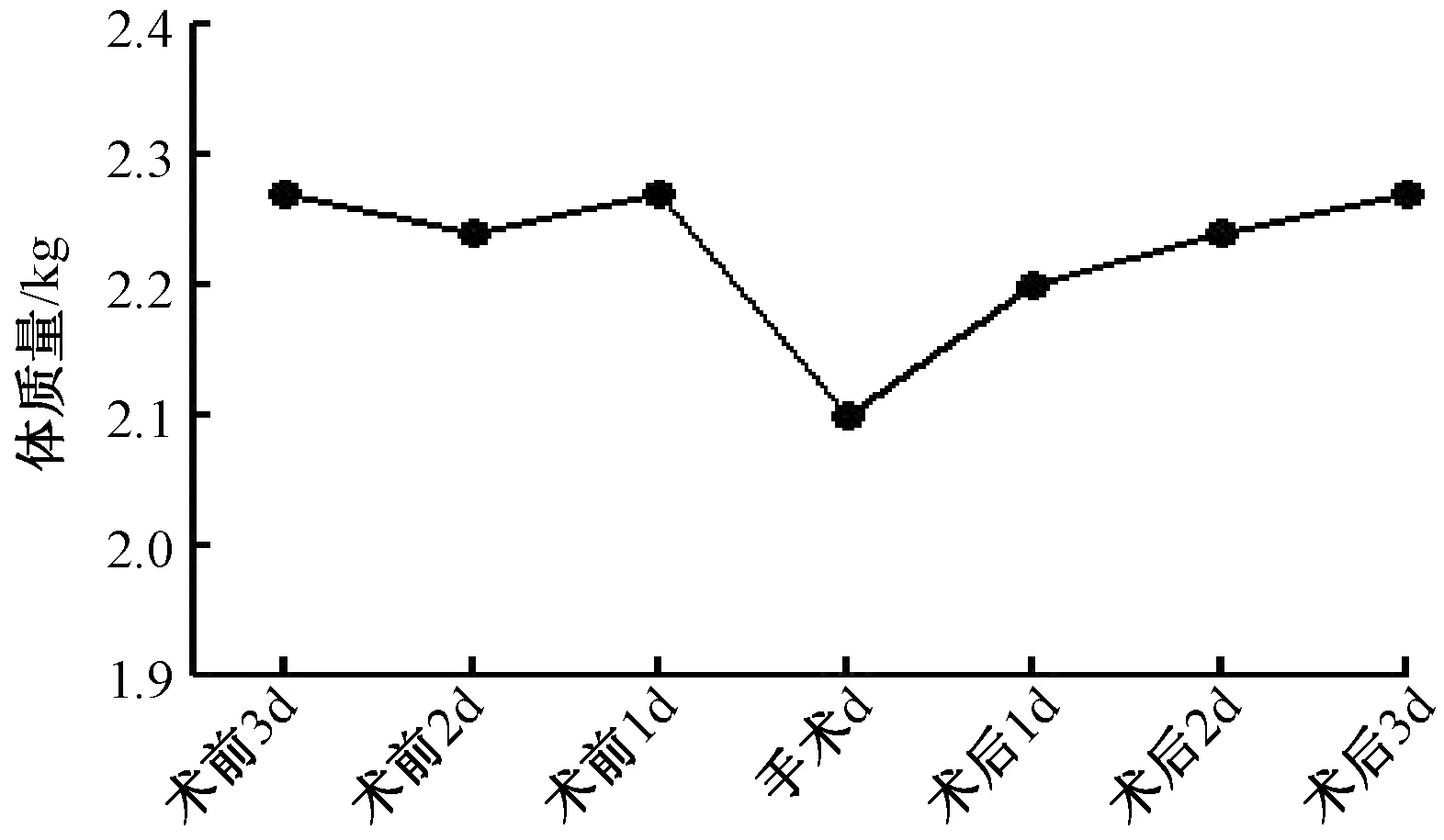
图3 体质量在术前、术后3 d的均数分布情况Fig.3 The mean distribution of body weight atpreoperativ and postoperatively 3 days
3 讨论
目前,中心静脉置管术在临床各科颇受重视[8],但导管为异物,易引起感染、导管堵塞等并发症[9-10],不仅加重患者经济负担,还阻碍治疗进程,带给患者痛苦,严重时将会危及生命[11-12]。因此,医护人员应当明确其并发症的发病机制及其表现,确保治疗顺利进行,提高患者生活质量[13]。目前,中心静脉置管术的基础研究已逐步在动物实验中开展。传统的新西兰兔颈外静脉置管办法[14-15]是通过手术来实现的,但由于损伤较大,期待新办法建模。本研究采用经皮穿刺新西兰兔颈外静脉构建CVC模型,并对所建模型作出相关评价,以探讨该建模办法的可行性及创新性。
3.1 穿刺损伤小,模型易保存
Chauhau等[16],Allan 等[17]建模时均需要剪破皮肤分离颈外静脉并结扎,此种办法建模可造成较大面积的创伤,因此,Larsson等[18]建议探索经皮穿刺法行中心静脉置管,精制模型,以减少建模所致的手术创伤和术后并发症。本实验在建模思路上摒弃了传统的手术思维,采用体外盲穿法穿刺颈外静脉,所建模型术后24 h存活率及成功率均为100%,建模结果较为理想。本实验所采用的建模技术向临床靠拢,减少了对实验动物的损伤及刺激,有利于动物机体恢复,大大降低因技术方法迥异而造成的实验误差,而且提高了动物的存活率和模型的保存率。PICC导管末端接有透明延长管,既便于固定,防止导管脱出,又能很好地观察导管内回血情况。模型建成之后,自制纸壳头套罩住动物头部,防止动物抓挠导管,有利于模型的长期保存。
3.2 可行性及实用性
Ye等[19]认为建立适当的动物模型是实验成功开展的关键。因此,合适的实验器材是实验成功的保障,本实验所选用的导管材质为美国BD 公司生产的硅胶单腔三向瓣膜导管,型号为4Fr,符合临床所用导管的要求,可避免因材质问题而影响实验结果。据实验结果显示,置管后3 d内,hs-CRP检测结果差异无显著统计学意义,表明该办法置管尚未引起炎症反应。据相关文献报道,中心静脉导管保留时间不宜超过4周[1],由此可见,该模型适用于中心静脉置管术的实验研究。结果显示,手术日实验兔体温、呼吸、体质量稍有波动,术后1 d即恢复正常水平,该种现象可能与麻醉药的呼吸抑制作用有关,且麻醉药代谢及侵入性操作均可引起体温波动,术前动物禁饮禁食,体质量可稍降低。但与位娟等[1]的实验中建立的模型相比,本实验建立的模型生命体征较为平稳,可行性高。
3.3 经济、方便
手术有风险,易造成动物浪费,而Larsson等[18],Pardo等[20]B超引导下建模办法,其成本较高。本模型仅需操作者经皮穿刺颈外静脉即可完成置管工作,且建模成功率100%,避免动物浪费,节省手术耗材;也不需要切皮、结扎静脉、游离颈静脉等具有难度又繁琐的工作,为操作者省力;同时简化了传统手术建模的冗长工作,节省建模时间。构建模型的经济效益是决定着实验能否顺利完成的重要保障。
综上所述,本实验采用经皮穿刺颈外静脉的办法构建新西兰兔中心静脉置管模型,具有可行性、实用性及创新性,且能很好地模拟临床,为临床中心静脉置管术开展实验性研究奠定基础。

