mTORC1信号通路在狼疮鼠体内的表达及意义
谢双德 魏姗姗 张华年 王桂松 彭学标 赵 珂 李俊灏 赖 宽
系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种多发于青年女性的可累及全身多脏器的自身免疫性疾病,其特点是血清中存在以抗核抗体、抗ds-DNA抗体为代表的多种自身抗体。发病机制主要为T、B淋巴细胞功能异常引起机体免疫功能紊乱,产生大量自身抗体。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路通过自噬调控、氧化应激、免疫调节参与SLE的发病过程。mTOR有mTORC1和mTORC2两种不同的复合物,mTORC1激活后通过磷酸化下游靶点(p70S6激酶)参与调控mRNA翻译[1]。激活的mTOR通路是SLE患者出现T、B淋巴细胞异常活化的关键因素[2]。Th17淋巴细胞亚群在SLE疾病的发生发展中起着重要作用,活动期 SLE 患者外周血中 Th17 淋巴细胞比例升高,产生 IL-17 能力增强[3]。有研究表明:在类风湿关节炎、系统性硬皮病、干燥综合征和SLE等自身免疫性疾病中,mTOR通路与Th17淋巴细胞亚群关系密切。为了探讨mTORC1信号通路及Th17淋巴细胞亚群在狼疮鼠发病中的作用及相关性,我们对狼疮鼠体内mTORC1信号通路及Th17淋巴细胞亚群进行了检测。
1 材料与方法
1.1 实验对象 实验组选用6只B6.MRL/lpr狼疮小鼠,20周龄,质量25~30 g,购于南京大学模式动物研究所。对照组选用6只正常C57小鼠,20周龄,质量25~30 g,购于南方医科大学动物中心。
1.2 主要试剂 小鼠IL-17 ELISA试剂盒(武汉六合生物技术有限公司)、RT-PCR引物(上海捷瑞生物工程有限公司)兔抗鼠mTOR单克隆抗体、兔抗鼠p-mTOR(2448)单克隆抗体、兔抗鼠p70S6K单克隆抗体、兔抗鼠p-p70S6K单克隆抗体(均是美国CST公司)、羊抗鼠IL-17抗体(美国Santa Cruz Biotechnology公司)、鼠抗鼠AKT单克隆抗体(Proteintech公司)、Western制胶试剂盒(上海碧云天生物技术有限公司)。
1.3 实验方法
1.3.1 标本制备 将两组小鼠麻醉取血处死后,腹部正中线切开,切取脾脏冰上放置,用于制备淋巴细胞单细胞悬液;切取小鼠的肾脏用于mRNA和蛋白水平测定。
1.3.2 流式细胞分析仪检测Th17(CD4+IL-17+T)细胞 无菌条件下制备小鼠脾脏淋巴细胞单细胞悬液[要求细胞浓度为(0.5~1)×107/mL];加入Cell Stimulation Cocktail(eBioscience, San Jose, USA),用Staining buffer(eBioscience)洗涤;加入CD4抗体,4℃避光孵育30 min,Staining buffer(eBioscience)洗涤;加入FIX工作液,涡旋混匀,4℃避光孵育30 min,Permeabilization Buffer (eBioscience)洗涤;加入IL-17A抗体,4℃避光孵育30 min,Permeabilization Buffer (eBioscience)洗涤;200 μL Staining buffer(eBioscience)重悬细胞,BDcalibur(eBioscience)流式细胞仪上机检测。
1.3.3 实时荧光定量PCR检测小鼠肾脏Akt、mTOR、p70S6K和IL-17的mRNA表达 用Trizol(Life Technologies)一步法提取50 mg小鼠肾脏的总mRNA,超微量分光光度计稀释RNA浓度并定量到1 μg/μL,反向转录成cDNA,以cDNA为模板,采用SYBR Green(Takara)进行实时荧光PCR反应;反应参数:95℃ 5 s,60℃ 30 s,40个循环。实验所用的引物如表1。

表1 RT-PCR引物序列
1.3.4 Western blotting检测小鼠肾脏Akt、p-Akt、mTOR、p-mTOR、p70S6K、p-p70S6K蛋白表达 称量小鼠肾脏50 mg,剪碎后加入500 μL冷Lysis Buffer(含磷酸酶抑制剂、蛋白酶抑制剂、PMSF,凯基生物有限公司),匀浆,离心后得蛋白提取物;采用BCA蛋白定量法测定蛋白浓度;6%~15% SDS聚丙烯酰胺凝胶进行蛋白电泳,蛋白分离后小分子200 mA、大分子350 mA转膜至PVDF膜上。室温下5%脱脂奶粉封闭膜2 h,用含5%BSA稀释的一抗4℃孵育膜过夜,洗涤后用含5% BSA稀释的HRP偶联的二抗(1∶1000)室温孵育2 h。洗涤后发光预览;调节曝光时间;调整图片并输出。
1.4 统计学方法 实验数据用均数±标准差表示,应用SPSS20.0软件处理,采用独立样本t检验,或者单因素方差分析。RT-PCR数据进行2-△△CT计算得到(△CT值=目标基因CT值-内参基因CT值;△△CT值=实验组△CT值-对照组△CT值)转换后数据分析,P<0.05为差异有统计学意义。
2 结果
2.1 流式细胞分析仪检测小鼠脾脏Th17淋巴细胞亚群 狼疮鼠组的Th17细胞占CD4+T细胞的比例[Th17/CD4+T,(10.89±1.69)%]显著高于正常对照组的(2.56±0.36)%,差异有统计学意义(P<0.05)。见图1。

图1 两组小鼠脾脏Th17淋巴细胞亚群的比例
2.2 RT-PCR检测肾脏组织Akt、mTOR、p70S6k、IL-17 mRNA表达 与对照组相比,狼疮鼠组Akt、mTOR、p70S6K、IL-17的mRNA表达水平[Akt:3.31±1.03%、mTOR:(3.59±0.46)%、p70S6K:(1.98±0.41)%、IL-17:(8.15±1.26)%]均显著升高,差异有统计学意义(P<0.05)。见图2。

图2 两组小鼠肾脏Akt、mTOR、p70S6K、IL-17mRNA的表达情况
2.3 Western blot检测肾脏组织Akt、p-Akt、mTOR、p-mTOR、p70S6K、p-p70S6K蛋白的表达 根据狼疮鼠肾脏提取的组织蛋白进行Western blot检测,检测到Akt、mTOR、p70S6K反应条带分别位于56、289、70 ku处,内参β-actin反应条带位于43 ku处,与预期结果相同。与对照组相比,狼疮鼠组的Akt、p-Akt、mTOR、p-mTOR、p70S6K、p-p70S6K蛋白条带着色较深。见图3。
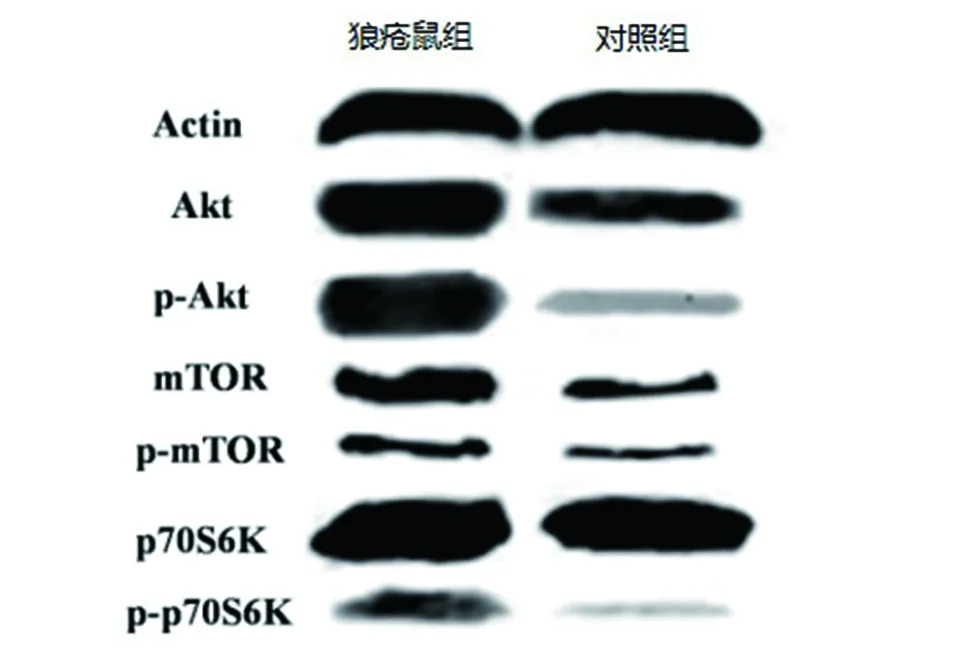
图3 两组小鼠Akt、p-Akt、mTOR、p-mTOR、p70S6K、p-p70S6K蛋白的表达
3 讨论
CD4+T细胞可被诱导分化为Th1、Th2、Th17、Treg细胞,Th17细胞是由Park等[4]发现的新的T细胞亚群,以选择性分泌IL-17为特征,在类风湿性关节炎、自身免疫性炎性肠病、系统性硬皮病及SLE等自身免疫病的发病中发挥着重要作用;Yang等[3]研究显示,活动期SLE患者外周血中Th17淋巴细胞比例升高,产生 IL-17 能力增强。本课题组前期实验发现:狼疮鼠动物模型肾脏组织RORγt、IL-17mRNA表达量较正常小鼠增多[5](RORγt是调控Th17细胞分化及IL-17分泌的关键性转录因子[6])。在本次实验中,狼疮鼠动物模型Th17细胞占CD4+T细胞的比例及肾脏组织中IL-17mRNA表达量均高于正常小鼠,与前期实验结果及相关人体实验的结果相一致,进一步证实Th17、IL-17在SLE发病中的致病作用。
mTOR是存在于真核细胞中的一类丝/苏氨酸(Ser/Thr)蛋白激酶,以两种不同形式的复合物存在:mTORC1和mTORC2。其中,mTORC1主要与细胞的营养、能量和细胞因子等信号相关,促进细胞增殖或自噬。mTORC1可被多种途径所激活,如营养物质[7](氨基酸、葡萄糖)、生长因子(胰岛素)、氧化还原作用等[8]。mTORC1被激活后可通过不同途径调控核糖体生成和mRNA转录,促进糖酵解、磷酸戊糖途径及脂类合成等相关基因的转录[9]。PI13K/Akt是mTORC1激活的重要途径,Akt及其在Thr308位点的磷酸化是PI13K/Akt通路的重要激活位点[10]。研究表明:mTORC1通过磷酸化核糖体S6激酶(S6K1,p70S6K),或真核起始因子4E结合蛋白1(4E-BP1)促进转录,调控蛋白质的合成[11]。
在CD4+T细胞中,mTORC1可以增加Th17淋巴细胞亚群分化,抑制mTORC1可以增加Treg细胞的分化[12],在Rheb或Raptor基因删除导致的mTORC1缺失中,Th17淋巴细胞亚群的分化也受到损害[13,14]。mTORC1主要通过以下几种方式调节Th17淋巴细胞亚群:1)mTORC1激活下游的HIF-1α,HIF-1α可以通过增加Rorc和Th17淋巴细胞亚群相关的基因表达,增加快速T细胞扩增所需要的糖酵解活性从而调节Th17淋巴细胞亚群的分化[15-17];2)mTOR通过磷酸化STAT从而调节Th17淋巴细胞亚群分化[14];3)mTORC1抑制剂通过减少RORγt的核易位和增加Gfi1表达来抑制Th17淋巴细胞亚群分化[18]。
本实验通过RT-PCR及Western blot 检测各组小鼠肾脏mTORC1信号通路相关基因和蛋白的表达,通过流式细胞技术检测小鼠脾脏Th17/CD4+T比例。与正常对照组相比,狼疮鼠组mTOR、p70S6K、Akt及其磷酸化水平显著升高,Th17/CD4+T比例升高,提示mTORC1信号通路在狼疮鼠体内被激活,进而促进Th17淋巴细胞亚群分化,在SLE的发病中起着重要作用。该结论可能为系统性红斑狼疮的治疗提供新的思路和靶点。

