维持性血液透析患者促红细胞生成素抵抗与炎症反应和氧化应激反应的关系
李佳,魏善斋,孙杰,许康春,张以来
(南京中医药大学沭阳附属医院,江苏沭阳223600)
维持性血液透析(MHD)是治疗终末期肾病的重要手段,但长期透析可导致肾性贫血等并发症[1,2]。促红细胞生成素(EPO)分泌量相对或绝对不足是诱发肾性贫血的重要原因[3,4]。重组人促红细胞生成素(rHuEPO)常用于治疗肾性贫血,通过加速红细胞成熟而改善贫血[5]。但部分MHD患者存在EPO抵抗,常规剂量rHuEPO不能纠正肾性贫血,其具体机制尚不明确[6]。研究发现,透析膜的生物相容性差及微生物污染透析液等可激活机体炎症反应和氧化应激反应[6,7],可能与EPO抵抗有关。本研究探讨MHD患者EPO抵抗的发生与炎症反应和氧化应激反应的关系。现分析结果并报告如下。
1 资料与方法
1.1 临床资料 选择2015年3月~2017年11月在我院行MHD的终末期肾病患者99例(观察组),男59例、女40例,年龄35~67(53.15±6.27)岁,透析时间6~10(8.15±1.09)个月,原发病为高血压肾病34例、慢性肾小球肾炎25例、多囊肾16例、糖尿病肾病24例。纳入标准:①符合《内科学》关于终末期肾病的诊断标准[8];②首次使用rHuEPO;③MHD超过3个月;④临床资料完整,依从性好;⑤患者及其家属对本研究知情同意。排除标准:①合并心、肝功能不全及消化道出血;②合并感染或恶性肿瘤;③近半年使用免疫抑制剂和(或)有输血史。另选同期在我院体检的健康者73例(对照组),男42例、女31例,年龄32~66(53.08±6.13)岁。两组性别、年龄具有可比性。详细记录观察组透析期间每个月rHuEPO的平均用量及血红蛋白水平,计算EPO抵抗指数(ERI)。ERI =rHuEPO用量(IU/月)/血红蛋白(g/L)。观察组ERI为283.52~786.31(534.19±108.34),以中位ERI为分界值,将患者分为高ERI 52例、低ERI 47例。本研究经南京中医药大学沭阳附属医院医学伦理委员会批准。
1.2 血清炎症因子及氧化应激产物检测 两组均于清晨抽取空腹肘静脉血5 mL,置于未涂有肝素钠的采血管中,室温下静置20 min,3 500 r/min离心10 min,离心半径为3 cm,分离血清,-20 ℃保存。采用ELISA法检测血清IFN-γ、高迁移率族蛋白1(HMGB-1)、高敏C反应蛋白(hs-CRP)、IL-6、IL-4和IL-10,采用放射免疫法检测氧化应激产物丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽(GSH)和晚期氧化蛋白产物(AOPP)。试剂盒均由武汉博士德生物工程有限公司提供,并严格按照试剂盒说明书进行操作。
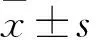
2 结果
2.1 两组血清炎症因子和氧化应激产物水平比较 与对照组比较,观察组血清IFN-γ、HMGB-1、hs-CRP、IL-6、IL-4、IL-10、MDA及AOPP水平均明显升高,血清SOD、CAT及GSH水平均明显降低,组间比较P均<0.05。观察组高ERI者血清IFN-γ、HMGB-1、hs-CRP、IL-6、IL-4、IL-10、MDA、AOPP水平均明显高于低ERI者,血清SOD、CAT及GSH水平均明显低于低ERI者,二者比较P均<0.05。见表1、2。
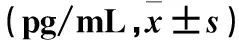
表1 两组血清炎症因子水平比较
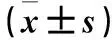
表2 两组血清氧化应激产物水平比较
2.2 ERI与血清炎症因子和氧化应激产物的关系 MHD患者ERI与血清IFN-γ、hs-CRP、IL-6、IL-4、IL-10、MDA及AOPP水平均呈正相关关系(r分别为0.721、0.778、0.765、0.724、0.738、0.716、0.698,P均<0.05),与血清SOD及GSH水平均呈负相关关系(r分别为-0.802、-0.734,P均<0.05),与血清HMGB-1、CAT水平无明显相关性(P均>0.05)。
3 讨论
MHD能够有效清除终末期肾病患者体内的毒性代谢产物,继而保证酸碱平衡,延长患者生存时间[10,11]。但血液透析可导致机体总铁储备量下降、产生EPO抗体,诱发EPO抵抗[6,12]。终末期肾病患者体内活性氧簇水平增加,诱导生成大量的同型半胱氨酸等毒性代谢产物在体内潴留,同时机体抗氧化能力下降,氧自由基增加,导致机体氧化应激水平升高,引起炎症反应,而炎症反应又反过来加重氧化应激反应,形成恶性循环,使疾病进一步发展[9]。研究发现,MHD也可诱发炎症反应和氧化应激反应。MHD过程中的氧化应激反应不仅通过氧化反应损伤相关组织,而且可激活炎症反应损伤组织。此外,透析膜的生物不相容性也可激活炎症反应[9,13]。
IFN-γ是单核细胞和巨噬细胞分泌的促炎因子,介导炎症反应的级联反应[14];HMGB-1是可以激活单核巨噬细胞的晚期促炎因子,可促进多种炎症介质的瀑布式分泌[15];hs-CRP为炎症反应的急性时相反应蛋白,其水平变化可以反映炎症反应程度[16];IL-6作为炎症反应的中枢性调节因子,与hs-CRP关系密切,炎症发生后,可促进hs-CRP合成增多,增加血管内皮活性氧簇的生成量,加重炎症反应[17]。激活炎症反应亦可导致抗炎因子的代偿性分泌,并增强代偿性抗炎反应,如IL-4和IL-10分泌量增加在一定程度上抑制过度的炎症反应[6]。本研究结果显示,观察组血清IFN-γ、HMGB-1、hs-CRP、IL-6、IL-4及IL-10水平均高于对照组,提示终末期肾病患者MHD过程中炎症反应被激活,导致促炎因子和抗炎因子水平明显升高。进一步对比不同ERI者血清炎症因子水平,结果显示,高ERI者血清IFN-γ、HMGB-1、hs-CRP、IL-6、IL-4及IL-10水平均显著高于低ERI者,且MHD患者ERI与血清IFN-γ、hs-CRP、IL-6、IL-4及IL-10水平均呈正相关关系,进一步证实MHD激活的炎症反应可降低患者对EPO的敏感性。
在正常状态下机体内氧化和抗氧化能力保持平衡,可避免组织细胞损伤。氧化应激是指机体受到外界有害刺激后,生成大量的活性氧自由基,致使氧化程度超过抗氧化能力,使组织细胞受损[9]。氧化应激反应是MHD过程中重要的病理变化,透析膜的生物不相容性、透析液中微生物污染等可诱发生成大量的氧自由基,是导致氧化应激反应的重要原因[6]。氧自由基攻击机体生物膜结构上的脂质和蛋白质,二者发生氧化反应后分别生成MDA和AOPP,加速生物膜的结构和功能破坏。MDA水平可反映机体的氧化应激状态,AOPP不仅是氧化应激产物,其自身还可以产生大量的氧化自由基[9,18]。SOD和CAT等抗氧化物酶催化的还原反应可清除氧自由基,从而避免机体过度的氧化损伤[6]。GSH是合成的抗氧化剂,多存在于细胞内,可保证细胞的完整性,其水平变化可影响机体细胞的氧化平衡状态,同时还可反映细胞抗损伤能力和受损程度[19]。本研究结果显示,与对照组比较,观察组血清MDA、AOPP水平均升高,血清SOD、CAT、GSH水平均降低。提示终末期肾病患者在MHD过程中氧化应激反应被激活,氧化应激反应产物生成量增加,并消耗大量的抗氧化酶。进一步分析不同ERI者氧化应激反应产物水平变化发现,高ERI者血清MDA、AOPP水平均高于低ERI者,血清SOD、CAT、GSH水平均低于低ERI者;ERI与血清MDA、AOPP呈正相关关系,而与血清SOD、GSH水平呈负相关关系;进一步证实MHD患者的抗氧化能力下降,氧化应激产物增加,进而降低EPO的敏感性,诱发EPO抵抗。
综上所述,MHD患者EPO抵抗的发生与炎症反应和氧化应激反应密切相关;炎症反应和氧化应激反应可降低机体对EPO的敏感性,诱发EPO抵抗。

