hK14、COX-2蛋白表达水平变化与上皮性卵巢癌发病相关性分析及作用机制分析
史红利
(嵩县人民医院肿瘤科,河南 嵩县 471400)
卵巢上皮性肿瘤的发生早期缺乏可靠的筛查指标,其早期诊断水平较低。流行病学研究显示,卵巢癌的发病率可达233~566/10万人左右[1]。临床上卵巢癌的病情进展,能够导致患者盆腔内器官转移、远期淋巴结转移等的发生,病死率较高[2]。
在探讨卵巢癌的发病病因的过程中发现,基因或者基因相关转录反应蛋白的分子表达水平的改变,能够通过影响到癌细胞的生物学特征,进而在促进肿瘤细胞增殖、抑制癌细胞的凋亡等方面发挥作用。环氧合酶-2蛋白1(COX-2)能够通过诱导局部肿瘤微环境中的氧化应激损伤,促进癌细胞的DNA扩增风险,并能够诱导血管内皮生长因子的激活,促进新生血管的形成,并增加肿瘤病灶组织的血流灌注[3];人激肽释放酶-14(human kallikrein-14,hk14)能够通过其结构上的丝氨酸结构,促进肿瘤细胞膜表面糖蛋白受体的激活,促进细胞内信号通路的激活,增加癌细胞的侵袭或者转移的风险[4,5]。 为了进一步揭示 hK14、COX-2 蛋白表达与卵巢癌发生发展的关系,从而为临床上卵巢癌的早期筛查提供可靠的实验室参考指标,本次研究选取我院确诊的上皮性卵巢癌患者组织标本100例,探讨了相关指标的异常表达变化,并揭示了其与卵巢癌临床分期、细胞分化或者腹水等的关系。
1 资料与方法
1.1 一般资料 选取我院手术后卵巢癌组织标本100例(病灶组)、正常卵巢组织50例(对照组),收集时间2015年5月-2017年5月。病灶组,年龄29~65 岁,平均年龄 38.52±11.33 岁,良性卵巢浆液性肿瘤15例,交界性卵巢浆液性肿瘤20例,卵巢浆液性肿瘤65例。卵巢浆液性肿瘤65例中,病理分级G1级19例,G2级23例,G3级18例。临床分期,I期18例,Ⅱ期14例,Ⅲ期15例,Ⅳ期18例。有淋巴结转移38例,无转移27例。有腹水40例,无腹水25例。对照组,年龄30~66岁,平均年龄 38.19±12.15 岁,两组年龄没有明显差异 (P>0.05)。
1.2 纳入排除标准
1.2.1 纳入标准 ⑴术前未合并其他部位恶性肿瘤;⑵术后病理证实为上皮性卵巢癌;⑶手术根治性切除肿瘤,术后生存期大于1个月,未发生围术期并发症;⑷有完整规范的术后病理报告及随访资料;⑸术前未接受放化疗;⑹无高血压、糖尿病、肾炎、急慢性盆腔炎及子宫内膜异位症等疾病,近期均未服影响前列腺素和血栓素代谢的药物。
1.2.2 排除标准 ⑴合并其他系统严重疾病者;⑵未能完成随访者;⑶贫血及凝血功能障碍;⑷风湿及免疫系统疾病;⑸严重的肝肾功能疾病;⑹甲状腺功能障碍;⑺因其他部位肿瘤进行过放化疗治疗者。
1.3 免疫组化染色及蛋白质免疫印迹方法 蛋白印记法检测相关指标的表达:冰上分离出血肿周边脑组织(假手术组为左侧尾状核),置于预冷的研钵中液氮研磨至粉末状。按总蛋白80g计算上样体积,4:l的比例加上样缓冲液,每条泳道加20ul样品缓冲液,于60V电压下跑胶,脱脂蛋白封闭2h,羊抗 hK14、COX-2 蛋白抗体(1:200),2h 后加入二抗。Image proplus 4.01版本的专业图像分析软件进行图像分析。
免疫组化检测相关指标的表达:所有组织标本经石蜡包埋后作连续切片,厚度约为4mm,采用免疫组化链霉卵白素一生物素复合体法 (strep avidin-biotin complex,SABC 法)染色,二氨基联苯胺(diamionben zidene,DAB)显色。hK14、COX-2 抗体、PV6000通用型二抗以及SP试剂盒和DAB显色盒均购自北京中杉金桥生物技术开发公司。以阳性片及PBS代替一抗分别作为阳性及阴性对照,高倍显微镜下观察hK14、COX-2的表达情况,具体染色步骤严格按照SP试剂盒说明书进行操作。
1.4 免疫组化判定标准 免疫组化结果判定:以呈现清晰的棕黄色颗粒为阳性,按阳性细胞所占比例数分为: 染色强度分为-(阴性)、+(弱)、++(中度)、+++(强); 染色范围为-(0%~5%)、+(6%~25%),++(26%~50%)、+++(﹥50%)。 两种蛋白阳性表达结果中,(一)归为阴性表达组,(+)、(++)、(+++)归为阳性表达组。采用免疫印迹(Western blot)法测定各组织中 hK14、COX-2 蛋白表达水平(灰度值>15.0 为阳性)。
1.5 统计学方法 统计软件采用SPSS 17.0,采用均数±标准差(±s)进行统计描述,两组间比较采用t检验;计数资料组间比较采用 χ2检验;P<0.05表示差异具有统计学意义。
2 结果
2.1 两组组织标本中hK14、COX-2蛋白的表达情况比较 病灶组、对照组的hK14蛋白表达阳性率分别为 83.00%、8%(P<0.001),表 1。病灶组、对照组的 COX-2蛋白表达阳性率分别为 78.00%、4.00%(P<0.001),表 2。
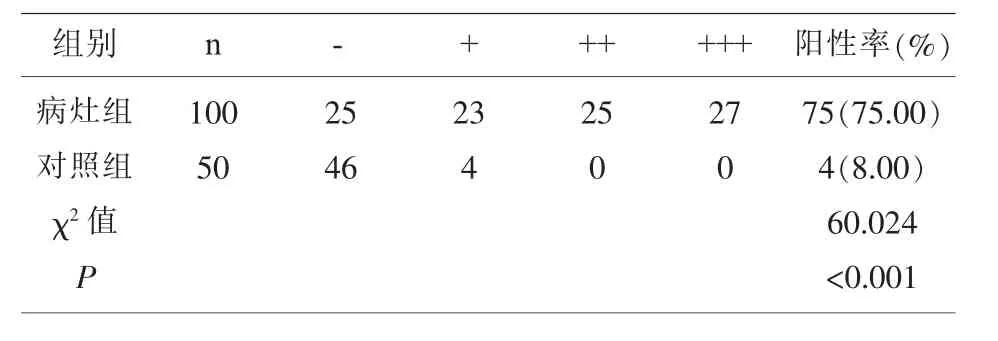
表1 组织标本中hK14蛋白表达情况比较

表2 组织标本中COX-2蛋白表达情况比较
2.2 hK14、COX-2蛋白印迹检测结果 交界性卵巢浆液性肿瘤、卵巢浆液性肿瘤、良性卵巢浆液性肿瘤 hK14 蛋白表达率分别为 65.00%、87.69%、33.33%,与对照组相比具有显著性差异(P<0.05);交界性卵巢浆液性肿瘤、卵巢浆液性肿瘤COX-2蛋白表达率分别为 80.00%、93.85%,与对照组相比具有显著性差异(P<0.05);表 3。
2.3 卵巢癌组织标本中的hK14、COX-2蛋白表达与患者临床病理学特征的关系 COX-2蛋白表达率和相对含量在不同的年龄、临床分期、病理分级、有无腹水及有无淋巴结转移间比较,均无显著性差异 (P>0.05),hK14 蛋白表达率和相对含量在临床分期、病理分级、有无腹水及有无淋巴结转移间比较,均有显著性差异(P<0.05)。 表 4。
3 讨论
卵巢癌的早期筛查主要通过血清学指标进行,虽然超声或者CT等辅助检查能够在疾病的高危筛查、诊断及临床预后过程中发挥重要的作用,但对于部分病变不典型、病灶范围较小的卵巢肿瘤人群中,影像学检查的局限性较为明显。同时在卵巢恶性病变的早期,影像学检查的灵敏度较低,其预测卵巢恶性肿瘤的总体风险不足25%[6]。血清学指标的筛查具有微创、可反复测量,能够在广大基层医疗机构及无相关高危因素的基础人群中广泛开展。但一项包含了345例样本量的卵巢血清学指标可见,现阶段临床上对于部分肿瘤如卵巢粘液性肿瘤或者印戒细胞癌等的评估价值较低[7]。本次研究通过对于新型相关肿瘤分子的分析研究,能够为后续临床上肿瘤的血清学筛查提供新的选择。
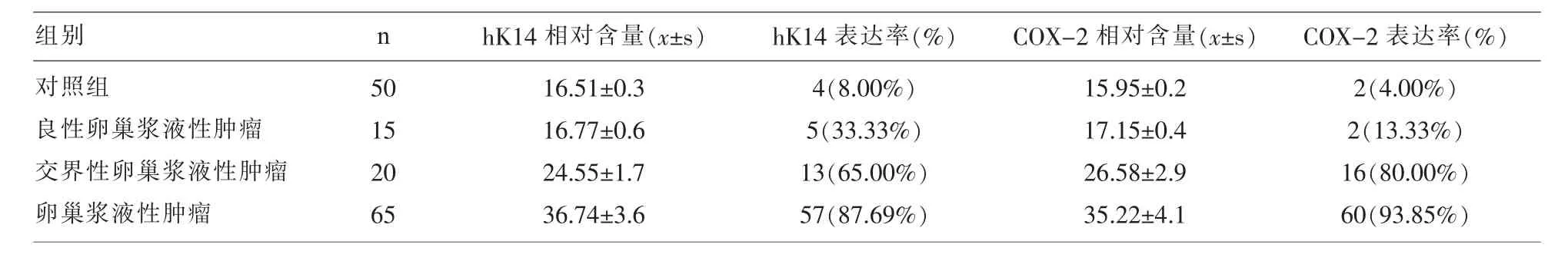
表3 hK14、COX-2蛋白表达水平比较
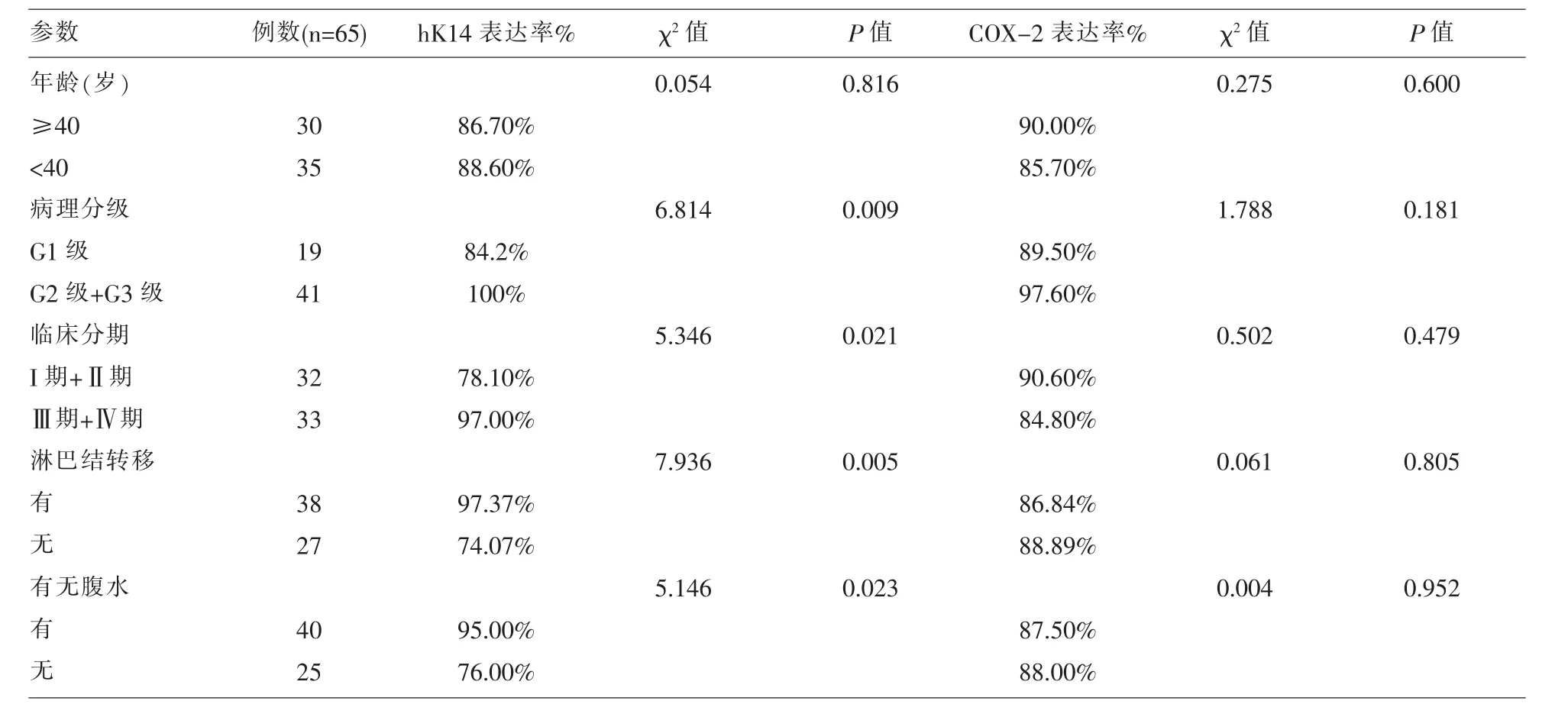
表4 上皮性卵巢癌hK14、COX-2蛋白表达与临床病理因素的关系
COX-2作为氧化应激性指标,其能够在诱导下游IL-6或者IL-10等方面发挥作用,促进卵巢上皮细胞的线粒体损伤,促进癌细胞DNA增殖过程中调控障碍。COX-2对于癌细胞粘附能力的改变,能够诱导癌细胞粘附淋巴结内皮细胞,促进癌细胞通过局部组织液及淋巴液进行扩散的风险[8,9]。 已经证实的是,COX-2 能够促进甲状腺癌、乳腺癌等恶性肿瘤的临床分期的进展,高表达的COX-2能够加剧癌细胞的异型性,促进组织学分级的恶化;hK14结构上包含的丝氨酸结构,能够通过诱导下游脯氨酸酶的上调,促进细胞内NTOCH或者MAPK信号通路的激活,诱导癌细胞内的肿瘤相关基因cyc-m的上调,促进癌细胞的生物学特征的改变[10,11]。部分研究揭示了hK14在影响到消化道肿瘤、呼吸系统肿瘤中的作用,但在卵巢上皮性肿瘤中的研究较少。
本次研究通过免疫组化及蛋白印记检测分析发现,在卵巢癌病灶组织中,可以发现显著的hK14、COX-2蛋白的表达阳性率或者表达水平的上升,其表达水平明显高于正常卵巢上皮组织,这提示hK14、COX-2二者均可能参与到了卵巢肿瘤的发生发展过程中,从机制上分析hK14、COX-2蛋白的表达对于卵巢恶性肿瘤的病情影响主要与下列机制有关[12,13]:⑴hK14蛋白对于癌细胞内的AKT或者MAPK等通路的激活作用,促进了癌细胞分化诱导因子a的异常转录,影响到了癌细胞的细胞异型性、分化成熟障碍等生物学特征;⑵COX-2蛋白在影响到肿瘤氧化应激反应的同时,能够促进CD4+T淋巴细胞或者树突状细胞的免疫抑制,导致肿瘤细胞免疫逃逸的发生。孙丽丽等[14]研究者在探讨了83例样本量的卵巢肿瘤的分子谱表达后发现,COX-2蛋白的表达阳性率可平均上升25%以上,在综合性治疗敏感性较低、治疗后复发率较高或者生存预后较差的卵巢肿瘤患者中,COX-2蛋白表达阳性率可进一步上升。交界性卵巢浆液性肿瘤、卵巢浆液性肿瘤等病灶组织中,均可以发现hK14、COX-2蛋白的高表达趋势,同时在卵巢良性浆液性肿瘤中,同样可以发现hK14的高表达趋势,提示hK14不仅对于恶性肿瘤或者交界性肿瘤的发生具有一定的标志作用,同时对于卵巢良性病变同样具有一定潜在筛查价值。在探讨相关因子表达与卵巢癌患者临床病理特征关系过程中可以发现,hK14蛋白的表达能够导致卵巢癌患者淋巴结转移的发生,促进临床分期的进展,同时对于卵巢肿瘤病灶的组织学分级等同样具有一定的影响,这主要考虑与hK14蛋白对于淋巴结内皮细胞粘附分子adherin 1的上调作用,或者与其对于癌细胞浸润能力的增加,从而促进临床分期进展有关。但本次研究并未发现COX-2蛋白的表达与卵巢肿瘤的临床病理特征的关系,考虑COX-2蛋白可能主要参与到了卵巢肿瘤的早期发生过程,而对于病情进展无特异性的促进作用[15]。
综上所述,hK14、COX-2蛋白在上皮性卵巢癌组织中高表达,并且与肿瘤的发生发展关系密切,有望成为治疗卵巢癌的靶点。

