HP感染与消化性溃疡患者细胞因子、α-防御素水平变化的关系
丁德敏
(周口市鹿邑县人民医院消化科,河南 周口市 477200)
消化性溃疡以十二指肠溃疡、胃溃疡最为常见,是指胃肠道黏膜被自身消化形成的溃疡,其多发于胃空肠、食管吻合口附近和胃黏膜Meckel憩室[1]。 幽门螺杆菌(Helicobacter pylori,HP)感染,糖皮质激素、NSAIDs等药物的长期服用及遗传等因素均与消化性溃疡的发病有关。
HP是一种定居于胃黏膜上皮细胞表面或胃化生的十二指肠黏膜中的微需氧菌。人体出现HP感染后可介导免疫反应的产生,促进细胞因子释放并造成胃黏膜损害,而进一步形成溃疡,亦可引起全身性的免疫反应及慢性的炎性反应,诱导大量细胞因子以及炎性介质的生成,其中IL-6、IL-8、IL-2、IL-17、TGF-β1 及 α 防御素均参与细胞的免疫调节过程,但其机制还需要进一步研究[2,3]。本研究深入探讨了HP感染与消化性溃疡患者血清炎症细胞因子、α-防御素水平变化的关系,现报告如下。
1 资料与方法
1.1 一般资料 选取在河南省周口市鹿邑县人民医院确诊的160例消化性溃疡患者 (病例组)、健康研究对象80例(对照组),收集时间为2016年1月至2017年5月。病例组,男92例、女68例,年龄 27~75 岁, 平均 48.4±12.2 岁, 身体质量指数(BMI)23.7±2.0kg/m2, 其中十二指肠球部溃疡 93例、胃溃疡67例,HP感染阳性110例;收缩压/舒张压 127.2±10.5/77.0±10.4mmHg。 对照组, 男 44例、女 36 例,年龄 32~77 岁,平均 49.0±13.7 岁,BMI 23.5±2.1kg/m2,收缩压/舒张压 126.4±9.8/76.8±9.1mmHg。 两组研究患者的年龄、性别、BMI、血压比较,差异均无统计学意义(P>0.05)。
1.2 纳入排除标准
1.2.1 纳入标准[4]⑴消化性溃疡的诊断标准参考《内科学》人民卫生出版社第八版中的标准,HP感染的诊断标准参考 《第四次全国幽门螺杆菌感染处理共识报告》中的标准;⑵患者年龄≤79岁;⑶患者具有典型的消化性溃疡临床症状(黑便、食欲不振、腹胀腹痛、反酸嗳气等),经内镜取活组织检查确诊;13C尿素呼气实验(UBT)结果阳性;⑷对照组来源于本院经内镜检查未发现消化性溃疡的患者。
1.2.2 排除标准 ⑴合并全身感染性疾病的患者;⑵伴有恶性肿瘤;⑶消化道手术史;⑷急性心肌梗死、脑血管病史;⑸近2个月使用抗菌药物、糖皮质激素、免疫抑制剂的患者;⑹精神或认知功能障碍。
1.3 观察指标及检查方法 所有待检者入院第2d取清晨静脉血,3000r/min离心(10min)后取血清。酶联免疫法(ELISA)法在酶标仪(美国BD公司生产)检测并对比两组研究对象血清白细胞介素-6(IL-6)、IL-8、IL-2、IL-17、转化生长因子 β1(TGF-β1)、α-防御素,相关试剂盒均购置于南京建成生物研究所。
1.4 统计学方法 统计软件采用SPSS 16.0,计量资料采用均数±标准差(±s)进行统计描述,两组间比较采用t检验;P值<0.05表示差异具有统计学意义。
2 结果
2.1 两组研究对象的各项血清指标比较 病例组的血清 IL-6、IL-8、IL-2、IL-17、TGF-β1 显著的高于对照组(P<0.05),而 α-防御素水平显著低于对照组(P<0.05)(表 1)。
2.2 不同溃疡部位患者的各项血清指标比较 十二指肠球部溃疡患者的血清 IL-8、IL-2、IL-17、TGF-β1 显著的高于胃溃疡患者(P<0.05),但二者的 IL-6、α-防御素水平差异无统计学意义 (P>0.05)(表 2)。
2.3 HP感染阳性和阴性患者的各项血清指标比较HP感染阳性的消化道溃疡患者的血清IL-6、IL-8、IL-2、IL-17、TGF-β1 显著的高于 HP 感染阴性的消化道溃疡患者(P<0.05),而前者的 α-防御素水平显著低于后者(P<0.05)(表 3)。
表1 两组研究对象的各项血清指标比较(±s)
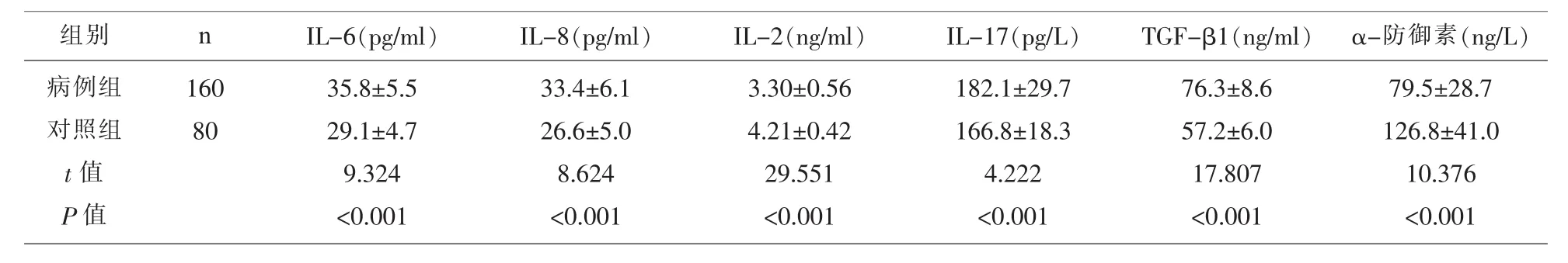
表1 两组研究对象的各项血清指标比较(±s)
组别 n病例组对照组t值P值160 80 IL-6(pg/ml) IL-8(pg/ml) IL-2(ng/ml) IL-17(pg/L) TGF-β1(ng/ml) α-防御素(ng/L)35.8±5.5 29.1±4.7 9.324<0.001 33.4±6.1 26.6±5.0 8.624<0.001 3.30±0.56 4.21±0.42 29.551<0.001 182.1±29.7 166.8±18.3 4.222<0.001 76.3±8.6 57.2±6.0 17.807<0.001 79.5±28.7 126.8±41.0 10.376<0.001
表2 不同溃疡部位患者的各项血清指标比较(±s)

表2 不同溃疡部位患者的各项血清指标比较(±s)
溃疡部位 n十二指肠球部溃疡胃溃疡93 67 t值 P值IL-6(pg/ml) IL-8(pg/ml) IL-2(ng/ml) IL-17(pg/L) TGF-β1(ng/ml) α-防御素(ng/L)36.0±5.1 35.2±4.9 1.16 0.247 35.1±5.9 32.7±5.6 3.201 0.003 3.14±0.50 3.43±0.52 4.180<0.001 189.5±23.0 172.0±26.5 5.277<0.001 77.3±7.5 74.6±7.2 2.664 0.018 77.2±21.8 83.0±24.2 1.872 0.062
表3 Hp感染阳性和阴性患者的各项血清指标比较(±s)

表3 Hp感染阳性和阴性患者的各项血清指标比较(±s)
溃疡部位 n Hp阳性Hp阴性t值P值110 50 IL-6(pg/ml) IL-8(pg/ml) IL-2(ng/ml) IL-17(pg/L) TGF-β1(ng/ml) α-防御素(ng/L)37.1±5.2 33.0±4.3 6.086<0.001 35.0±5.9 30.2±5.4 6.108<0.001 2.98±0.51 3.82±0.49 12.185<0.001 190.1±27.6 170.4±23.8 5.45<0.001 80.5±7.4 67.3±8.0 12.677<0.001 71.0±27.1 92.8±22.5 6.203<0.001
3 讨论
消化性溃疡多由化学或物理因素破坏胃黏膜屏障、胃肠道黏膜修复机制所致[5]。胃酸过多、HP感染、胆盐及药物因素等均是消化性溃疡的损害因素,其中HP感染是造成消化性溃疡的重要因素。近年来的临床研究[6]发现胃酸分泌过多、幽门螺杆菌感染和胃黏膜保护作用减弱等因素可引起胃黏膜的侵袭因素和防御因素失衡,进而导致胃黏膜损伤,严重者甚至可能导致胃癌的发生。
武胜[7]的研究发现HP作为一类革兰阴性微量需氧菌,其分泌的毒素可引发宿主免疫应答介导的胃黏膜损伤及胃酸的调节异常。除幽门外,HP还可存在于十二指肠和胃的其他部位,这些部位的溃疡都已被证实与HP诱发的黏膜损伤有关[8]。
李桂玲[9]的研究提示消化性溃疡患者体内有多种细胞因子的释放,多存在免疫调节紊乱。TGF-β1归属于TGF-β超家族,分子量为25kD,由两个结构相近或相同的亚单位同孤傲二硫键链接构成,TGF-β1可调节细胞分化和生长,还可抑制细胞因子产生、免疫活性细胞增殖、炎症反应和免疫应答[10]。α-防御素属于小分子抗菌肽,可通过诱导细胞因子的释放以调节细胞间信号传导及介导其他分子协同反应来活化T细胞,从而发挥免疫调节的作用[11,12]。IL-17属于T细胞来源的致炎因子,亦是Thl7细胞的主要效应因子,其可与IL-6、IL-8等细胞因子共同作用激活补体系统产生反应蛋白而诱导炎症的发生[13]。
本研究发现病例组的血清 IL-6、IL-8、IL-2、IL-17、TGF-β1 显著的高于对照组(P<0.05),α-防御素水平显著低于对照组。血清α-防御素表达水平降低可能和受到体内基因蛋白水平的调控所致有关;血清TGF-t3l水平升高可能是由于患者免疫功能降低,免疫细胞被抑制所导致[14];IL-6、IL-8、IL-2、IL-17水平的升高证实HP感染的消化道溃疡患者存在较严重免疫反应,这也与先前的研究[15]一致。
本研究中不同溃疡部位患者的各项血清指标比较发现十二指肠球部溃疡患者的血清IL-8、IL-2、IL-17、TGF-β1 显著的高于胃溃疡患者 (P<0.05), 但 IL-6、α-防御素水平在不同溃疡部位的差异无统计学意义。上述结果说明HP感染、十二指肠球部溃疡会进一步提高患者血清炎症因子及降低α-防御素水平。经分析认为幽门螺杆菌感染后,往往都伴随局部细胞的免疫反应,导致局部炎症细胞产生的细胞因子增多,进而参与了消化性溃疡的病理过程,该结果提示不同部位的消化道溃疡患者炎症因子的存在差异,这也为临床不同部位消化道溃疡的诊断提供了新的思路。
HP感染阳性或阴性患者的各项血清指标比较结果显示HP感染阳性的消化道溃疡患者的血清 IL-6、IL-8、IL-2、IL-17、TGF-β1 显著的高于HP 感染阴性的消化道溃疡患者(P<0.05),而前者α-防御素水平显著低于后者。上述结果说明HP被根治后患者的局部炎症得到控制,体液免疫活跃和细胞免疫的根源被去除,降低了炎症反应程度,促进了溃疡的愈合。这也提示 IL-6、IL-8、IL-2、IL-17、TGF-β1及α-防御素的水平可作为判断机体细胞免疫功能的重要指标,并对病情的严重程度及预后的评估起到协助作用。
综上所述,消化道溃疡患者的血清细胞因子水平显著升高、α-防御素水平显著降低,HP感染、十二指肠球部溃疡会进一步升高患者血清炎症因子及降低α-防御素水平。

