3种食源性致病菌的多重PCR快速检测方法研究
闵文光,余慧宏,魏建萍,涂智杰,吴建英,宋建新
(景德镇市疾病预防控制中心,江西 景德镇 333000)
微生物引起的食源性疾病中,志贺菌,大肠埃希菌O157与副溶血性弧菌引起的食源性疾病占据了大多数。传统检测方法的操作步骤过于繁琐,工作量大,检测周期长,不能及时为食源性疾病爆发和食物中毒提供有效的线索[5]。本研究旨在建立一种快速同时检测三种病原菌的多重PCR方法。有文献报道,志贺菌侵袭性质粒抗原H的IpaH基因[1]、副溶血性弧菌t1基因[2],大肠埃希菌O157的eaeA基因[3,4]均具有很高的特异性,在这些文献研究中已得到验证。通过对三种致病菌的基因进行分析,设计出各自特异性PCR引物,通过对病原学标本的合理处理,PCR反应条件的摸索,能同时对三种病原菌进行PCR扩增。
1 材料与方法
1.1 材料
1.1.1 菌株实验所用菌株共8株,分别为志贺菌(ATCC10412)、大肠埃希菌 O157(ATCC43888)、肠道致病性大肠埃希氏菌(ATCC11775)、产肠毒素性大肠埃希菌 (ATCC35401)、 金黄色葡萄球菌(ATCC29213)、单核细胞增生李斯特菌(CMCC54004)、蜡样芽孢杆菌(CMCC(B)63303)、副溶血性弧菌(ATCC17802)。所有菌株均为本实验室保藏菌株。
1.1.2 培养基LB培养液组成成份 胰蛋白胨10g/L、NaCl 10g/L、酵母提取物 5g/L,用 40g/LNaOH 调pH至7.0。
1.1.3 试剂及仪器 Taq DNA聚合酶、dNTP、Mg-Cl2、10×PCR buffer购于上海生工;引物由上海生工合成;DL2000DNA Marker、溴化乙锭购于大连宝生物工程有限公司;琼脂糖为西班牙Biowest公司产品。PTC-200PCR仪为美国MJ公司产品;LEGEND MICRO 21Centrifuge高速离心机为美国Thermo Scientific公司生产;FLY-211B恒温摇床;DYY-6C电泳仪为北京六一仪器厂生产;GelDoc 2000凝胶成像系统为美国Bio-Rad公司生产。
1.2 方法
1.2.1 引物设计 根据志贺菌侵袭性质粒抗原H的IpaH基因[1]、副溶血性弧菌t1基因[2],大肠埃希菌 O157 的 eaeA 基因[3,4]设计 3 对引物(表 1)。本实验提取3种菌株核酸为模板,进行PCR扩增,扩增产物进行电泳鉴定。
1.2.2 DNA模板的制备 将8株保藏菌株按照不同组合方式接种于5mlLB培养液中,37℃振荡培养,取菌液150μl于离心管中,12000r/min离心12min后弃上清,收集菌体,加1ml生理盐水洗涤1次,然后以100μl生理盐水悬浮菌体,沸水浴加热5min,迅速冷却后,12000r/min离心5min,上清即为DNA模板[6]。
1.2.3 大肠埃希菌O157,志贺菌,副溶血性弧菌单独PCR扩增实验 以表1中3对引物分别对3株目的菌的DNA进行PCR扩增验证引物的有效性,PCR 反应条件:94℃预变性 5min;94℃变性 30s,55℃退火 30s,72℃延伸 30s,进行 35 个循环;最后72℃延伸 5min。PCR 反应体系 (20ul):Mg2+浓度2.0mmol/L,10 ×PCR Buffer:2μl,2.5mmol/L dNTPs 2μl,5U/μl Taq DNA 聚合酶 0.4μl,20umol/L 引物2μl,DNA 模板 2μl,加 ddH2O 补足到 20μl[6]。 PCR产物检测:各取5μl PCR产物进行琼脂糖电泳,以DL2000Marker作参照,在2%琼脂糖凝胶 (含EB 0.5μg/ml)中,200V电泳,在凝胶成像系统中观察结果。
1.2.4 引物特异性实验 以表1中3对引物分别对8株实验菌株的DNA进行PCR扩增以验证引物的特异性[6],PCR检测方法同1.2.3中所述[6]。
1.2.5 多重PCR检测LB培养液中多种病原菌将志贺菌、副溶血性弧菌、大肠埃希菌O157分别、同时与其他5种病原菌 (包括肠道致病性大肠埃希菌,产肠毒素性大肠埃希菌,金黄色葡萄球菌,单核细胞增生李斯特菌,蜡样芽孢杆菌)接种于LB培养液中培养[7],所有细菌接种量为5cfu/ml,用上述PCR方法检测。
2 结果
2.1 大肠埃希菌O157,志贺菌,副溶血性弧菌单独PCR扩增 采用LB培养液增菌后,提取3种目的菌DNA,对三种目的菌分别进行PCR扩增,(图1)。
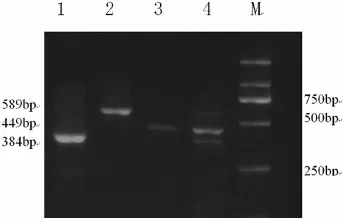
图1 大肠埃希菌O157,志贺菌,副溶血性弧菌单独PCR扩增结果
由图1可知,在LB培养液中增菌的大肠埃希菌O157,志贺菌,副溶血性弧菌均能扩增出条带,其中大肠埃希菌O157和志贺菌的扩增效果较好,副溶血性弧菌的扩增条带较弱,可以加大DNA模板量增强扩增效果。
2.2 引物特异性实验 用表1中的3对引物对8株实验菌株进行PCR扩增,分析引物的特异性,结果表明,3对引物只能扩增目标基因,不会扩增非目的基因,特异性良好。
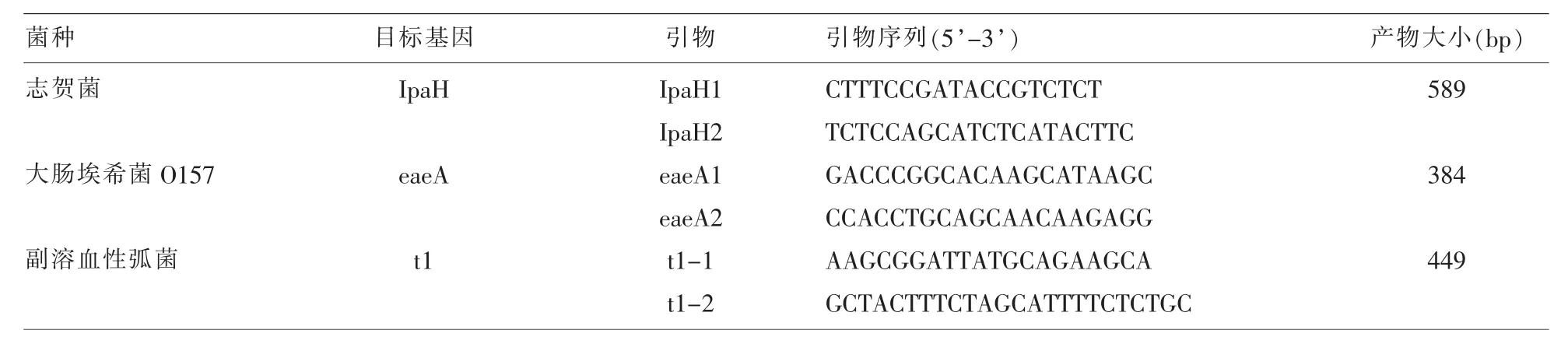
表1 志贺菌、大肠埃希菌O157、副溶血性弧菌多重PCR反应引物序列

表2 引物特异性实验结果
2.3 多重PCR检测LB培养中多种病原菌 将大肠埃希菌O157,志贺菌,副溶血性弧菌,干扰菌(金黄色葡萄球菌,单核细胞增生李斯特菌,蜡样芽孢杆菌,肠道致病性大肠埃希菌,产肠毒素性大肠埃希菌)分别或同时接种到LB培养液中37℃振荡培养10h进行增菌[8]。实验重复3次,提取DNA进行多重PCR检测。
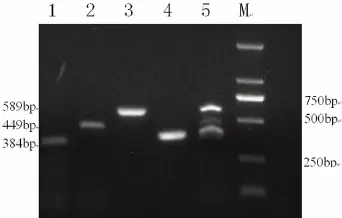
图2 接种LB培养液的待测菌多重PCR结果
1,4 为大肠埃希菌O157和其他干扰菌,2为副溶血性弧菌和其他干扰菌,3为志贺菌和其他干扰菌,5为大肠埃希菌O157,志贺菌,副溶血性弧菌和5种干扰菌
从图2可以看出,接种5cfu/ml大肠埃希菌O157和其他干扰菌仅扩增出384bp的特异性条带;接种5cfu/ml副溶血性弧菌和其他干扰菌仅扩增出449bp的特异性条带;接种5cfu/ml志贺菌和其他干扰菌仅扩增出589bp的特异性条带;同时接种平均5cfu/ml大肠埃希菌O157,志贺菌,副溶血性弧菌和其他干扰菌后,在泳道上只有3条特异性条带,而没有其他条带,表明多重PCR有良好的特异性。
3 讨论
本研究根据志贺菌IpaH基因、副溶血性弧菌t1基因、大肠埃希菌O157 eaeA基因设计特异性引物,为了验证引物的特异性,在实验中加入肠道致病性大肠埃希菌,产肠毒素性大肠埃希菌,金黄色葡萄球菌,单核细胞增生李斯特菌,蜡样芽孢杆菌5种干扰菌,通过PCR扩增反应,结果得出,设计的引物有很好的特异性,同时根据参考文献,优化PCR条件,建立一种同时检测大肠埃希菌O157,志贺菌,副溶血性弧菌的多重PCR检测方法。使用LB增菌液同时培养大肠埃希菌O157,志贺菌和副溶血性弧菌,能通过多重PCR反应检测出来[9,10]。使用一种培养液同时培养3中致病菌,大大减少了增菌和模板提取的工作量,提高了检测效率。有报道称直接从样本中直接富集菌体进行PCR,这对样本要求较高,容易导致漏检,增菌后检测能显著提高阳性检出率。

