新余市甲型H1N1流感病毒H275Y突变监测
刘瑞弘 ,文奇 ,付倩 ,毛尚根 ,龚甜 ,徐刚
(1、新余市疾病预防控制中心,江西 新余338000;2、江西省疾病预防控制中心,江西 南昌 330029)
2009年3月新型甲型H1N1流感病毒起源于墨西哥,并迅速传遍全球,导致了本世纪第一次流感大流行[1,2]。经基因序列分析,该病毒是一种4源重组的甲型流感病毒,由禽流感病毒、普通人流感病毒和2种猪流感病毒 (古典1918猪流感病毒、欧亚猪流感病毒)之间重排、重组形成[3-5],且这种新型流感病毒的NA、M基因与欧亚猪流感病毒株高度同源[6]。最早人们发现新型甲型H1N1流感病毒对神经氨酸酶抑制剂奥司他韦 (Oseltamivir)敏感,对烷胺类药物耐药[7]。但随着甲型H1N1流感病毒在人群中流行传播,Oseltamivir耐药株不断被报道,截至2010年12月29日,全球已发现316株Oseltamivir耐药株,而且这些毒株均发生了NA蛋白H275Y的突变[8]。本文参考日本学者Nukiwa N研发的RT-PCR-RFLP方法[9],监测新余市2013年-2015年分离出的部分甲型H1N1流感毒株,分析其NA蛋白是否发生H275Y突变,以筛查出Oseltamivir耐药株。
1 材料与方法
1.1 标本来源 新余市2013年-2014年流感监测工作中所采集的流感样病例咽拭子标本,采用狗肾传代(MDCK)细胞进行病毒分离培养,随机选择新余市2013年分离的8株、2014年分离的7株甲型H1N1流感病毒作为研究对象。选择江西省2009年-2011年分离的、已进行了NA基因测序分析的2株甲型H1N1流感病毒株A/江西安源/SWL541/2009(H1)、A/江 西 东 湖/SWL11036/2010(H1)作为参考毒株,它们均为Oseltamivir敏感株[10]。
1.2 甲型H1N1流感毒株RNA提取 根据Qiagen公司的 RNeasy Mini Kit试剂盒(Cat.No:74106,Lot No:145022097)说明书提取流感病毒毒株RNA。
1.3 RT-PCR扩增NA基因 采用Qiagen公司One Step RT-PCR Kit 试 剂 盒 (Cat:210212,Lot No:148047795) 进 行 RT-PCR 反 应 。 引 物 F:5′-AATCAGTCGAAATGAATGCCCCTAATGAT-3′;R:5′-CGATACTGGACCACAACTGC-3′;RT 反 应 条件 :60℃ 1min,42℃ 10min,50℃ 30mim,95℃15min。 PCR 循 环 如 下 :94℃ 30s,55℃ 30s,72℃30s,35 次循环,72℃ 10min, 在 MJ Research PTC-200仪器上进行扩增,扩增片段长度为224bp。
1.4 RFLP分析 采用NEB公司BclI限制性酶(Lot No:6121305)对扩增产物进行 50℃ 1h酶切。H275Y突变株不能被酶切,而敏感株(野生株)则被BclI酶切成198bp和26bp 2个片段。RFLP反应 体 系 :BclI 限 制 性 酶 0.45μl,10×NEB 缓 冲 液1μl,H2O 3.55μl,DNA 5μl。
1.5 电泳 One Step RT-PCR扩增产物及其RFLP产物采用3.0%琼脂糖凝胶、北京六一产的DYY-6C型电泳仪电泳 1h,BIO-RAD公司 Universal HoodⅡ凝胶成像仪观察电泳结果。
1.6 统计学处理 应用SPSS 13.0软件进行卡方检验,P<0.05表示差异具有统计学意义。
2 结果
2.1 2013年-2015年新余市流感病毒分离情况除2015年未分离到甲型H1N1外,每年B型、H3N2型和甲型H1N1流感病毒共同流行,并交替为优势株 (表1)。新余市2013年-2015年甲型H1N1 流感病毒分离情况分别为 45(3.66%)株、25(2.12%)株和 0(0%)株,年度之间的差异具有统计学意义(P<0.05),年度流行强度呈下降趋势。
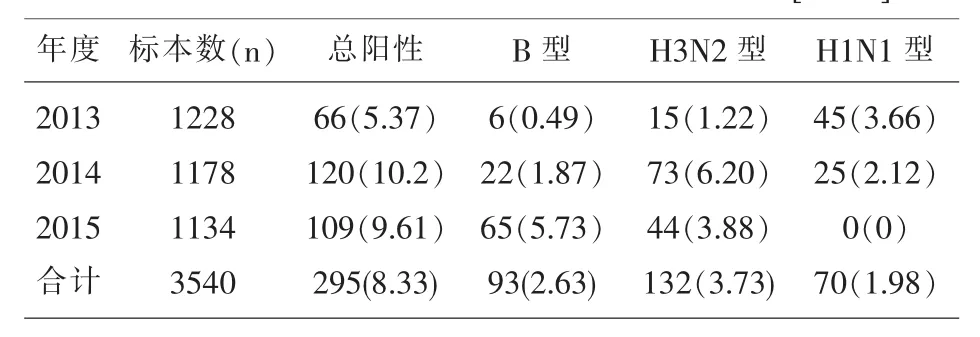
表1 2013年-2015年新余市流感病毒分离情况[n(%)]
2.2 NA基因的RT-PCR-RFLP结果分析 新余市15株甲型H1N1流行株(图1和图2)中,除毒株A/江西渝水/SWL1220/2014(H1)仅见大小约224 bp的RT-PCR产物(未被酶切消化)外,其余14株(含8株2013年、6株2014年流行株)和2株参考毒株的RT-PCR产物均被BclI限制性酶酶切成大小约为198bp、26bp的两个片段,表明毒株A/江西渝水/SWL1220/2014(H1)系H275Y突变耐药株,其他流行株均为敏感株。
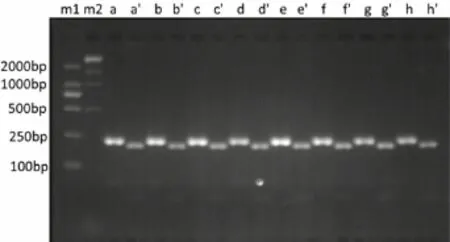
图1 新余市2013年部分甲型H1N1流感毒株RT-PCR产物及其RFLP产物电泳图谱

图2 新余市2014年部分甲型H1N1流感毒株RT-PCR产物及其RFLP产物电泳图谱
3 讨论
Oseltamivir被WHO推荐用于治疗甲型H1N1患者的一线药物,也是目前全世界范围内最常使用的抗流感类药物[11]。自甲型H1N1取代原有的H1N1成为季节性流感以来,有关该病毒对Oseltamivir耐药的报道不断增多。中国大陆最早报道的耐Oseltamivir甲型H1N1流感毒株为A/Hunan/SWL3/2009(H1),系从湖南一输入性病例标本中分离得到[12,13]。此后我国陆续在浙江、云南和福建等省份的流感监测中发现个别Oseltamivir耐药株,这些耐药株共同的NA基因改变是在823位由C变成T,即NA蛋白发生了H275Y替换[14-16]。
以往耐药基因突变位点最常用的检测方法是基因测序,本次研究选用RT-PCR-RFLP方法,简化了实验步骤,采用RT-PCR方法直接扩增目标片段,将扩增产物进行酶切消化,电泳观察结果。该方法巧妙地将上游引物设计成含有一个错配碱基的序列 (导致目的扩增片段的820位碱基由T变成G),甲型H1N1流感Oseltamivir敏感株NA基因经扩增后得到目标片段含有BclI酶切识别序列(TGATCA),可被酶切成大小约为198bp、26bp的两个片段,而H275Y突变株的扩增片段在相应位置序列为TGATTA,不被BclI酶识别消化,即可筛查出H275Y突变株。
近年来江西省内部分疾控机构对辖区内甲型H1N1流感病毒分离株NA基因进行了相关研究[21-24],并未筛查到H275Y突变毒株。我们通过对2013年-2014年新余地区的15株甲型H1N1流感病毒NA基因进行RT-PCR-RFLP分析,成功筛选出1株H275Y突变株 A/江西渝水/SWL1220/2014(H1),此突变株为江西省内首次发现的甲型H1N1流感耐Oseltamivir H275Y突变株,当年已被国家流感中心所确定[17]。对该毒株分离标本的病例情况进行调查:患者为8个月大的幼儿,男,2014年3月9日因发烧于水北镇一乡村卫生所就诊,发热不见好转后第2d转诊到新余市人民医院门诊进行治疗,期间体温在38.4℃-39℃之间,咽部、肺部特征阴性,未使用过Oseltamivir等抗流感药物,门诊医生于3月12日采集了患儿的咽拭子。这些调查结果表明,该患儿感染上的H275Y甲型H1N1流感病毒并不是因为使用了Oseltamivir等抗流感药物诱导产生的。在关于全球2013-2014年度流感病毒对NAIs敏感性更新报告中提到,在甲型H1N1流感病毒中发生H275Y替换的比率已达到3.28%(169/5152),在曾携带H275Y甲型H1N1流感病毒的已康复患者中,有82%的人在采集标本前未使用过NAIs抗流感药物治疗,说明这些突变毒株已具备自发产生和传播的潜质[18]。事实上,日本北海道札幌曾发生一起社区聚集性(39人感染)的H275Y甲型H1N1流感疫情事件,美国一年内20个州共检出57人也感染上这种病毒,这些病例均未经治疗或者不具有Oseltamivir暴露史[19,20]。尽管中国大陆对甲型H1N1流感病毒Oseltamivir耐药株的报道数很少,但我们应该加强Oseltamivir耐药株的监测力度,研究并制定防范措施以杜绝流感Oseltamivir耐药株的扩散传播甚至群体性感染事件的发生。

