一侧小脑发作间期低代谢在癫痫术前评估中的定侧价值
高曲文 黎振声 王欣璐 林健 郭晓绯 欧阳习 齐自娟彭凯润 王伟,3
广州军区广州总医院1癫痫科,2核医学科PET/CT中心(广州 510010);3中山大学附属第二医院神经外科(广州 510120)
约1/4~1/3的癫痫患者对药物反应不佳而被称为药物抗性癫痫。癫痫手术对这类患者有可能完全控制其发作。在常用的术前评估方法中,发作间期脑PET/CT渐受重视[1]。在评估中,笔者发现许多患者双侧小脑半球发作间期PET/CT代谢不对称且代谢低的一侧位于致痫灶对侧。为明确一侧小脑相对低代谢是否具有致痫灶定侧价值,笔者进行了以下研究。
1 对象与方法
1.1 研究对象收集2013年6月至2015年12月间经我科确诊为药物抗性癫痫、曾行脑PET/CT检查、接受病灶切除、术后随访1年以上且疗效达到Engel 1级的患者。共入组患者44例,其中6例患者进行了深部电极植入,存在双侧大脑半球低代谢灶者6例,男31例,右利手43个,致痫灶位于左侧大脑半球者24例,位于右侧者20例,术后病理示FCD 37例、节细胞胶质瘤4例,瘢痕脑回2例,脂肪瘤1例,平均随访时间2.5年(1.0~4.2年),手术时平均年龄21.1岁(4.0~39.9岁)。
致痫灶定侧以手术切除病灶侧为准。患者术前评估及手术均经患者本人或监护人签字同意。术前评估流程主要包括:(1)详实的病史询问;(2)神经系统查体;(3)长时间视频脑电图监测并至少监测到一次痫性发作;(4)头颅MR检查,包括T1、T2及Flair成像;(5)发作间期脑PET/CT。如非侵入性检查尚不能明确致痫灶则在得到患者或监护人同意后行深部电极植入进行立体脑电图检查。
采取裁剪式术式切除致痫灶,手术标本送病理科进行常规组织学及免疫组化检查,由有经验的神经病理学专家阅片并给出病理诊断。局灶性皮质发育不良的分类参照国际抗癫痫联盟2011年的标准进行[2]。脑肿瘤诊断标准参照2007年世界卫生组织中枢神经系统肿瘤分类[3]。
1.2 检查方法PET/CT检查:显像仪器采用德国Siemens公司生产的Biograph 16 HR PET⁃CT扫描仪。48 h以内无痫性发作的受检者空腹6 h以上,注射显像剂前平静休息10~15 min,平静状态下通过静脉注射7.4 MBq/kg的显像剂,在暗室静息状态下平卧50~60 min后行数据采集。所有图像重建采用有序子集最大期望值迭代法,并将PET和CT图像传送到工作站进行融合。
PET/CT阅读采用目测法和感兴趣区平均标准摄取值(standardized uptake value,SUV)测量法。目测法:由2名有经验的PET/CT医师双盲目测,连续2个以上断面上发现明确下降判为异常。感兴趣区SUV:先测双侧小脑半球SUV(选小脑半球相邻两个层面,在相对应的皮层区各镜面勾画直径0.4 cm左右的圆形区,同一位点包括轴位、冠状及矢状)。然后计算代谢性分布不对称指数(asymmetry index,AI),AI=(I-C)/[(I+C)/2](“I”表示致痫灶同侧小脑SUV,“C”表示致痫灶对侧小脑SUV)。
1.3 统计学方法用SPSS 17.0对数据进行统计学分析。计数资料采用频数(%)表示;计量资料以x±s表示。首先对数据进行Kolmogorov⁃Smirnov检验,对符合正态分布的采用一个样本的t检验。假设(a):双侧小脑平均摄取值大致相等,即双侧小脑代谢性分布不对称指数为0,以P<0.05为差异有统计学意义。
2 结果
目测法显示在44例患者中,双侧小脑半球代谢大致对称者占61.4%(27/44),致痫灶对侧小脑半球代谢较另一侧低者占38.6%(17/44)。见表1、图1。另外,38例患者PET/CT显示致痫灶同侧大脑半球低代谢,即本研究中PET/CT的定侧价值为86.4%(38/44),6例患者示双侧大脑半球低代谢,其中3例致痫灶对侧小脑半球代谢较另一侧更低,3例双侧小脑半球代谢大致对称(图2)。以一侧小脑PET/CT低代谢为定侧依据,则定对侧大脑半球为致痫灶的敏感性为38.6%(17/44),特异性为100%。加上小脑的定侧价值,则PET/CT总的致痫灶定侧价值可由86.4%提高到93.2%(41/44)。Kolmogorov⁃Smirnov检验显示所有患者双侧小脑AI符合正态分布(P>0.05)。AI=0.034± 0.070,假设(a):双侧小脑半球代谢对称,即AI=0。统计结果显示致痫灶同侧小脑半球代谢较致痫灶对侧小脑代谢高(x>0),且双侧小脑半球AI差异有统计学意义(P=0.002)。
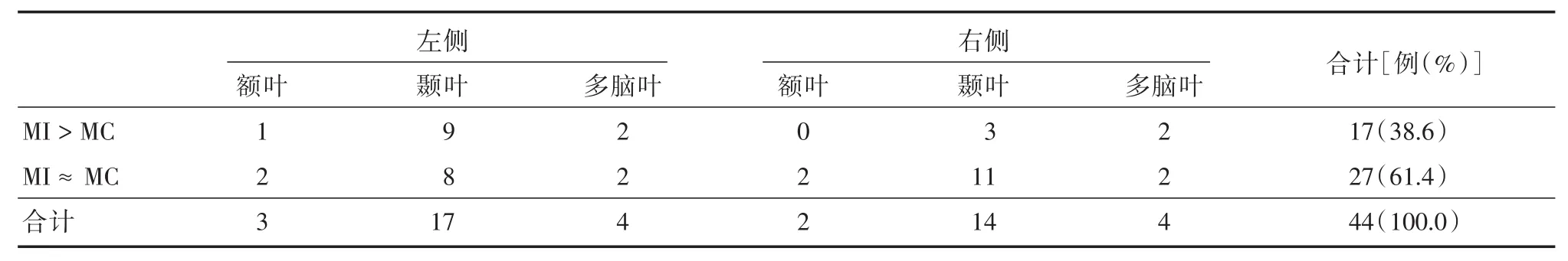
表1 目测法示双侧小脑半球代谢情况Tab.1 Detection of hypometabolism in cerebellum by visual evaluation 例
3 讨论
小脑与癫痫关系颇为密切。首先,小脑通过以Purkinje细胞为核心的微环路对大脑皮质的痫性活动起抑制作用[4]。其次,癫痫患者可能出现小脑萎缩且萎缩程度与sGTCS发作总次数及频率有关[5]。另外,癫痫患者还可出现小脑血流灌注及代谢改变[6]。但有关发作间期PET/CT小脑低代谢在癫痫术前评估中定侧价值的研究目前国内尚未见报导,国外这方面的研究也很少。

图1 一侧小脑半球低代谢定侧实例Fig.1 A case indicating unilateral cerebellum hypometablism lateralizing the epileptogenic zone

图2 双侧大脑皮质低代谢患者一侧小脑低代谢的定侧实例Fig.2 A case with bilateral cerebral hypometablism indicating unilateral cerebellum hypometablism lateralizing the epileptogenic zone
本研究表明致痫灶对侧小脑半球代谢较同侧小脑半球更低,尤其当致痫灶位于左侧时更明显。如果以一侧小脑发作间期PET/CT低代谢判定对侧大脑皮质为致痫灶的话,其敏感性约40%,特异性100%,可将PET/CT总的定侧价值提高约6.8%。1996年SQVIC等将48个部分性发作的癫痫患者分为3组,组1为发作起始及代谢降低均位于颞叶内侧者,组2为发作起始于颞叶内侧并迅速扩散至同侧额叶者,组3为额叶起始且额叶低代谢者,结果显示组1双侧小脑半球发作间期PET/CT代谢无明显差异,组2及组3显示致痫灶对侧小脑半球代谢更低。与本研究的结果出现差异的原因可能是多方面的,如定位致痫灶的方法差异、不同部位致痫灶及不同病理类型的患者构成比例及是否分亚组等。一侧大脑病变,对侧小脑出现低代谢或低灌注的现象于1947年首次被MONAKOW称为交叉性小脑失联(crossed cerebellar diaschisis,CCD)。CCD可见于脑梗死[7-8]、脑神经胶质瘤或脑转移瘤[8]、癫痫[6,9-10]、Rasmussen氏脑炎[11]等多种情况。可能因为失去了对侧大脑皮质-桥-小脑的兴奋性神经传入从而使该侧小脑出现代谢下降、灌注减少[6]。多数CCD是短暂的,但如果低灌注持续时间长也可能是持续性的[12],而脑血管病患者其CCD可长达20年以上[13]。由于本组患者右利手占97.8%(43/44),可能绝大部分以左侧大脑半球为优势半球,而小脑广泛参与了言语、语言工作记忆等过程[14],优势侧大脑半球与对侧小脑可能有更多的联系,当致痫灶位于左侧大脑半球时右侧小脑可能会出现更明显的CCD而表现出更明显的发作间期PET/CT低代谢。
确定致痫灶的金标准是评价各种术前评估技术敏感性及特异性的前提和基础。本研究以致痫灶手术切除侧结合术后随访1年以上达到EngelⅠ级为定侧金标准[15],较PERISSINOTTI等[16]及KAR⁃GIOTISA等[17]的标准更为严格,选择更严格的标准是为了最大程度地减少对致痫灶定侧的误判从而提高结果的可靠性。影响本研究结果的另外一个因素是PET/CT低代谢的检测方法。目前主要有3种检测方法:目测法、SUV法及统计参数图法(Statistical parametric mapping,SPM)。目测法简单、直接,临床上广泛使用,但存在一定主观性。SUV法是一种半定量法[18],是近几年被使用最多的方法,操作简单且在一定程度上减少了主观性,但仍存在诸多影响SUV值的因素,如感兴区形状及面积大小等。SPM是一种基于全脑体素的分析法,由计算机自动处理,进一步减少人为因素的影响[19],但操作相对复杂,一样受不同操作平台等因素的影响。另外,SPM的使用一般要求有年龄、性别匹配的正常对照组,因PET/CT检查对受试者健康有一定影响,正常对照组的获得有不小难度。最后,本研究样本量偏少且致痫区大多位于颞叶(70.5%,31/44),而术后病理大部分为FCD(84.1%,37/44),存在一定选择偏倚,因此,笔者期待能有更大样本量、分组更细、包含更多病理类型并涉及更多其他脑叶的同类研究。
本研究表明在癫痫术前评估中,一侧小脑发作间期不对称性低代谢往往提示致痫灶位于对侧大脑半球,如果发现致痫灶同侧小脑半球低谢更低要警惕定侧的准确性。

