血管钙化相关MicroRNA的研究进展
王亚萍 综述 何胜虎 审校
(1.扬州大学临床医学院,江苏 扬州 225001; 2.江苏省苏北人民医院心内科,江苏 扬州 225001)
血管钙化以往指的是磷酸钙盐在血管壁的沉积[1-2]。它不仅发生在血管老化的过程中,而且发生在糖尿病血管病变和慢性肾脏疾病(CKD)以及多种心血管疾病中[1-2]。由于血管壁的弹性丧失,血管钙化可能导致左心室肥厚和冠状动脉灌注的失衡[1,3]。因此,许多研究表明血管钙化能增加心血管疾病的发病率和死亡率,甚至可以成为独立的预测因子[2,4-5]。在血管钙化进程中位于血管中膜的平滑肌细胞可转化为成骨样细胞,这是一个动态的不可逆的过程。在这个过程中血管平滑肌细胞(VSMCs)失去了收缩表型标志,主要包括α肌动蛋白(α-actin)等,上调了成骨样细胞表型标志,包括核转录因子2(RUNX2)、骨桥蛋白(OPN)、骨钙素(OCN)和碱性磷酸酶(ALP)等[1,4,6-7]。越来越多的数据表明microRNAs(miRs)在VSMCs成骨转化过程中起着重要的作用[4,8]。现就血管钙化中相关miRs的作用进行综述。
1 miRs概述
miRs是一种长度为18~25个核苷酸的非编码小单链RNA,主要作用是通过诱导信使RNA(mRNA)切割或干扰mRNA翻译,对基因表达的转录后调节[9-10]。miRs与靶mRNA的3’非翻译端(UTR)结合,导致mRNA的去稳定化或翻译抑制,调节相应蛋白质的合成[11]。1993年,首次在秀丽隐杆线虫体内发现长度为22 nt的miRs,其可作为基因筛选的靶点识别胚胎发育后期出现的缺陷[12]。后来陆续发现,miRs几乎参与了所有疾病发病过程的调控和一切生命活动的调节,比如调控细胞增殖、分化、迁移、凋亡及表型转换等病理生理过程[13]。因此,miRs作为多种细胞功能的调节剂不仅参与调节基因的多样性并可以调节蛋白质的合成[10]。相应地,miRs的功能失调能影响到多种疾病的发病过程。miRs在钙化的VSMCs的细胞基质囊泡内有很丰富的表达,携带miRs的基质囊泡可在细胞之间来回转运发挥作用,因此miRs功能的失调可改变许多基因的表达。miRs调节血管钙化主要是对其收缩表型、反应应激(例如缺氧)和成骨转分化的调节[8]。在血管钙化的进程中涉及到许多miRs,不同的miRs可能对血管钙化起不同的作用。
2 miRs促进血管钙化(表1)
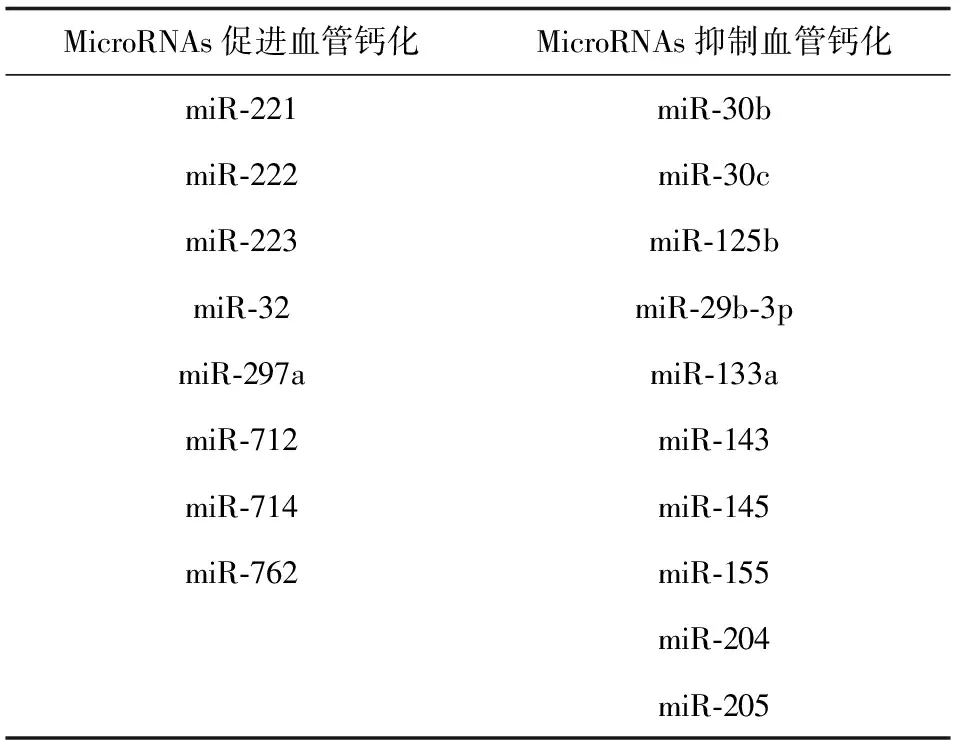
表1 血管钙化相关microRNAs
有研究表明[14],随着无机磷酸盐浓度升高,血管钙化风险也相应增加,同时miR-223的表达也增加,提示miR-223在血管钙化中起一定的作用。另外,在生理上,miR-223还参与骨形成的调控。然而,在血管钙化期间,miR-223可以从动脉粥样硬化斑块的炎症细胞迁移到VSMCs中,可能是导致VSMCs表型转换的一个重要因素[15]。此研究发现,miR-223的高表达确实增加了VSMC增殖和迁移的能力[15]。同时减少了VSMC收缩表型α-actin的表达[15]。 miR-223的靶目标是Mef2c和Rhob,在VSMC表型转换中起关键作用的2种蛋白质[15]。在VSMC中当Mef2c和Rhob在较低表达水平时miR-223是上调的[14]。miR-223的另一个靶目标是VSMC钙化抑制剂核因子IA。miR-223的上调可诱导核因子IA的降解[14,16]。最近有研究报道了在CKD 4期和5期患者中原本下调的血清miR-223在肾移植后可以恢复正常[17]。以上研究提示miR-223在VSMC表型转换和钙化进程中可能起到促进的作用。
Liu等[18]利用骨保护素敲除小鼠制备钙化的模型,取出主动脉后经微点阵检测后发现miR-32的表达上调,且miR-32是通过PI3K-AKT信号通路使磷酸酶张力蛋白基因水平降低,骨形态发生蛋白2(BMP2)、RUNX2、OPN、基质gla蛋白和ALP的表达增多,从而使VSMC发生钙化。在Zheng等[19]的研究中,利用维生素D3加尼古丁建立了大鼠血管钙化模型,通过miRs芯片来分析2组的miRs表达谱,检测后发现钙化组与对照组比较有10个miRs表达增多,6个miRs减少,其中miRNA-297a下调的幅度最大,进一步在基因和蛋白水平证实了其作用的靶点为FGF23,并且通过下调Klotho使FGF23的表达增多。
另一对促进血管钙化的miRs是miR-221和miR-222。它们在VSMC表型转换的过程中发挥协同作用促进血管钙化。在VSMC表型转换的早期阶段它们的浓度随着血管钙化程度的进展而降低。促钙化条件下培养VSMCs发现miR-221和miR-222的表达被抑制[20]。有趣的是miR-221和miR-222的作用靶点不是肌节同源盒基因同系物2和RUNX2,而是通过上调外切核苷酸磷酸二酯酶的表达,产生矿化物质抑制焦磷酸盐的产生[20]。另外,miR-221和miR-222还可以通过抑制钠磷共转运体Pit-1促进血管钙化[20]。另有研究表明miR-712、miR-714和miR-762也可诱导血管钙化。这些miRs直接作用于钙转运通道钠钙交换体亚型1、细胞膜钙泵亚型1和钠钾钙交换体亚型4,从而导致细胞内钙水平的升高。抑制miR-762、miR-714和miR-712可明显延缓钙化的进程[21]。
3 miRs抑制血管钙化(表1)
有研究发现在钙化的冠状动脉VSMCs中miR-30b和miR-30c的表达下调。 其结合的靶点是RUNX2,一种主要的成骨转录调节因子[7,22]。 RUNX2可调节OCN、核因子κB配体的受体激活剂(RANKL)和OPN[4]。 miR-30b和miR-30c的结合点位于RUNX2的3’UTR区域,导致其下调从而抑制ALP活性,使OPN和OCN分泌减少。此外,这两个miRs受到BMP2的控制,BMP2促进血管钙化的机制是通过增加细胞内无机磷酸盐水平和刺激编码成骨细胞表型相关基因的表达[23-24]。用BMP2处理VSMCs后miR-30b和miR-30c的表达明显下调,RUNX2的表达显著增高[25]。
miR-133a主要存在于骨骼和心肌细胞中,现在发现在VSMCs中也有很高的表达,其可能成为预防血管钙化的靶点。进一步来说,miR-133a在VSMCs转变成成骨样细胞过程中是下调的,它也是通过结合于RUNX2的3’UTR区域,导致OCN和ALP的表达量减少,最终维持VSMCs的正常表型[22]。
miR-125b是发现的第一个与人冠状动脉钙化相关的miRs,在血管钙化的早期阶段也可抑制VSMC向成骨样细胞转化[26]。 Goettsch等[26]研究发现,miR-125b在血管钙化过程中是降低的,抑制miR-125b的表达能促进成骨转分化和基质矿化并能增加ALP活性。成骨细胞特异性转录因子Osterix是miR-125b发挥作用的主要靶点并介导了它对血管钙化的保护作用。在体外实验中证实了miR-135a可抑制VSMC的成骨转分化作用。降低miR-135a水平不仅会造成基质矿化,钙离子浓度的增加而且增加ALP和OCN的活性。这些作用是通过Kruppel样因子4/转录激活因子3(KLF-4/STAT3)途径来实现的,其中KLF-4是调节细胞分化和增殖的一种重要的转录因子,但有趣的是在衰老的VSMC中miR-135a的表达是下调的,这可能是老年人群血管钙化发生率增加的原因之一[27];但也有人报道miR-135a能促进血管钙化,机制是通过影响钙转运蛋白的活性通道钠钙交换体亚型1、细胞膜钙泵亚型1和钠钾钙交换体亚型4,从而导致细胞内钙水平增加[21]。
miR-204是不管在体外还是体内已被确定的另一种可以抑制血管钙化的miRs。miR-204同样是通过靶向RUNX2并结合到其3’UTR区域抑制其表达来减轻血管钙化的,同时也降低了ALP和OCN的活性[28]。miR-205也能预防血管钙化,其不仅通过靶向RUNX2,而且通过调节Smad1的活性,影响成骨细胞活动和骨骼发育[29]。 最近的一项研究报道了CKD患者肾脏中miR-204的下调与其肾功能损害严重程度相关[30]。miR-145和miR-155通过刺激心肌细胞的活性从而在维持VSMC表型中起重要作用。当这些miRs水平下降后VSMCs易转换成成骨样细胞,从而加速了血管钙化的进程[31]。
miR-133a和miR-143在无机磷酸盐诱导的钙化细胞中也是下调的。这些miRs的结合靶点是osterix和Smad1,使其在钙化期间保持过度分泌的状态。有趣的是,有研究显示Mg能阻止miR-133a和miR-143的下调,这表明它可能对血管钙化有保护作用[32]。也有报道说随着无机磷酸盐浓度升高能降低miR-143和miR-145的水平。随着这些miRs的生物利用度降低会导致血小板衍生生长因子和KLF-4和KLF-5表达的增加,而这2种因子与血管钙化的进程是有关系的[14,16]。另一对在血管钙化中发挥重要作用的miRs是miR-29a和miR-29b,其可以调节成骨细胞和破骨细胞的活性[33]。微调这些miRs的功能不仅可以发生血管钙化而且会使动脉管壁变硬。miR-29的主要靶点是凝血酶敏感蛋白(disintegrin and metalloproteinase with thrombospondin motifs-7,ADAMTS-7)。ADAMTS-7 下调后,导致BMP2活性的降低和软骨寡聚基质蛋白(COMP)降解的延迟,COMP是一种参与维持VSMC收缩表型的糖蛋白。最后的结果是预防血管钙化和保持动脉弹性[33]。也有其他人报道miR-29通过下调弹性蛋白的表达促进血管钙化。弹性蛋白的减少会促进VSMC转换成成骨细胞表型并伴随血管壁钙沉积的增加[34]。Jiang等[35]用维生素D3喂食大鼠建立动脉钙化的模型后发现在钙化的血管组织中基质金属蛋白酶-2(MMP-2)的表达增多,同时miR-29b-3p的表达降低,接着用转染的方法进一步证实了MMP-2的3’UTR区域就是miR-29b-3p 作用的靶点,过表达miR-29b-3p后能抑制MMP-2的产生从而延缓血管钙化的进程。
4 小结与展望
miRs与许多疾病都有所关联,包括心血管疾病、肿瘤和自身免疫疾病等,然而miRs在血管钙化中的作用还未研究透彻,并且关于miRs的调节机制的阐述也很有限。越来越多的研究表明,血管钙化受多重miRs的网络调节,且是一个复杂可调控的过程。因此,miRs可作为早期血管钙化的生物学标志,检测相关的miRs及时起干预作用防止其进展;但由于这个过程调节的复杂性和多重性,需更多的研究筛选确定可用于靶向治疗的最佳miRs。目前,有研究者已陆续发现一些miRs与血管钙化机制之间的关系,但只发现极少部分的miRs参与调节血管钙化,因此,深入研究miRs在血管钙化的作用显得尤为重要,相信在不久的将来,miRs可成为临床治疗血管钙化的新靶点。

