枯草芽孢杆菌碱性蛋白酶基因在酿酒酵母中的表达和应用
张若兰,刘庆国,王敏,汪琨,朱廷恒
(浙江工业大学 生物工程学院,浙江 杭州,310014)
碱性蛋白酶是指用于水解蛋白质或多肽并且在碱性环境下活力较高、稳定性较好的一类酶[1],与酸性和中性蛋白酶相比具有作用范围广,水解能力强等优点。目前,碱性蛋白酶广泛应用于蛋白质去除、食品制剂、皮革加工、医药和生物修复等方面[2-5],大豆蛋白水解就是其中十分重要的一个方面。大豆蛋白的必需氨基酸含量丰富、组分齐全,与牛奶蛋白质的氨基酸组成相近,是最具营养的植物蛋白质[6],但是大豆蛋白中的大部分蛋白如β-伴大豆球蛋白、大豆球蛋白和胰蛋白酶抑制因子都是致敏性蛋白[7],影响了其作为食物的可接受性,并且大豆蛋白质的分子结构较为紧密,对酶解具有很强的抵抗力,不易被吸收, 使得其消化率和生物效价不及牛奶、蛋等动物性蛋白。为了使植物蛋白质成为优质蛋白养分更好的被利用吸收,在饲料和食品工业中,可添加碱性蛋白酶催化饲料中的大分子蛋白质降解为肽和氨基酸。酿酒酵母是用于饲料和食品生产的益生菌,目前利用酿酒酵母表达碱性蛋白酶的研究较少。枯草芽孢杆菌具有产蛋白酶量大、耐高温等特点,从枯草芽孢杆菌中克隆碱性蛋白酶基因转化进酿酒酵母中,获得的产碱性蛋白酶酵母在食品和饲料生产中具有重要的现实意义。
我国的碱性蛋白酶研究存在微生物资源开发不足,种类较少,作用范围较窄,酶制剂品种单一、价格昂贵等问题[8]。目前大多碱性蛋白酶研究重点集中在高产菌的筛选、酶的分离和纯化及酶的应用等方面,而且大多是应用在洗涤和皮革等行业[9-12]。在食品和医药工业中,主要应用来自曲霉属的碱性蛋白酶[13],但是其发酵过程易受多种因素(如易污染或菌株生长状态)影响。另外,米曲霉产生的蛋白酶种类较多,这增加了碱性蛋白酶的纯化难度,阻碍了其进一步的开发利用[14]。
重组DNA技术和蛋白质工程具有大幅提高酶的产量,推出量身定制的功能特性,包括稳定性,催化活性和特异性,克服一些传统菌种选育方法缺点等的优势[15-18]。基于碱性蛋白酶在食品发酵行业的广泛需求,利用基因工程技术挖掘安全、价格低廉、菌体易于培养、易于实现工业化生产的菌株是未来研究亟待解决的问题。
酿酒酵母在食品和医药等领域有广泛应用,是一种典型的真核细胞模型和重要的模式生物[19],可表达各种原核和真核来源的蛋白。酿酒酵母在饲料蛋白原料豆粕的发酵加工中是主要微生物,但是酿酒酵母几乎没有碱性蛋白酶活性,不能有效地去除豆粕中的抗原蛋白,本文将来自枯草芽孢杆菌的碱性蛋白酶基因克隆至酿酒酵母中构建工程菌,诱导表达目的蛋白,对其性质进行研究,为碱性蛋白酶在食品发酵工业的更广泛应用提供依据。
1 材料和方法
1.1 实验材料
1.1.1 菌株
酿酒酵母Whu2d(尿嘧啶缺陷)、大肠杆菌(Escherichiacoli)(含有pYES2质粒)、E.coliDH 5α由本实验室保存。
1.1.2 工具酶、试剂盒和试剂
rTaq聚合酶、限制性内切酶、DNA Marker和琼脂糖凝胶回收试剂盒等均购自TaKaRa公司;卡那霉素、PCR产物纯化试剂盒、小量DNA产物纯化试剂盒、福林酚和酪蛋白等均购自上海生工生物工程有限公司;大豆胰蛋白酶抑制因子测定试剂盒、大豆球蛋白测定试剂盒、β-伴大豆球蛋白测定试剂盒等均购自北京龙科方舟生物工程技术有限公司, 其他试剂均为进口或国产。
1.1.3 实验仪器
Biometra PCR仪、低温离心机、MniniRUN Ge100型电泳槽、RH-150生化培养箱,上海一恒;YXQ-LS-50SⅡ立式压力蒸汽灭菌器,上海博讯;UV7504分光光度计、JIRCAS 3UV Transilluminator紫外投射仪和超声波破碎仪等。
1.2 方法
1.2.1 编码枯草芽孢杆菌碱性蛋白酶重组基因的获得及其表达载体的构建和鉴定
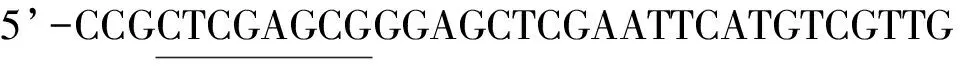
1.2.2 酿酒酵母菌工程菌的构建和验证
将重组质粒pYES2-SAP通过醋酸锂转化法转入酿酒酵母Whu2d中,转化后分别涂布于YNB(URA3-)平板上,30 ℃培养2~4 d。挑取URA3+转化子接到YNB(URA3-)液体培养基中,30 ℃培养16 h,用试剂盒提取酵母质粒。将获得的质粒转化E.coliDH5α进行扩增。挑取克隆子用引物进行PCR鉴定,F2: 5’- GAGGACCAAGAAGACATCA- 3’;R2: 5’- GTGGAGAAGCCATAGAGG - 3’,PCR扩增条件同上,产物经琼脂糖电泳检测,阳性酵母转化子命名为 pYES2-SAP-Whu2d。
1.2.3 重组酵母菌株的诱导表达和碱性蛋白酶活力测定
挑取酿酒酵母转化子接种于5 mL YNB(URA3-)液体培养基中,以28 ℃、200 r/min振荡培养12 h,然后转接到100 mL发酵培养基中。离心收集上清液,用福林酚法测定酶活,将0.025 mol/L硼酸-氢氧化钠缓冲液(pH为10.5)配制的酪蛋白溶液,40 ℃预热5 min。待测样品1.00 mL,40 ℃水浴2 min;加酪蛋白溶液1.00 mL 40 ℃水浴10 min;加入2.0 mL浓度为0.4 mol/L的三氯乙酸,随后以12 000 r/min离心10 min,取1.00 mL上清液加入5 mL浓度为0.40 mol/L的Na2CO3溶液和1 mL福林试剂,40 ℃保温20 min,在680 nm下测定其OD值。40 ℃下1 mL反应混合物每分钟催化产生1 μg 酪氨酸的酶量定义为1个活力单位(U)。收集发酵液进行SDS-PAGE分析。
1.2.4 温度和pH对碱性蛋白酶活性和稳定性的影响
将粗酶液反应温度设为30~60 ℃(梯度为5 ℃)探究碱性蛋白酶的最适反应温度。在30~70 ℃(梯度为10 ℃)下处理粗酶液10~60 min 探究碱性蛋白酶的热稳定性。将粗酶液反应pH值设为磷酸盐-柠檬酸钠(pH 7.0、7.2、7.6、8.0、9.0)、硼酸缓冲液(pH 10.5,pH 13.0)的不同pH值下探究碱性蛋白酶的最适反应pH。然后在4 ℃、pH值7.0~13.0条件下处理粗酶液12 h测定残余角蛋白酶酶活。未受任何处理的酶活性定为100%,各种处理的酶活与之对比,计算出相对活性。
1.2.5 金属离子和蛋白酶抑制剂对酶活性的影响
将50 mmol/L MgSO4、MnCl2、BaCl2、CuSO4、ZnCl2、FeSO4、CaCl2、LiAc、CoCl2溶液,添加到反应体系中探究金属离子对酶活性的影响。在粗酶液中加入SDS、Tween60、Triton X-100、EDTANa2、β-巯基乙醇、PMSF等蛋白抑制剂4 ℃处理30 min,探究其对碱性蛋白酶活性的影响。
1.2.6 重组蛋白酶工程菌对豆粕中蛋白和抗营养因子的降解研究
将酿酒酵母工程菌于5 mL液体YNB试管培养基中,200 r/min,28 ℃,摇床培养14~16 h。接入10%的菌液量于固态发酵培养基中,28 ℃发酵48 h。用凯氏定氮法对发酵前后豆粕中的粗蛋白含量进行测定。用半微量法或全量法粗蛋白质测定方法测定发酵前后酸溶蛋白含量。用酶联免疫法(ELISA)定量测定试剂盒测定发酵前后豆粕中抗营养因子β-伴大豆球蛋白、大豆球蛋白、胰蛋白酶抑制因子的含量。
2 结果与分析
2.1 编码枯草芽孢杆菌碱性蛋白酶重组基因的获得及其表达载体的构建和鉴定
2.1.1 碱性蛋白酶成熟肽编码基因 (SAP)的PCR扩增
含有碱性蛋白酶基因的pUC57-SAP质粒DNA为模板,以F1/R1为引物,PCR扩增得到1 181 bp源于枯草芽孢杆菌并经密码子优化的碱性蛋白酶基因SAP。
2.1.2 重组表达质粒的构建和鉴定
将SAP基因DNA片段克隆到TA载体 pMD19,将重组质粒转化到E.coliDH5α。用XhoⅠ、SphⅠ分别酶切表达质粒pYES2和pMD19-SAP,连接获得pYES2-SAP重组表达质粒,将重组质粒转化到E.coliDH5α中,使用含100 μg/mL 氨苄青霉素LB 平板培养基筛选得到阳性克隆。用限制性内切酶XhoⅠ、SphⅠ进行酶切验证,得到大小为1 181 bp和5 787 bp 的条带,酶切验证正确 。
2.2 酿酒酵母菌工程菌的构建和验证
将pYES2-SAP通过醋酸锂转化法转入到酿酒酵母Whu2d转化液涂布于YNB(URA3-)固体培养基上,随机挑取转化子提取酵母质粒,转入E.coliDH5α中,以F2/R2 为引物进行PCR验证。pYES2-SAP-Whu2d转化子在975 bp处出现条带,与理论值相符 。
2.3 重组酵母菌株的诱导表达
挑取17个阳性转化子接种于YNB(URA3-)液体培养基,出发菌株接种于YPD液体培养基,培养16 h后,将所得菌体转接到发酵培养基中,培养后对出发菌株和工程菌株上清液和胞内液粗酶活进行酶活测定。出发菌株与7号工程菌株的酶活有很大差异,对其进行显著性分析,分析结果见图1。结果显示,两者酶活存在显著差异(p<0.01),工程菌株比出发菌株的粗酶活高55.2%。证明SAP在酿酒酵母WHU2d中成功表达。收集上清液进行SDS-PAGE验证,结果见图2,根据氨基酸序列推导出来的碱性蛋白酶理论分子量是39.5 kDa,没有看到目的蛋白的条带,而通过酶活测定有酶活,证明碱性蛋白在酿酒酵母中表达了,但是表达量太少,通过SDS-PAGE看不出来。
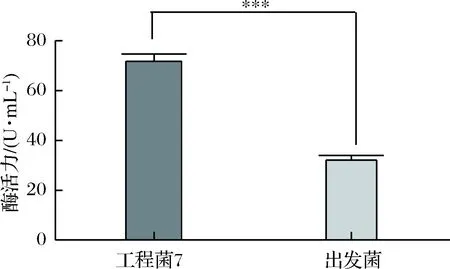
图1 酶活力显著性差异Fig.1 The significance difference of enzyme activity* 代表差异的显著性
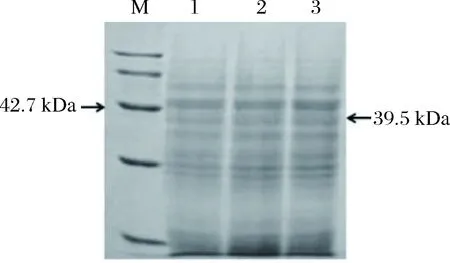
M-maker;1-原始菌株; 2-空质粒菌株; 3-重组菌株图2 SDS-PAGE分析碱性蛋白酶的表达Fig.2 The analysis of Alkaline protease by SDS-PAGE
2.4 碱性蛋白酶酶活性质分析
2.4.1 碱性蛋白酶最适反应温度及温度稳定性
由图3-a可知,重组酶的最适温度为45 ℃,温度低于45 ℃时,酶活随温度上升而上升,当温度高于45 ℃时,酶活迅速下降。将粗酶液置于30、40、50、60、70 ℃水浴中保温20~60 min后,再与1%酪蛋白底物混合反应,测定酶活,结果如图3-b。可以看出,在30 ℃和40 ℃保温1 h后,剩余的酶活分别为97%和90%,表明该粗蛋白酶在温度低于40 ℃时酶活是稳定的;当温度在50~60 ℃之间时,蛋白酶活性有所降低,但酶活仍在70%左右;高于60℃时,酶活迅速下降,70 ℃保温60 min后,相对酶活接近于0。
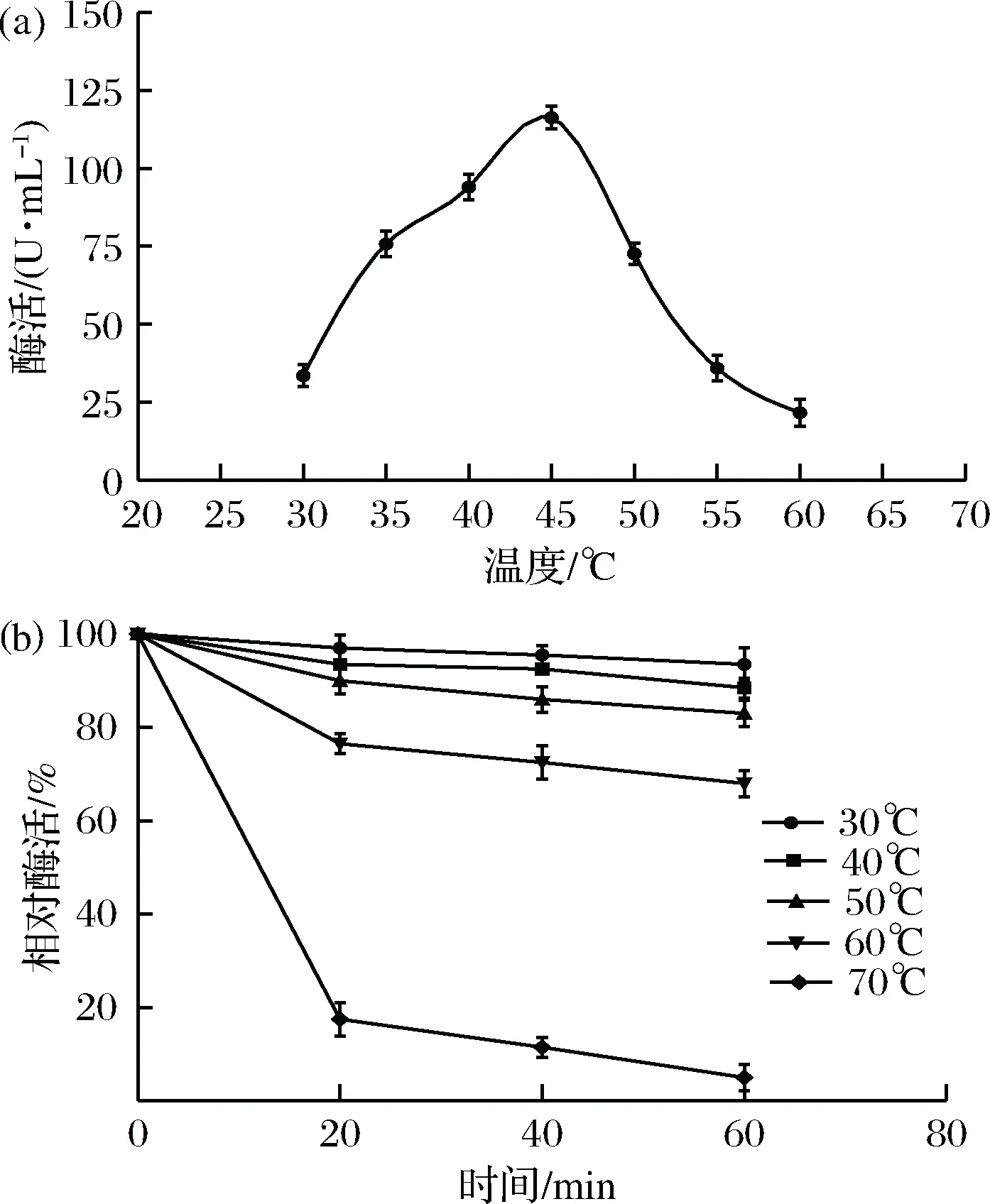
图3 温度对蛋白酶粗酶活的影响Fig.3 Effects of temperature on the protease activitye
2.4.2 碱性蛋白酶最适反应pH及pH稳定性
从图4-a中可以看出,此蛋白酶从中性到碱性都有活性,在pH 8.0时,酶活达到最高。将粗酶液与不同pH的1%酪蛋白溶液混合后,4 ℃放置12 h,进行酶活测定,结果如图4-b。可以看出,该蛋白酶从中性到到碱性(pH7.6~10.5)酶活力较稳定,而且相对酶活都在80%以上。只有pH在高于11或12时,酶活力才会明显降低。因此确定该蛋白酶属于碱性蛋白酶。
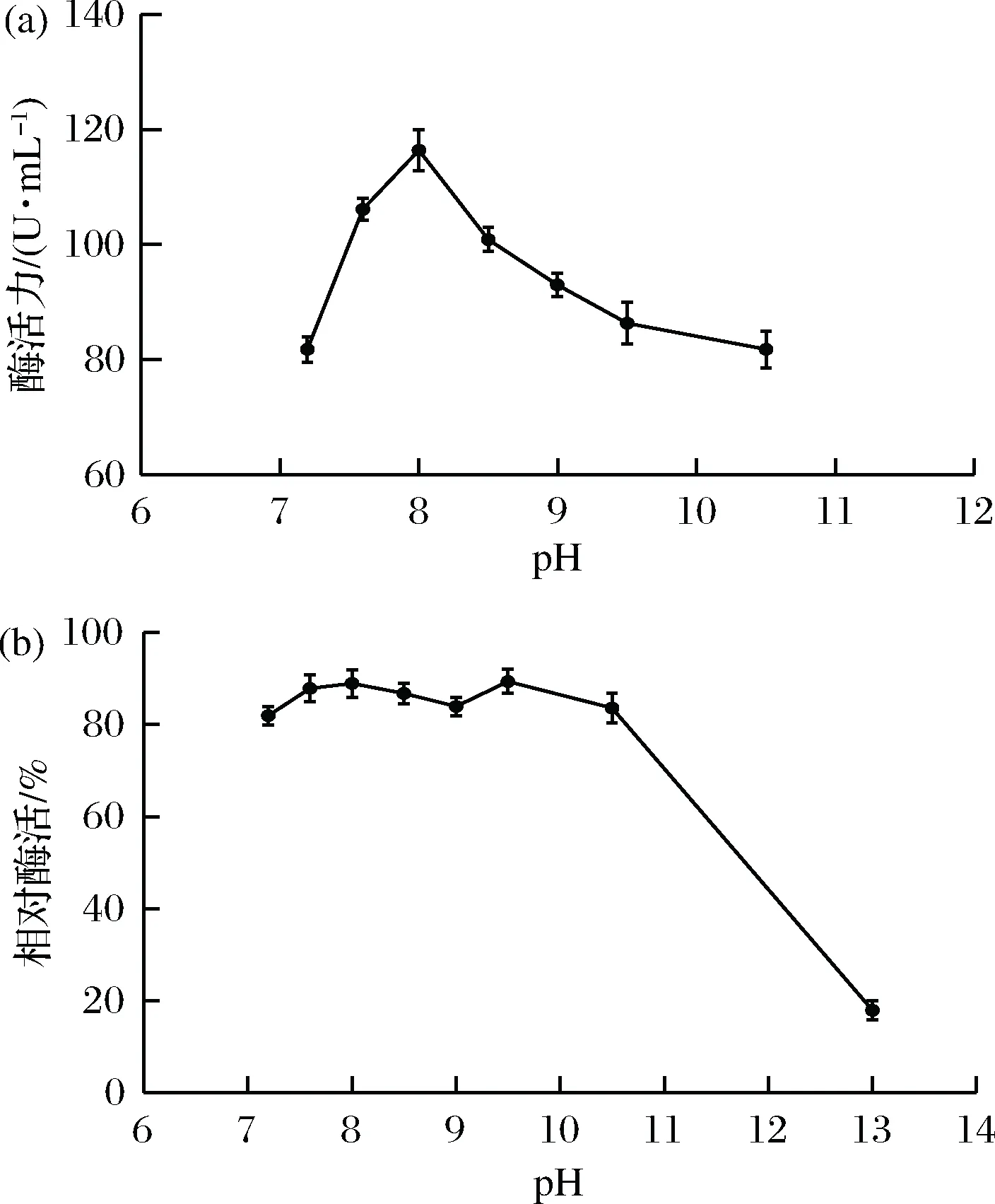
图4 pH对蛋白酶粗酶活的影响Fig.4 Effects of pH on the protease activitye
2.4.3 金属离子对碱性蛋白酶活性影响
将粗酶液与不同金属离子溶液按比例混合,使得金属离子的最终浓度为1 mmol/L和5 mmol/L,4 ℃放置30 min,测定酶活性,结果用相对酶活表示(反应中加去离子水的酶活为100%),见图5。其中Mg2+、Li+和Co2+对该粗酶液酶活基本没有影响;当金属离子为1 mmol/L时,Mn2+、Fe2+、Ca2+对酶活没有明显的影响,而Ba2+、Cu2+、Zn2+对酶活有一定的促进作用,但增加的幅度并不太大。当金属离子为5 mmol/L时,Ba2+、Cu2+、Zn2+、Fe2+、Ca2+对酶活同样有促进作用,增加幅度略高于低浓度金属离子。根据文献得知微生物来源的碱性蛋白酶在一定浓度Mn2+存在时,Mn2+会提高碱性蛋白酶的活性,并能提高蛋白酶的温度稳定性[20],而当Mn2+的浓度为5 mmol/L时,对该蛋白酶酶活有明显的促进作用(p<0.01),与理论相符。
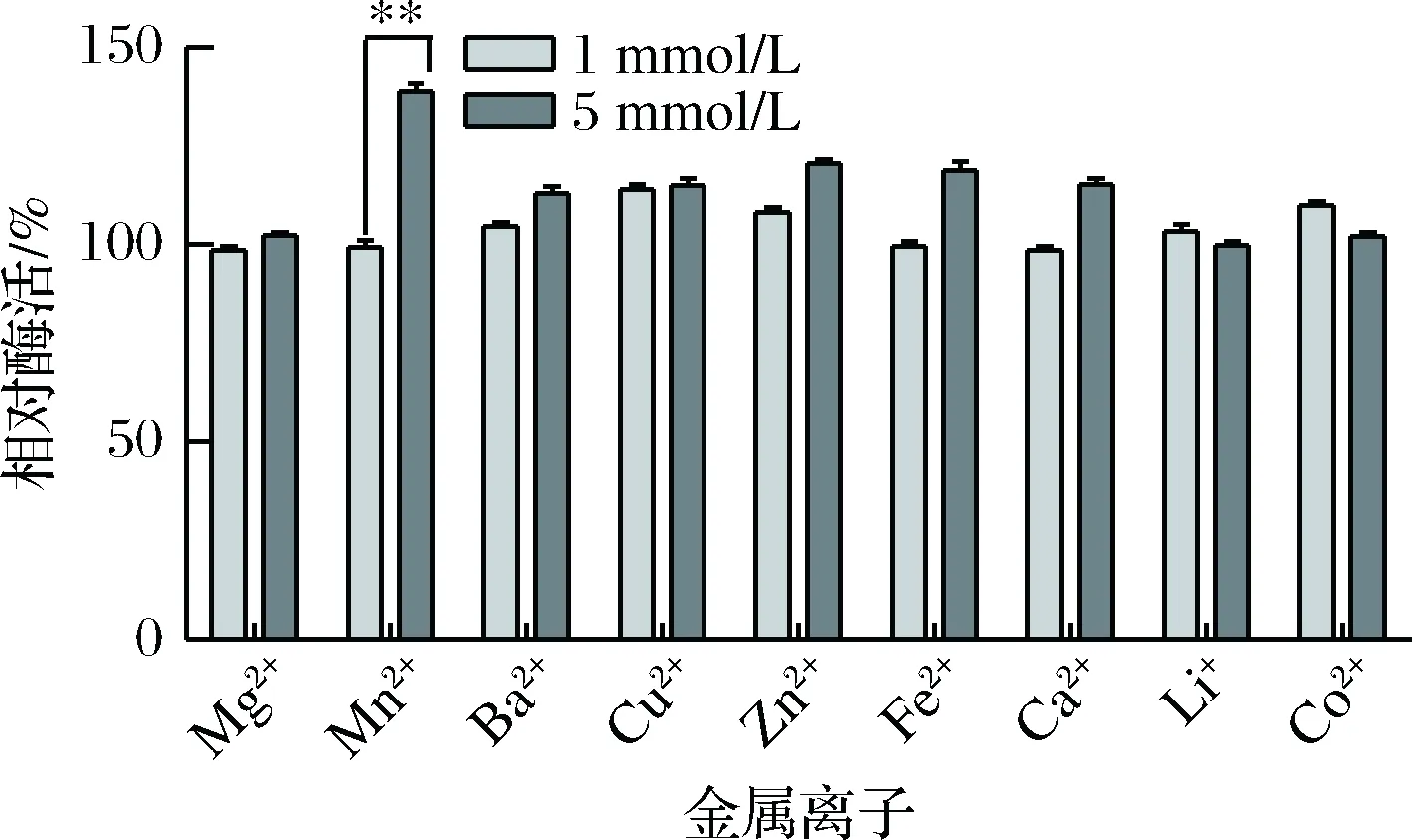
图5 金属离子对蛋白酶粗酶活的影响Fig.5 Effects of different metal-ion on stability of the protease* 代表差异的显著性
2.4.4 蛋白抑制剂对碱性蛋白酶活性影响
将粗酶液与不同的蛋白抑制剂混合,达到相应的终浓度后,测定酶活性,得到的相对酶活如图6。可以看出,EDTANa2和β-巯基乙醇(β-ME)对该蛋白酶的活性基本无影响;SDS是一种阴离子表面活性剂,1 mmol/L的SDS对该蛋白酶有一定的促进作用,当浓度是10 mmol/L时,酶活有所降低,但酶活仍在90%以上;当Tween 60浓度是1 mmol/L时,对蛋白酶活性基本无影响,而浓度是10 mmol/L时,酶活只有15%左右,对该蛋白酶酶活有明显的抑制作用(p<0.01);Triton X-100和PMSF对该蛋白酶的影响较大,在浓度是1 mmol/L和10 mmol/L时,相对酶活都下降很多。
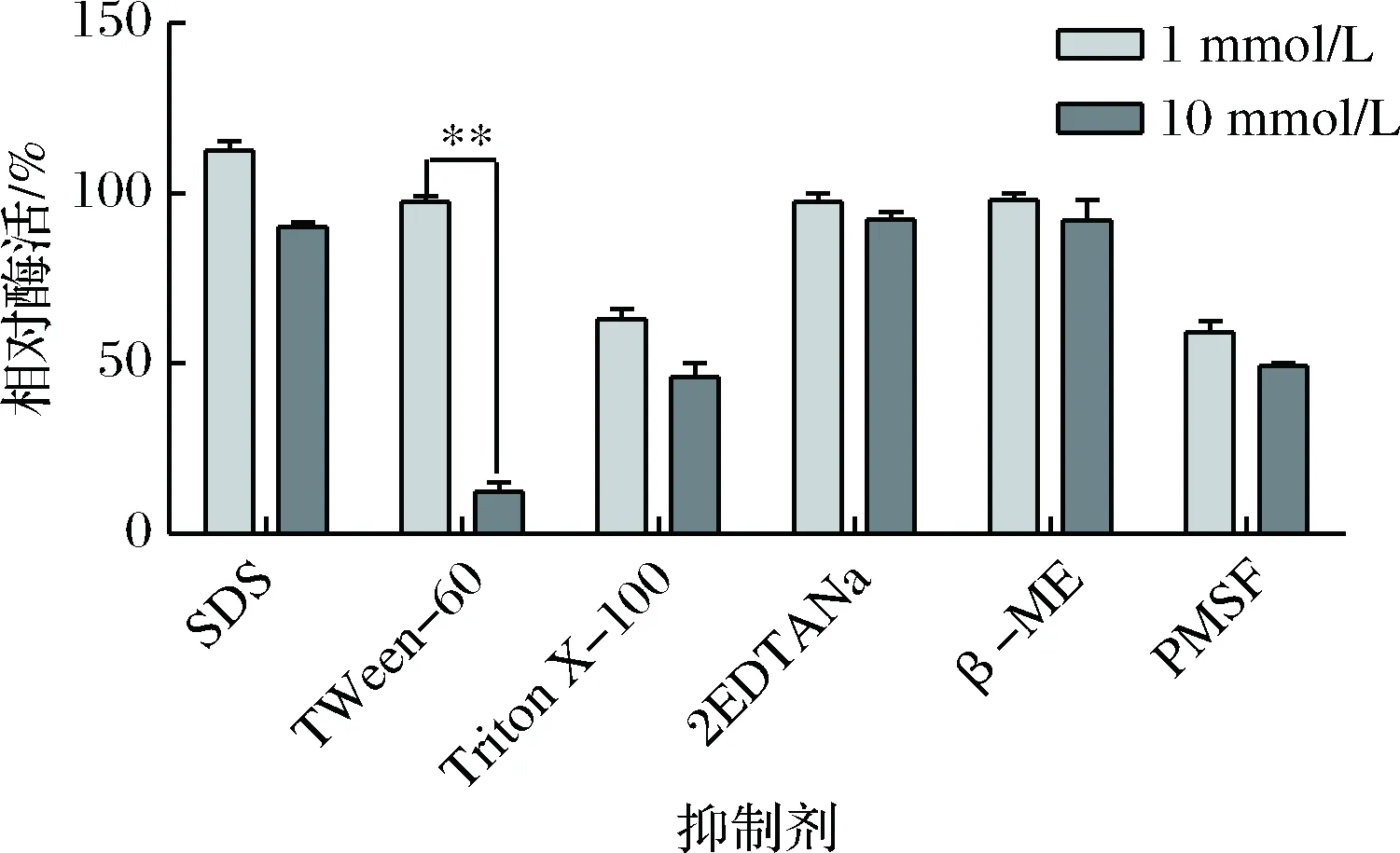
图6 蛋白抑制剂对蛋白酶粗酶活的影响Fig.6 Effects of chemical reagent on the protease activity* 代表差异的显著性
2.5 重组蛋白酶工程菌对豆粕中蛋白和抗营养因子的降解研究
酿酒酵母工程菌株对豆粕进行固态诱导发酵48 h后,分别测定发酵前后豆粕样品中的粗蛋白、酸溶蛋白和抗营养因子的含量变化。工程菌株在固态发酵后,对豆粕中粗蛋白的增加无明显效果,却可以显著增加酸溶蛋白的含量(图7-a,p<0.01),与出发菌株相比增加42.1%;在消除抗营养因子方面,工程菌株去除β-伴大豆球蛋白的效果与出发菌株无显著差异;而降解大豆球蛋白(图7-b,p<0.05)和胰蛋白酶抑制因子与出发菌株存在显著性差异(图7-c,p<0.05),降解能力分别比出发菌株提高41.9%和57.4%。
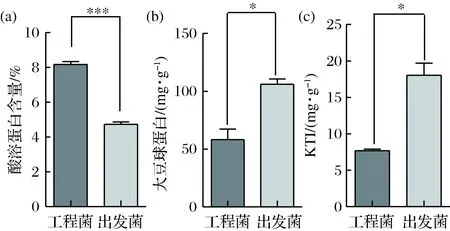
图7 工程菌对豆粕中蛋白和抗营养因子的降解Fig.7 Degradation of proteins and anti-nutritional factors in soybean meal by engineering bacteria*代表差异的显著性
3 讨论
本文克隆了枯草芽孢杆菌来源的重组碱性蛋白酶基因并在酿酒酵母中成功诱导表达,对其酶学性质和豆粕中蛋白类抗营养因子的降解效果进行了研究。酿酒酵母的蛋白酶酶活很低,对豆粕中的大豆蛋白几乎没有分解能力。在本实验中,酿酒酵母工程菌与酿酒酵母出发菌株相比,碱性蛋白酶酶活提高55.2%,分解大豆球蛋白和胰蛋白酶抑制因子能力分别提高41.9%和57.4%,分解大豆蛋白形成酸溶蛋白能力提高42.1%,这表明酿酒酵母工程菌在一定程度上可以解决大豆蛋白致敏作用强和利用率低的问题。并且获得的碱性蛋白酶直接分泌到发酵液中,利于该酶的分离纯化和工程菌发酵处理饲料蛋白原料。该酶具有较宽泛的pH稳定性和较高的热稳定性,能较好的适应发酵生产过程中的pH和温度变化。以上结果显示该重组碱性蛋白酶在饲料、食品生产中有较大的应用潜力。

