荚膜红细菌来源的酪氨酸酚裂解酶的酶学性质
张宇,周景文,堵国成,陈坚,2*
1 (江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122) 2 (江南大学,粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122)
L-酪氨酸(L-tyrosine,L-Tyr)是一种重要的芳香族氨基酸,常作为营养补充剂[1]、饮料添加剂和配制人工昆虫饲料等。此外,酪氨酸也是合成多肽类激素、抗生素、L-多巴等药物的主要原料[2-4],是合成对香豆酸、柚皮素等高价值化合物的重要前体[5],被广泛应用于食品、化工、饲料和医药等工业领域。目前,国内外报道的L-酪氨酸制备方法主要有提取法、直接发酵法、有机合成法和酶转化法[6-8]。提取法由于污染严重、生产成本高,已经被逐渐取代。直接发酵法通过代谢工程改造微生物发酵生产L-酪氨酸,由于目前产量和转化率还较低,未能实现工业应用。化学合成法主要通过L-苯丙氨酸的羟基化或经由对羟苯甲醛与海因缩合、碱解、转氨、拆分等步骤进行,耗能高、污染严重,也已经被逐步淘汰[9-10]。目前,采用酶法合成L-酪氨酸是最为成熟的技术路线[11]。
酪氨酸酚裂解酶(tyrosine phenol-lyase, TPL,EC 4.1.99.2 )是合成L-酪氨酸、L-多巴的关键酶。该酶参与多种催化反应,需要5-磷酸-吡哆醛(pyridoxal-5′-phosphate,PLP)作为辅因子[12]。在生物体内可催化L-酪氨酸裂解生成苯酚、丙酮酸和氨,该反应在一定条件下是可逆的。TPL催化前体铵、丙酮酸和酚类底物转化合成L-酪氨酸/L-多巴的过程是α和β消除反应的逆过程[13]。酶转化具有转化效率高、专一性强、分离纯化容易等优点[14]。本文采用丙酮酸路线经TPL一步法催化合成L-酪氨酸[15-16]。为了获得1株具有高效生产L-酪氨酸性能并且稳定催化性能的TPL菌株,本研究基于pET-28a表达质粒,将源于荚膜红细菌(Rhodobactercapsulatus)的TPL在大肠杆菌(Escherichiacoli) BL21(DE3)中进行表达,并对TPL进行纯化及酶学性质的分析[17]。研究结果为后期理性改造TPL性能,提高酶法合成L-酪氨酸的效率,并最终实现工业生产提供重要参考。
1 材料与方法
1.1 实验材料
1.1.1 菌种
大肠杆菌宿主菌株JM109、BL21(DE3)、质粒pET-28a(+)为本研究室保藏;来源于R.capsulatus的TPL基因根据大肠杆菌对密码子的偏好性进行优化,由南京金斯瑞生物科技有限公司合成后,连接至pET-28a(+),构建得到表达载体pET28a-ScTPL。
1.1.2 主要试剂
Mix DNA聚合酶,杭州宝赛生物科技有限公司;限制性内切酶、琼脂糖凝胶DNA回收试剂盒,Thermo Scientific公司;细菌质粒小量抽提试剂盒、感受态细胞制备试剂盒,上海生工生物有限公司;标准分子量蛋白、蛋白上样缓冲液、SDS-PAGE预制胶,Life Technologies公司;BCA试剂盒,碧云天。丙三醇、α-乳糖、丙酮酸钠、乙酸钠、苯酚、NaCl、NH4Cl、K2HPO4、KH2PO4:分析纯,上海国药集团。
1.1.3 培养基
LB培养基:酵母提取物5 g/L、蛋白胨10 g/L、NaCl 10 g/L;固体培养基添加琼脂条20 g/L,121 ℃灭菌15 min。
TB培养基: 酵母提取物24 g/L、蛋白胨12 g/L、甘油4 mL/L、KH2PO42.3 g/L、K2HPO416.4 g/L;121 ℃灭菌15 min。
Binding Buffer:50 mmol/L KH2PO4,50 mmol/L K2HPO4,调pH至 7.3。
Wash Buffer:50 mmol/L KH2PO4,50 mmol/L K2HPO4,150 mmol/L NaCl,调至pH 7.3。
Elution Buffer:50 mmol/L KH2PO4,50 mmol/L K2HPO4,150 mmol/L NaCl,500 mmol/L咪唑,用磷酸调pH至7.3。
1.2 实验方法
1.2.1 载体构建
根据NCBI中R.capsulatus来源的酪氨酸酚裂解酶基因TPL (NCBI登录号为AF022932.1)的基因序列,由南京金斯瑞生物科技有限公司合成,经密码子优化后,连入表达载体pET-28a(+),构建表达载体,酶切位点为BamH I、Hind III。
1.2.2 TPL诱导表达以及表达条件优化
从LB固体平板上挑取大肠杆菌BL21(DE3)重组菌单菌落转接于LB液体培养基中(终质量浓度为50 μg/mL的卡那霉素),37 ℃,220 r/min条件下培养10 h,以1%的接种量转接至TB培养基,于37 ℃、220 r/min条件下培养2.5 h至菌体OD600达到0.6~0.8时,向培养基中添加终浓度为0.25 mmol/L的IPTG于25 ℃下进行诱导。
基于蛋白表达后,分别对诱导OD600、诱导温度进行优化,于25 ℃下在OD600分别为0.5、1.0、1.5、2.0、3.5时诱导,在基于最佳诱导OD600下分别于25、30、37 ℃下诱导。由于IPTG浓度会对菌体生长有害,且价格昂贵,而乳糖作为一种二糖,没有毒性,且价廉易得,因而采用乳糖代替IPTG,优化不同乳糖质量浓度0.1、1、5、10、20 g/L,确定最佳诱导表达条件。
1.2.3 粗酶液的制备以及TPL的分离纯化
取发酵液于4 ℃、2 599g离心10 min收集菌体,将收集的菌体用Binding Buffer缓冲液洗涤2次,重悬至菌体浓度OD600为20,冰上放置超声破碎30 min后,4 ℃、6 654g离心30 min去除细胞碎片,微孔滤膜(0.45 μm)过滤除去杂质,得到粗酶液。
粗酶液利用AKTA蛋白纯化系统及5 mL Ni柱(His TrapTMFF,GE)进行蛋白质纯化[18],取纯化后的洗脱液在缓冲液(50 mmol/L磷酸盐缓冲液)中过夜透析,经透析后获得用于酶催化反应的酶液。柱纯化条件:以A液(Wash Buffer)平衡柱子3~5个柱体积后上样,进样结束以3~5个柱体积A液继续平衡柱子,接着以5%的B液(Elution Buffer)洗去杂蛋白,5%~100%线性洗脱10个柱体积,收集洗脱蛋白。对收集的各段洗脱液进行SDS-PAGE分析。最后用超纯水冲洗5个柱体积后,再用20%乙醇冲洗3个柱体积,卸下柱子保存。蛋白纯化过程中流速均为1 mL/min。
1.2.4 蛋白浓度测定及酶活测定
蛋白浓度的测定:采用碧云天BCA试剂盒检测方法进行,取适度稀释的待测样品加入96孔板,再加入200 μL显色液,37 ℃静置30 min后用酶标仪测定562 nm处吸光值,根据标准曲线确定待测样品的蛋白浓度。
酶活的测定[19]:反应体系为2 mL,反应体系:75 mmol/L丙酮酸钠,55 mmol/L苯酚,37.5 mmol/L氯化铵,于pH 9.0的铵盐(150 mmol/L氯化铵、氨水)缓冲液中30 ℃,220 r/min酶催化反应30 min,浓盐酸终止酶促反应,高效液相色谱检测反应液中L-酪氨酸的含量。酶活定义为每分钟内催化生成1 μmol/LL-酪氨酸所需要的酶量为1个酶活单位(U/mL)。
1.2.5 酶学性质分析
用纯化后的蛋白测定最适反应pH值、最适反应温度。于30 ℃条件下进行酶活测定,分别测定TPL于pH 6.0~10.0缓冲液环境中的酶活力,从而测定出TPL的最适反应pH。以测得的最高酶活设为100%,相对酶活计算方法为:其他pH下的酶活/最高酶活[100%;以pH 9.0的PBS作为酶活反应的缓冲液,分别测定于20~60 ℃反应温度下的酶活,从而测定出TPL的最适反应温度,以测得的最高酶活设为100%,相对酶活/%=(其他温度下的酶活/最高酶活×100]。
对纯化后的蛋白进行温度稳定性、pH稳定性、苯酚耐受性的测定。将酶分别在30~60 ℃(间隔5 ℃)条件下孵育0~180 min,每隔20 min取样检测,测定残余酶活;将酶加到pH 6.0~10.0的缓冲液中,40 ℃处理0~120 min,每隔30 min取样检测,测定残余酶活。酶分别在20~100 mmol/L不同底物苯酚浓度下反应,测定残余酶活。
1.2.6 TPL体外全细胞催化反应
于1.2.2确定的最优条件下进行诱导表达,诱导后于4 ℃、2 599g离心10 min收集菌体用于体外全细胞催化反应,控制菌体浓度为OD600为20。
以丙酮酸钠、苯酚、氯化铵为底物,进行体外全细胞催化生成酪氨酸的能力进行测定[20]。全细胞转化反应体系:650 mmol/L氯化铵,50 mmol/L丙酮酸钠,50 mmol/L苯酚,于37 ℃,220 r/min条件下进行全细胞催化反应30 min,酶活定义为上述条件下每分钟内催化生成1 μmol/L酪氨酸所需要的细胞量为1个酶活单位(U/g)。
1.2.7 HPLC检测条件
高效液相色谱仪Agilent 1260,检测器为紫外检测器,色谱柱:Agilent C18(250 mm×4.6 mm,5 μm),流动相A液为100 mmol/L 醋酸钠(pH 4.0±0.05),B液为甲醇,分流比为90∶10;流速为0.6 mL/min,柱温为30 ℃,进样量为10 μL[21]。
1.2.8 LC-MS鉴定条件
色谱条件 色谱柱:Shim-pack VP-ODS柱(2.0 mm×250);检测波长:280 nm;柱温:40 ℃;进样量10 μL;流速:0.5 mL/min;流动相:0.1%甲酸∶甲醇(9∶1)。
质谱条件 ESI 离子源,正离子模式喷雾电压4.5 kV,负离子模式喷雾电压-3.5 kV;一级、二级离子扫描范围m/z20~2 000;加热模块(BH)和曲形脱溶剂管(CDL)温度均为200 ℃;载气(氖气)流速1.5 L/min,离子累计时间10 ms;检测器电压1.6 kV;IT真空2.6×10-2Pa,TOF真空2.2×10-4Pa。
2 结果与分析
2.1 表达载体的构建
来源于R.capsulatus的TPL基因经密码子优化,由南京金斯瑞生物科技有限公司合成,分别以限制性内切酶BamH I、Hind III双酶切后,与pET-28a(+)连接转化至大肠杆菌BL21(DE3)中,得到重组表达质粒pET28a-RcTPL。提质粒后分别以限制性内切酶BamHI、HindIII双酶切验证,核酸电泳得到大小为5 400 bp和1 400 bp左右的条带,分别与pET-28a和TPL大小一致(图1)。
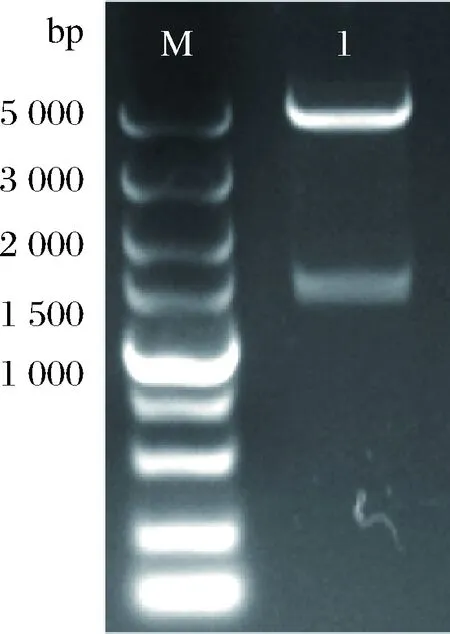
M-DL5000 DNA marker; 1-BamH I和Hind III酶切重组质粒pET28a-RcTPL图1 表达载体酶切验证琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of expression vectors
2.2 诱导表达优化及纯化
2.2.1 TPL诱导表达以及表达条件优化
SDS-PAGE分析TPL在E.coli中的表达情况,如图2所示,对全细胞分析可见大小约为52 kDa的蛋白条带与TPL理论值相符,表明TPL基因在E.coli中成功得到表达。
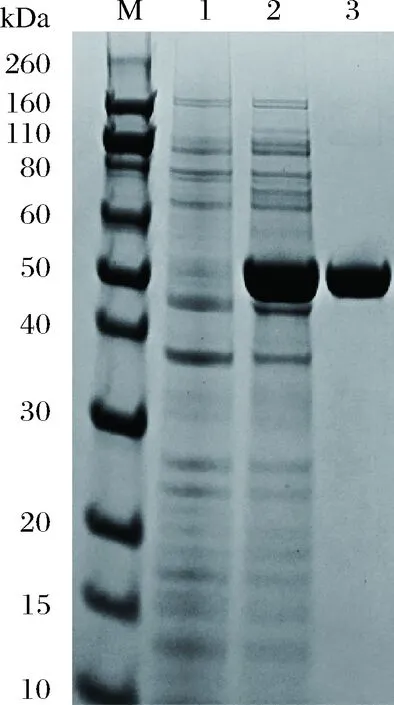
M-标准蛋白Marker; 1-E. coli BL21(DE3)/pET28a;2- E. coli BL21(DE3)/ pET28a-ScTPL蛋白表达;3-pET28a-ScTPL纯化酪氨酸苯酚裂解酶图2 目的基因在E. coli BL21中的表达情况Fig.2 Expression of the tyrosine phenol lyase gene in E. coli BL21
对TPL蛋白诱导OD600、诱导剂浓度、诱导温度优化后进行分析,结果如图3。当OD600在1.0时,酶活最高。37 ℃诱导表达时,酶活明显降低,25 ℃诱导明显优于30、37 ℃诱导。因此选择25 ℃为最佳诱导温度。乳糖诱导质量浓度在1 g/L时酶活最高,不需要较高的乳糖浓度即可达到较好的诱导效果。因此选取最优诱导浓度OD600为1.0,乳糖诱导质量浓度1 g/L,诱导温度25 ℃。
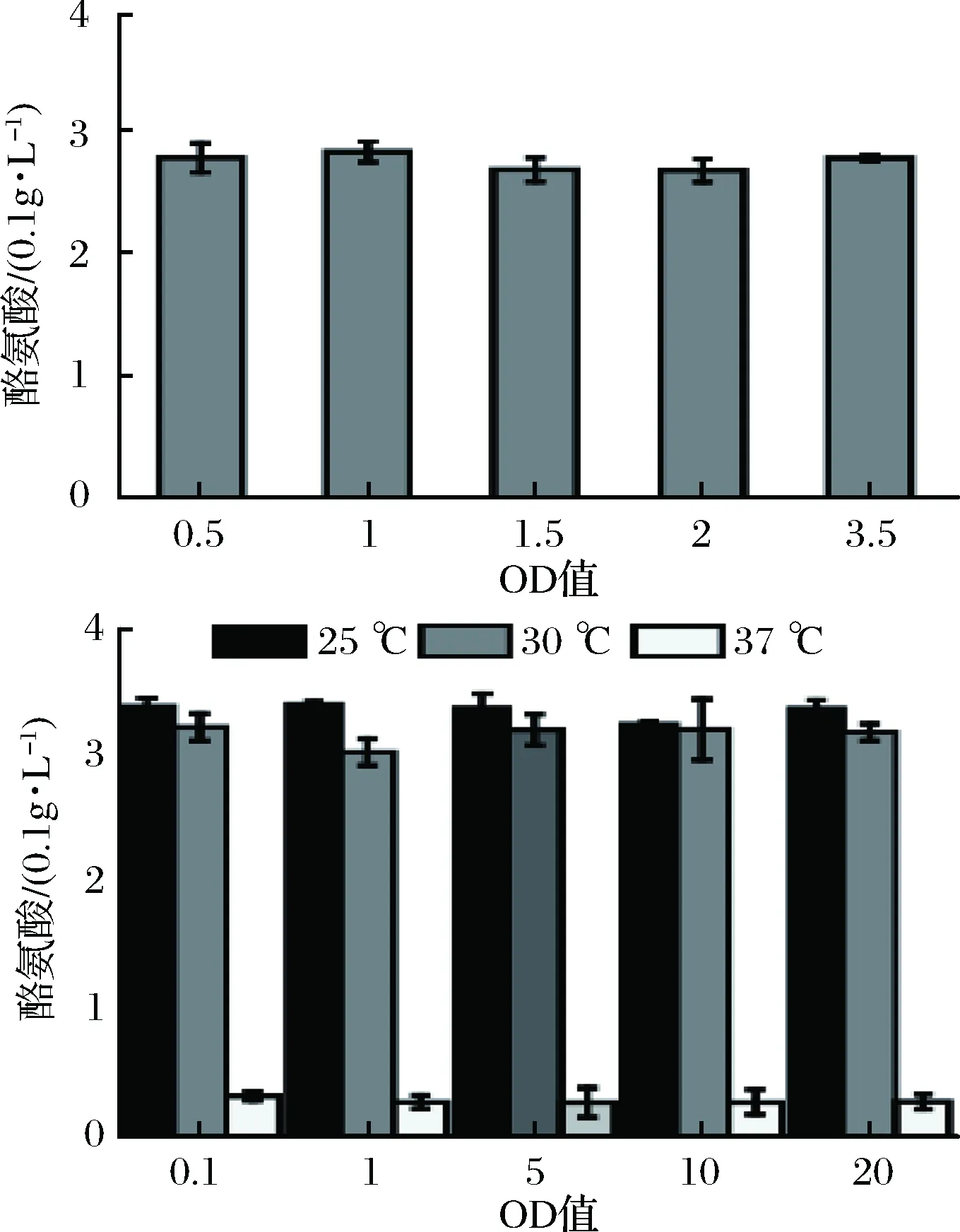
A-TPL表达诱导时间的优化;B-TPL表达诱导温度和诱导浓度的优化图3 诱导OD600、诱导浓度、诱导温度优化TPL表达Fig.3 Optimization of induced time for TPL expression
2.2.2 TPL的纯化
取按照1.2.2处理后的粗酶液利用Ni-NTA亲和层析柱进行分离纯化。在线性洗脱条件下,TPL在28%~45%缓冲液中被洗脱,在确定了洗脱浓度范围的基础上,再进一步以20%、40%、60%、100%洗脱液进行梯度洗脱。在40%洗脱液下可以获得单一的TPL蛋白,再经50 mmol/L磷酸盐缓冲液(K2HPO4、KH2PO4)过夜透析,得到单一的目的蛋白,SDS-PAGE分析可见大小约为52 kDa的蛋白条带与TPL的理论值相符(图2)。
2.3 TPL的酶学性质分析
2.3.1 TPL最适温度、pH的测定
分别对不同pH(6.0~10.0)和温度(20~60 ℃)条件下酶活性进行检测分析,结果如图4所示。pET28a-ScTPL最适反应温度为40 ℃,最适反应pH为8.5。低于最适温度40 ℃时,随着温度升高,TPL酶活力提高,高于最适温度时,随着温度升高TPL活力下降。ScTPL在pH6.0~8.0,pH9.0~10.0相对酶活都很低,易受酸碱性影响。
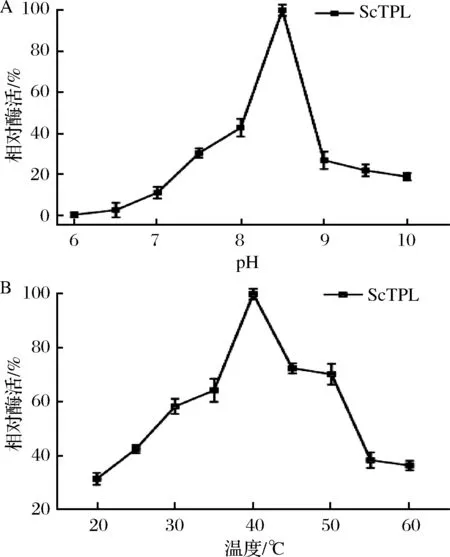
图4 温度及pH对酪氨酸酚裂解酶活性的影响Fig.4 Effects of temperature and pH on enzyme activity
2.3.2 TPL温度稳定性、pH稳定性分析
为了获得最理想的催化性能,减少酶在催化过程酶活性的损失,考察了酶在催化过程中酶活受温度和pH的影响,对TPL的温度稳定性和pH稳定性进行了分析。结果如图5所示。
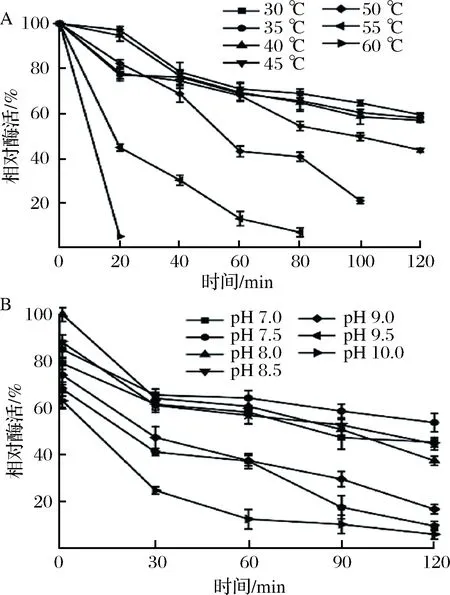
图5 温度及pH稳定性对酪氨酸酚裂解酶活性的影响Fig.5 Effects of thermostability and pH stability on enzyme activity
该酶在低于40 ℃条件下处理120 min仍有大于60%的残存活力,60 ℃条件下处理20 min剩余小于10%的残余活力。在50、55 ℃条件下处理100 min残余活力逐渐降低;该酶在pH 7.0~8.5处理120 min仍有大于40%活力,pH 9.0~10.0处理120 min残余活力逐渐降低至失活。结果表明ScTPL在低温、弱碱条件下更稳定。
2.3.3 TPL苯酚耐受性的测定
苯酚是催化合成L-酪氨酸的关键底物,对TPL有较大的毒副作用,过高的浓度能抑制TPL的活性,为了分析TPL对苯酚的耐受性,研究了在不同苯酚浓度下酶活损失情况(结果如图6)。随着底物苯酚浓度的增加,残余活力逐渐降低,ScTPL耐苯酚的性能逐渐降低,在苯酚浓度为80 mmol/L时,酶活损失最大。结果表明在较低底物苯酚浓度下酶的催化性能更稳定,这为后期进行分子改造提高苯酚耐受性以及通过补料降低底物抑制提供参考意义。
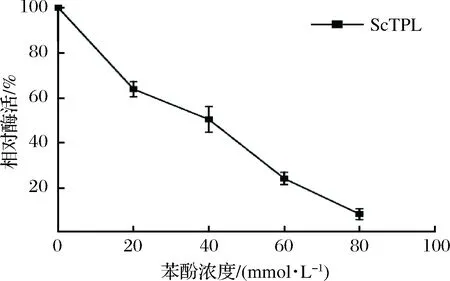
图6 苯酚浓度对酪氨酸酚裂解酶活性的影响Fig.6 Effects of phenol concentration on enzyme activity
2.4 TPL酶活、体外催化特性的测定分析
按照1.2.4方法测定TPL酶活,最终测得ScTPL酶活为0.29 U/mL,比酶活分别为0.29 U/mg。检测ScTPL全细胞催化的酶活为0.41 U/g,反应10 h产量为0.30 g/L。对TPL催化合成L-酪氨酸进行LC-MS验证,结果如图7所示,一级、二级质谱扫描的m/z与L-酪氨酸标品相对分子质量一致,所检测产物为L-酪氨酸。
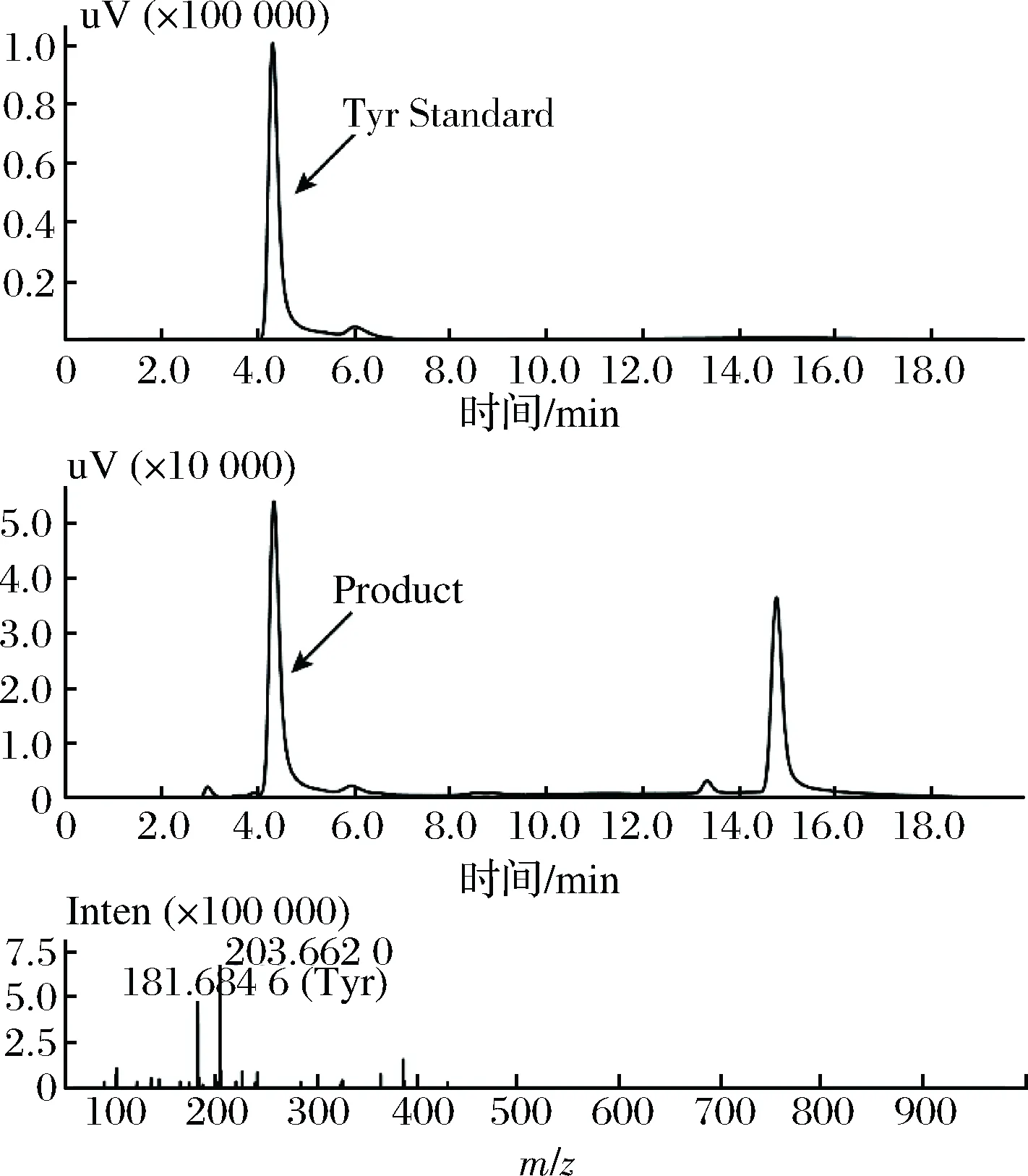
图7 TPL催化合成L-酪氨酸的LCMS验证Fig.7 Analysis of L-tyrosine production with TPL by LCMS
3 结论
利用酶法合成氨基酸是近年来氨基酸工业的研究热点之一。国外主要研究L-酪氨酸通过TPL水解生成铵、丙酮酸和酚类物质的α和β消除反应过程[22-23]。TPL能催化多个重要反应,但对其正向催化生产酪氨酸性能性质的研究报道较少。国内主要通过对来源于弗氏柠檬酸杆菌的酪氨酸酚裂解酶基因构建重组表达载体合成L-酪氨酸[24],其他来源的酪氨酸酚裂解酶基因的研究鲜有报道。为了提高L-酪氨酸的产量,本研究选取R.capsulatus来源的酪氨酸酚裂解酶,基于pET-28a表达质粒成功异源表达于大肠杆菌中,通过His TrapTMFF柱纯化得到了纯度较高的TPL,测得TPL的酶活为0.29 U/mL,比酶活分别为0.29 U/mg,最适反应温度为40 ℃,最适反应pH为8.5左右,且经过HPLC验证可催化得到L-酪氨酸。之前研究中弗氏柠檬酸杆菌来源的TPL(CfTPL)水解催化反应的最适温度为45 ℃,最适pH为8.5。这两个TPL有着相近的最适反应温度、pH以及pH稳定性[25]。研究结果表明,本文中的ScTPL于45 ℃下处理60 min后残存酶活仍大于60%,而CfTPL残存酶活小于20%。因此,ScTPL温度稳定性显著优于CfTPL,在实际应用中具有一定的优势。此外,本文在对ScTPL正向催化合成酪氨酸反应性质的研究基础上,对ScTPL的活性和稳定性方面进行了研究,为后续采用定向进化或理性改造提高TPL的温度稳定性和底物耐受性提供了重要参考。

