活性干酵母活化时间与级数对葡萄酒发酵的影响
刘嘉璐,孙玉梅*,黄 超,唐文竹
(大连工业大学 生物工程学院,辽宁 大连 116034)
在葡萄酒的酿造过程中,酿酒酵母主导着整个生物转化过程。葡萄汁中的糖分通过酿酒酵母的代谢作用,转化成酒精、有机酸以及各种风味物质[1]。
在工业生产中,为了避免扩大培养酵母,通常采用活性干酵母。由于活性干酵母细胞内含水量低(<6%)[2],需要活化后使用[3]。选择合适的酿酒酵母酵母活化条件,可以有效提高酿酒酵母的活性[4-5]。干酵母于36~40℃无菌水中活化15 min,即可接种到发酵罐中[6]。也可以将活性干酵母在20倍(质量比)含糖5%的温水(35~40℃)中分散均匀,活化20~30 min[7]。王传荣[8]研究的安琪耐高温酒精活性干酵母(temperature tolerant Angel active dry yeast,TH-AADY)复水温度为35~40℃,时间为10~15 min,活化温度为35℃,活化时间为60 min。SCHMIDT S A等[9]把活性干酵母在35~43℃复水活化15 min,即可以使细胞的活力恢复到最佳的状态。KONTKANE D等[10]将活性干酵母进行3 h 15 min的糖度(10°Bx、20°Bx)和温度(40℃、25℃、20℃)梯度驯化,接种发酵后的酵母生物量、耗糖、产酒精明显高于不驯化直接接种方式。酵母的不同活化方式可以有效避免由于酵母的大量失活而导致起酵缓慢、发酵停滞等问题。为了加快葡萄汁酒精发酵的启动,或者葡萄汁存在发酵不彻底的危险,可以在24 h前制备母液[7]。对于不同的酵母种类、发酵温度,通用的活化方式不一定可以有效提高酵母活性,而同一活化时间不同的活化级数也可能对酵母活性与葡萄酒发酵有影响。
本研究通过检测发酵过程中酵母的活细胞浓度和总菌体浓度、二氧化碳生成量和耗糖量以及乙醇和乙酸产量,探究用于葡萄酒酿造的活性干酵母LV的活化时间和活化级数对葡萄酒发酵的影响,以期活性干酵母在葡萄酒发酵过程中有较好的生长和代谢状态,控制其活化条件对其活性的提高和葡萄酒发酵有重要的意义。
1 材料与方法
1.1 材料与试剂
活性干酵母LV:辽宁本溪桓仁五女山米兰酒业有限公司;24°Bx普通葡萄模拟汁:根据葡萄的成分组成[11]以及参考文献[12-15]配制。
葡萄糖、果糖:山东西王药业有限公司;酵母浸粉:北京奥博星生物试剂有限公司;多种氨基酸(色氨酸、苏氨酸、缬氨酸、赖氨酸、丝氨酸、精氨酸、丙氨酸、脯氨酸):上海阿拉丁生化科技有限公司。乙醇(分析纯):国药集团化学试剂有限公司;乙酸(分析纯):天津市恒兴化学试剂有限公司。
1.2 仪器与设备
PHS-3C型精密pH计、722S型分光光度计:上海精密科学仪器有限公司;HITACHI CR21 GⅢ离心机:日本日立工机株式会社;ZHJH-C2109B超净工作台:上海智城分析仪器制造有限公司;GC8900气相色谱仪:山东经纬分析仪器有限公司;FFAP色谱柱(30 m×0.32 mm×0.5 μm):大连三杰科技发展有限公司;N2000色谱工作站:浙江大学智达信息工程有限公司;SPME 57330-U萃取手柄、SPME 65 μm PDMS/DVB萃取纤维头:美国SUPELCO有限公司。
1.3 方法
1.3.1 酿酒酵母的活化
本研究对LV活性干酵母进行(25 min、3 h 15 min和24 h 15 min)三种活化时间,其中3 h 15 min活化分为两级和三级并同时采用不同糖度的活化,详见表1。活化后接种到24°Bx葡萄模拟汁中,于24℃控温发酵。
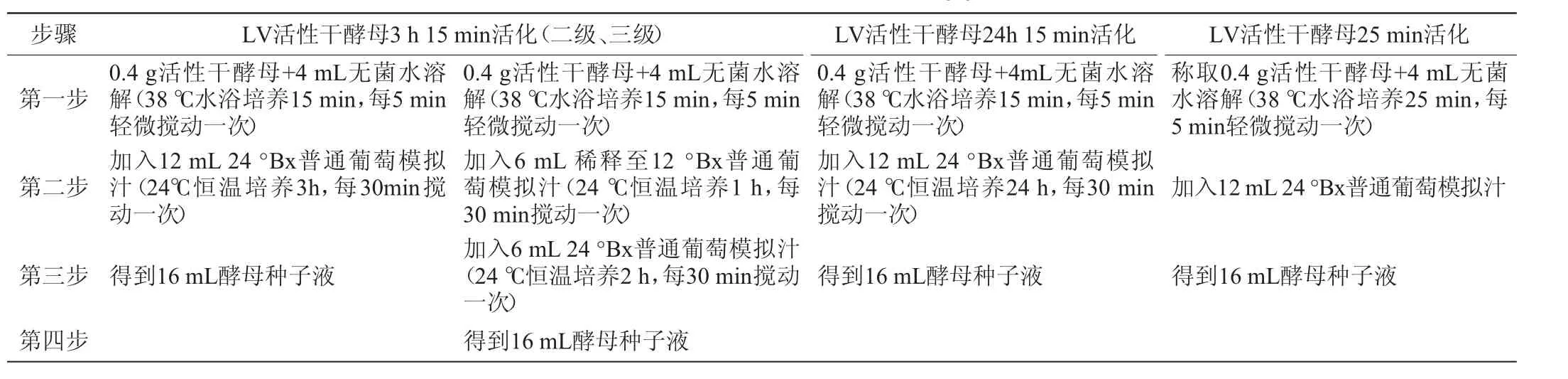
表1 LV活性干酵母的活化方式Table 1 Activation methods of LV active dry yeast
1.3.2 葡萄酒酿造工艺流程
配制模拟葡萄汁→分装模拟葡萄汁(500 mL/瓶)→接种酵母菌种子液→24℃控温发酵→终止发酵
操作要点:无机盐、维生素和氨基酸分别制成母液备用,再与其他试剂混合均匀后配制模拟葡萄汁分装使用(为了保持实验的一致性,因此自行配制模拟葡萄汁而不采用天然葡萄汁)。发酵体系为1 L三角瓶,每个三角瓶分别装入500 mL普通葡萄模拟汁。活性干酵母接种量为0.25 g/L,经不同方式活化(酵母浓度为2.8×109个/mL)后接种16 mL到500 mL葡萄汁中进行24℃控温发酵。发酵前2 d用棉塞封瓶口。当发酵液中有气体产生时,把棉塞换为发酵栓,每个发酵栓中加灭菌水8 mL,开始厌氧发酵。在发酵液中的还原糖量降至不变时,终止发酵。发酵初期为第0~4天,发酵中期为第5~10天,发酵后期为第11~18天。
模拟葡萄汁参考普通葡萄汁的化合物含量,无机盐、维生素与氨基酸分别制成母液备用(见表2)。每种活化分别设置2个平行。
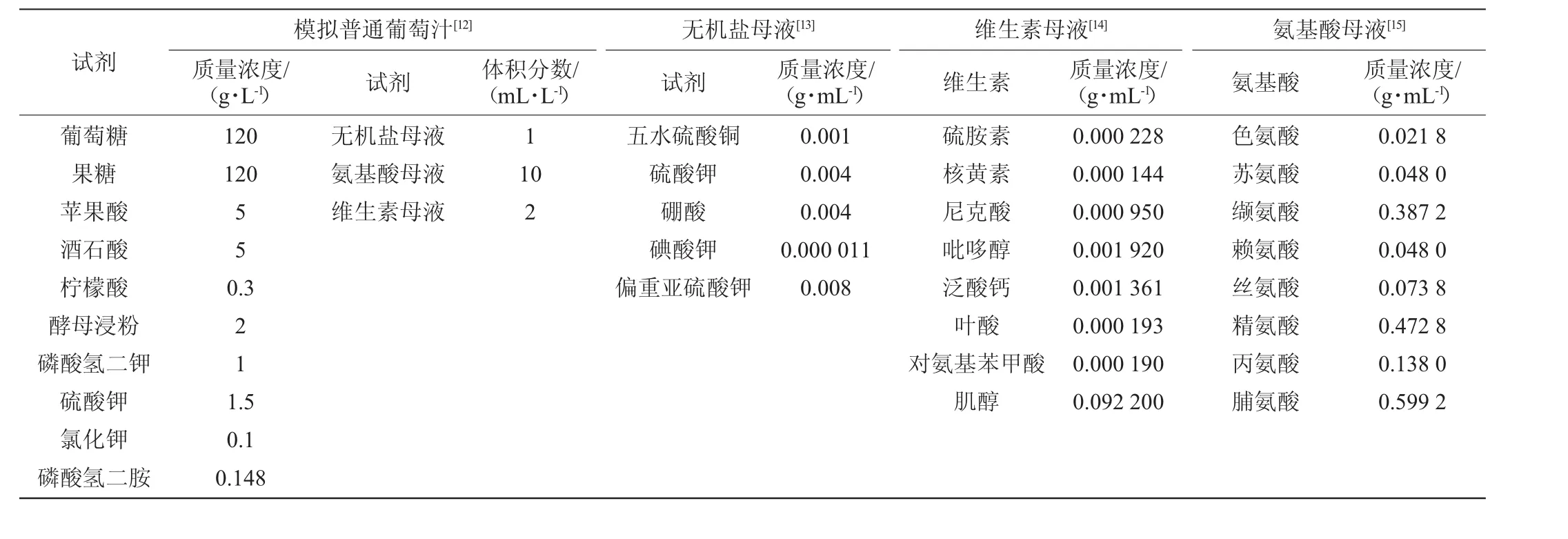
表2 模拟普通葡萄汁的配方[11]Table 2 Formula of normal synthetic grape juice
1.3.3 样品的取样及处理
发酵过程中,活酵母菌浓度与总菌体浓度在第0、1、2、4、7、11、14、18天取样(3 mL)测定;CO2生成量每天测定;还原糖含量在第1、2、4、7、11、18天取样(1 mL)测定;乙醇和乙酸含量在第0、2、4、7、13、18天取样(21 mL)测定,样品保存于-20℃冰箱中。
测定各理化指标前,于4℃冰箱中解冻。其中还原糖、乙醇和乙酸的样品需要离心(10 000 r/min、4℃、10 min)得发酵上清液。
1.3.4 活酵母菌浓度测定
发酵液样品用吕氏碱性美蓝染色,在显微镜下计活酵母菌数(活酵母不被染色,死亡的酵母被染成蓝色)[16]。
1.3.5 菌体密度的检测
适量稀释样品后,分光光度计在波长600 nm处检测吸光度值OD600nm。
1.3.6 还原糖含量测定
采用 3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法测定还原糖含量[17]。
1.3.7 CO2生成量测定
发酵开始后,每天固定时间称取发酵瓶的质量。从培养箱取出的发酵瓶放入摇床,于100 r/min摇动5 min。待气泡消失后,用电子天平测量发酵瓶质量。通过前后两次称质量的差值来反映CO2生成量。如需取出发酵液样品,需要测量取样前后发酵瓶的质量[18]。
1.3.8 乙醇和乙酸的测定
采用顶空-固相微萃取-气相色谱法(headspace solid phase microextraction-gas chromatography,HS-SPME-GC)检测样品中乙醇和乙酸的含量。
固相微萃取条件:向20 mL顶空瓶中加入7 mL样品,1.4 g NaCl和磁力搅拌转子,加盖密封。49℃水浴加热,搅拌速率250 r/min,平衡时间10 min,然后插入萃取纤维头(65 μm PDMS/DVB、SUPELCO),萃取时间为45 min。萃取完成后,将纤维头插入气相色谱汽化室,解吸5 min。
气相色谱条件:FFAP毛细管色谱柱(30 m×0.32 mm×0.5 μm);汽化室温度250℃,火焰离子检测器(flame ionization detector,FID)温度 250℃,色谱柱初始温度40℃,保持3 min,以1.5℃/min速率升温至46℃,保持2 min,以6℃/min速率升温至52℃,保持3 min,以5℃/min速率升温至190℃,保持2 min;空气流量300 mL/min,氢气流量30mL/min,载气为氮气(N2),流量 30mL/min,分流比10∶1。
2 结果与分析
2.1 活化时间对葡萄酒发酵的影响
2.1.1 活化时间对发酵过程中活酵母菌浓度与总菌体浓度的影响
不同的活化时间对发酵过程中LV干酵母活菌浓度及总菌体浓度的影响结果见图1。由图1可知,虽然3种活化时间的酵母在发酵过程中总菌体浓度没有较大差异(P>0.05),但是活酵母菌浓度差异较大(P<0.05)。在发酵初期,各种活化实验组的活酵母菌数量呈上升趋势。活化3h 15min的活酵母菌浓度高于另外两组(P<0.05),在发酵中期仍处于增长状态,最高达到4.23×107个/mL;活化24 h 15 min的活酵母菌浓度略低;活化25 min的酵母在发酵中期活酵母菌浓度最早(第10天)开始下降。
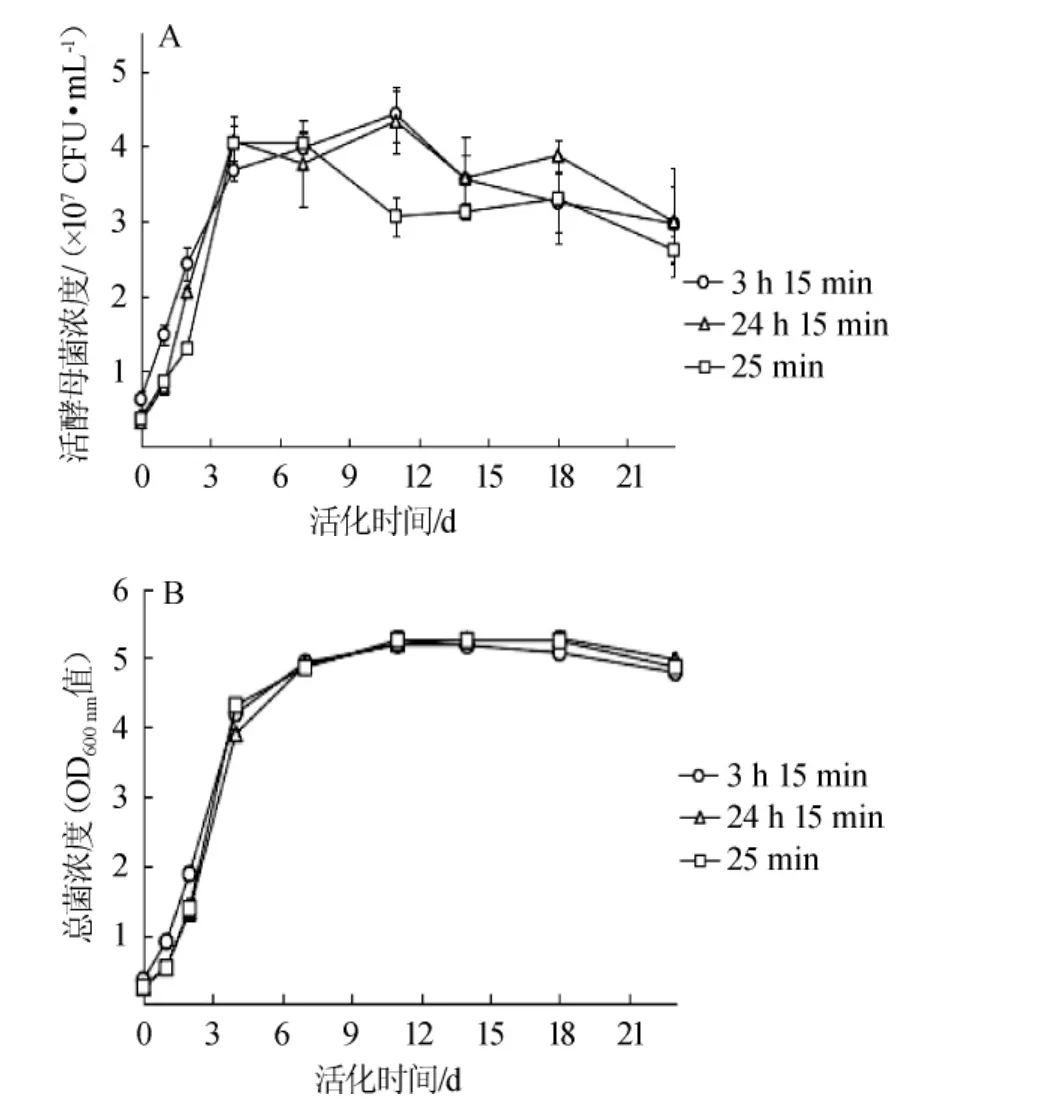
图1 不同活化时间的LV干酵母在发酵过程中活酵母菌浓度(A)及菌体总浓度(B)的变化Fig.1 Changes of viable yeast concentration(A)and total yeast concentration(B)during fermentation by LV dry yeast with different activation time
由此可见,活化3 h 15 min可以使酵母在发酵初期快速生长繁殖,拥有较高的活性。说明较长时间的活化,有利于酵母充分地适应发酵环境,并维持生长活力,表现为较长时间和较大量的细胞生长。而过长时间的活化可能会使酵母在种子液中因营养耗尽而活力下降,短时间活化不利于酵母在发酵过程中维持较长时间的生长活性。
2.1.2 活化时间对发酵过程中还原糖含量的影响
不同的活化时间对发酵过程中还原糖含量的影响结果见图2。由图2可知,在发酵初期,即发酵第2天检测的活化3h15min和24h15 min的酵母还原糖含量分别为98.95 g/L和111.26 g/L,结果表明,活化3 h 15 min的酵母发酵消耗的还原糖较多,活化24h15min的酵母其次。这与不同时间活化的酵母在发酵初期的活酵母菌浓度及总菌体浓度的差异一致。在发酵第7天检测还原糖含量根据发酵时间由短到长分别为66.06 g/L、40.93 g/L、53.17 g/L,表明活化25 min的酵母耗糖最慢。

图2 不同活化时间的LV干酵母在发酵过程中还原糖含量的变化Fig.2 Changes of reducing sugar contents during fermentation by LV dry yeast with different activation time
由此可见,较长时间活化可以使酵母快速适应环境,较快和较多地生长繁殖,并维持较高的发酵活力。而过长或过短时间的活化会使酵母生长和发酵活力较低。
2.1.3 活化时间对发酵过程中CO2生成量的影响
不同的活化时间对发酵过程中CO2生成量的影响结果见图3。由图3可知,随发酵时间的延长,CO2生成量逐渐增加,发酵初期升高较快,发酵中期和后期升高较慢,到12 d后CO2的生成量基本不变,活化时间由短到长CO2的生成量依次为90.29 g/L、77.27 g/L和86.42 g/L。发酵中期和后期的各组CO2生成量差异明显(P<0.05),活化25 min的酵母发酵CO2生成量最多,为91.2 g/L;活化3 h 15 min的酵母CO2生成量最少,为78.35 g/L。
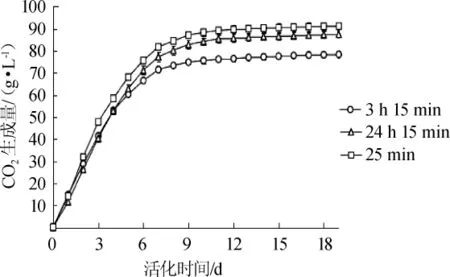
图3 不同活化时间的LV干酵母在发酵过程中的CO2生成量变化Fig.3 Changes of CO2production during fermentation by LV dry yeast with different activation time
CO2的生成量差异可以体现出发酵过程中的酵母活性的差异[17],活化3 h 15 min的酵母CO2生成量较低,可能是因为细胞生长能力较强,所以发酵性能较高。而活化过长或过短时间的酵母CO2的生成量较高,图1也显示了相应活化时间的酵母生长量较少,可能在葡萄酒发酵中较多的CO2抑制了酿酒酵母的生长[19],并降低了细胞活性,比如活化25 min的酵母在发酵中期活酵母菌浓度最早(第10天)开始下降。结果表明,CO2生成量的差异与活化不同时间的酵母在发酵过程中还原糖含量的差异一致。
2.1.4 活化时间对发酵过程中乙醇和乙酸含量的影响
不同活化对发酵过程中乙醇和乙酸含量的影响结果见图4。由图4A可知,活化3 h 15 min的酵母在整个发酵过程中乙醇产量均高于另外两种活化时间的酵母。在发酵初期,活化24 h 15 min与活化25 min的酵母乙醇产量无明显差异(P>0.05);在发酵中期和后期,即在发酵第10天和第18天的检测结果表明,活化24h15min的酵母乙醇产量分别为38.54g/L和56.59 g/L,均高于活化25 min的酵母乙醇产量,为32.66 g/L和46.5 g/L。在发酵第15~18天实验组乙醇的积累基本达到稳定。发酵终止时,活化3 h 15 min的酿酒酵母乙醇积累量较多(60.4 g/L),明显高于25 min活化的方式,略高于24 h 15 min活化方式(56.59 g/L)。由此可见,较长时间活化可以提高酵母乙醇发酵活性。由图4B可知,在发酵过程中,3种活化时间的酵母在发酵过程中的乙酸产生量逐渐增多,发酵14 d后的乙酸生成速率减小,随酵母活化时间的延长最终乙酸产量依次增加(P<0.05)。乙酸是酒精发酵的副产物,一般控制普通葡萄酒中乙酸含量低于1.2 g/L[20]。3种活化时间的酵母,乙酸的产量都能满足葡萄酒发酵控制乙酸生成量的要求,为保证葡萄酒质量,不宜过长时间活化酵母。
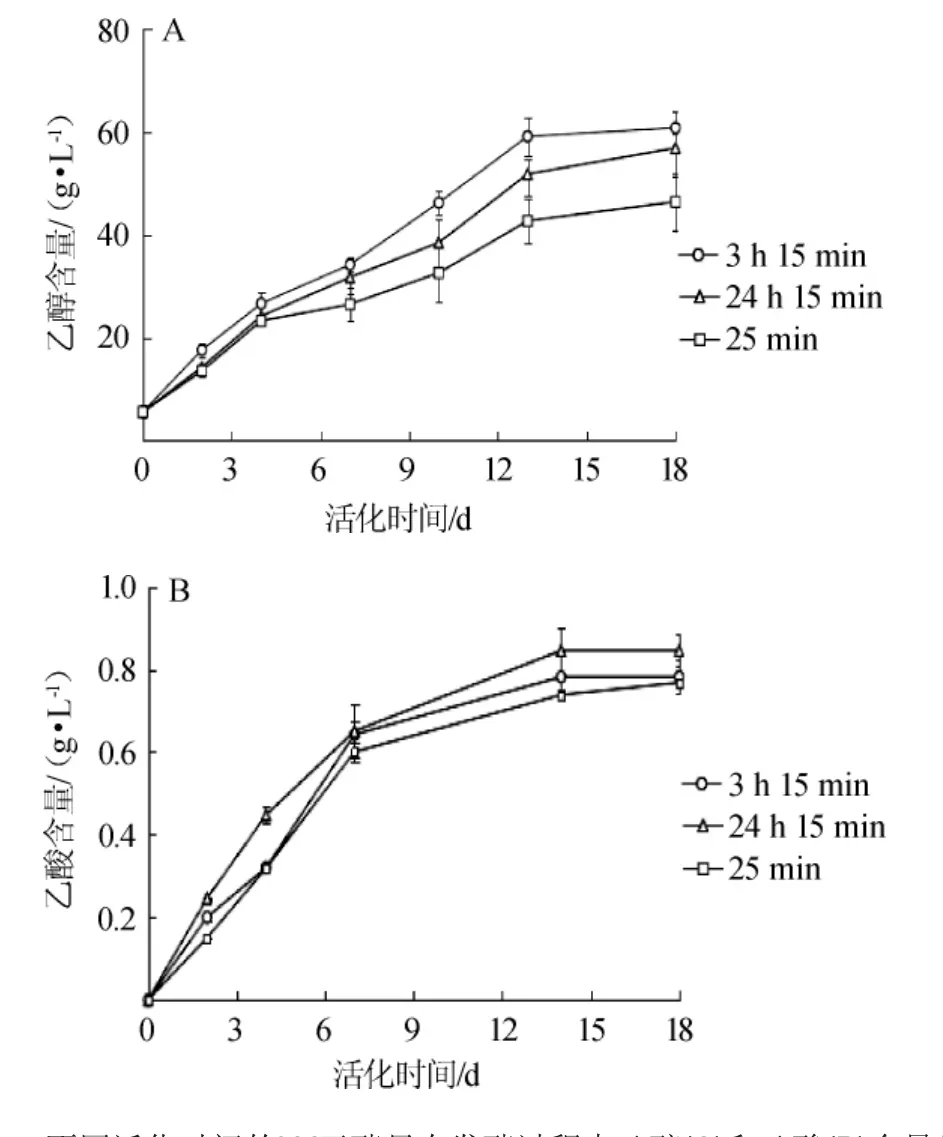
图4 不同活化时间的LV干酵母在发酵过程中乙醇(A)和乙酸(B)含量的变化Fig.4 Changes of ethanol(A)and acetic acid(B)contents during fermentation by LV dry yeast with different activation time
2.2 活化级数对葡萄酒发酵的影响
2.2.1 活化级数对发酵过程中活酵母菌浓度与总菌体浓度的影响
不同的活化级数对发酵过程中LV干酵母活菌浓度及总菌体浓度的影响结果见图5。由图5A可知,三级活化的酵母在发酵初期的酵母活菌浓度高于二级活化的酵母,达到4.51×107个/mL。在发酵第11天,二级活化的酵母活菌浓度达到最大值,为4.43×107个/mL。由图5B可知,在发酵前2 d,菌体总浓度的差异不明显(P>0.05)。在发酵中期和后期,三级活化的酵母菌体总浓度基本高于二级活化(P<0.05)。在发酵后期,三级活化的酵母活菌浓度基本高于二级活化(P<0.05)。
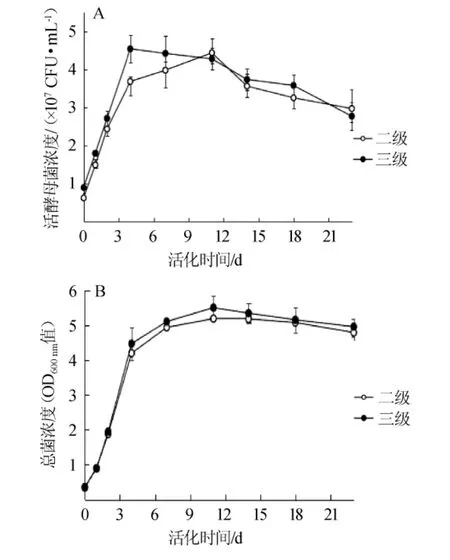
图5 不同活化级数的LV干酵母在发酵过程中活酵母菌浓度(A)及总菌浓度(B)的变化Fig.5 Changes of viable yeast concentration(A)and total yeast concentration(B)during fermentation by LV dry yeast with different activation stages
由此可见,三级活化的酵母在发酵过程中的活酵母菌浓度基本高于二级,总菌体浓度在发酵中期和后期均处于较高的状态。因此,不同的活化级数对于在发酵过程中活酵母菌浓度和总菌浓度具有显著影响(P<0.05)。
2.2.2 活化级数对发酵过程中还原糖含量的影响
不同的活化级数对发酵过程中还原糖含量的影响结果见图6。由图6可知,在发酵初期,两种级数活化的酵母发酵消耗还原糖差异不明显(P>0.05),发酵第2天检测二级与三级活化的酵母还原糖含量分别为214.1 g/L和218.24 g/L。到了发酵中期,消耗的还原糖含量差异显著(P<0.05),第7天检测三级活化的酵母还原糖含量为31.96 g/L,二级活化的酵母还原糖含量为40.93 g/L,可知三级活化的酵母消耗还原糖的能力高于二级。最终,在14~18 d还原糖含量逐渐降为0。由此可见,不同级数活化的酵母在发酵中期消耗还原糖的含量差异显著(P<0.05)。
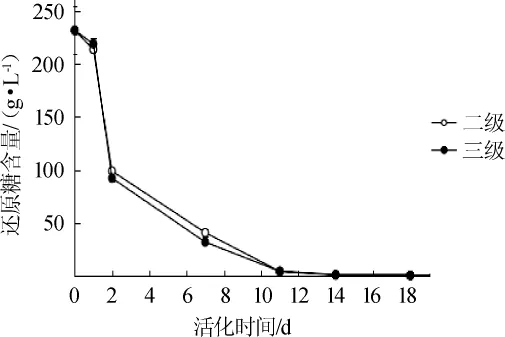
图6 不同活化级数的LV干酵母在发酵过程中还原糖含量的变化Fig.6 Changes of reducing sugar contents during fermentation by LV dry yeast with different activation stages
2.2.3 活化级数对发酵过程中CO2生成量的影响
不同的活化级数对发酵过程中CO2生成量的影响结果见图7。由图7可知,不同活化级数的酵母在发酵过程中CO2生成量无明显差异。由此可见,活化级数对酵母发酵过程中CO2生成量无显著影响(P>0.05)。
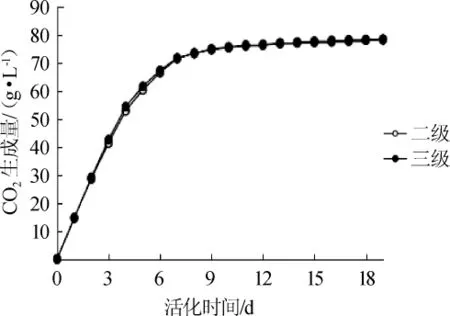
图7 不同活化级数的LV干酵母在发酵过程中的CO2生成量变化Fig.7 Changes of CO2production during fermentation by LV dry yeast with different activation stages
2.2.4 活化级数对发酵过程中乙醇和乙酸含量的影响
由图8A可知,在发酵初期和中期,即发酵第4天和第10天检测乙醇,三级活化的酵母乙醇的产量(30.47 g/L和48.65g/L)均显著高于二级(26.69g/L和46.33g/L)(P<0.05)。而至发酵后期,二者乙醇的积累量相差不大(P>0.05)。由此可见,两种不同级数活化的酵母在发酵初期和中期对乙醇的产量的影响较为显著(P<0.05),但最终乙醇的积累无显著差异(P>0.05)。
由图8B可知,两种活化级数的酵母在发酵前期乙酸产量有显著差异(P<0.05),在发酵第4天检测乙酸含量,三级活化的酵母乙酸产量高于二级,分别为0.35 g/L和0.32 g/L。但在发酵中期和后期无显著差异(P>0.05)。最终乙酸的产量均<1.2 g/L。
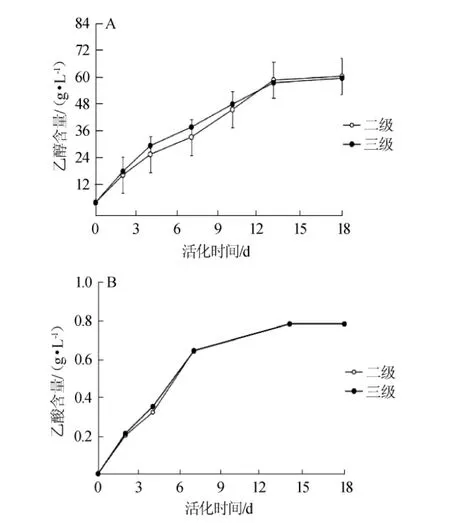
图8 不同活化级数的LV干酵母在发酵过程中乙醇(A)和乙酸(B)含量的变化Fig.8 Changes of ethanol(A)and acetic acid(B)contents during fermentation by LV dry yeast with different activation stages
3 结论
通过不同的活化时间和级数活化活性干酵母LV,接种到模拟葡萄汁进行葡萄酒发酵。结果表明活化时间和级数对酿酒酵母生长及发酵能力有较大影响。活化3h15min比活化24 h 15 min和25 min的酵母生长代谢能力强,酵母活菌浓度达到4.23×107个/mL;耗糖快;产乙醇较多,在发酵18 d后达到60.4 g/L。进行三级3 h 15 min活化活酵母菌浓度较大,最高达到4.51×107个/mL;两种级数活化的酵母在发酵过程中还原糖含量差异显著(P<0.05),CO2生成量、乙醇和乙酸没有显著差异(P>0.05)。如果在工业生产中对酵母的含量活性要求较高,建议采用3 h 15 min三级活化的方式。

