囊胚细胞计数法评价辅助生殖用医疗器械临床前安全性
【作 者】韩倩倩,赵军招,杨昭鹏,史建峰,王迎,连环,王春仁,金星亮,
1 中国食品药品检定研究院,北京市,102629
2 温州医科大学第二附属医院育英儿童医院生殖医学中心,温州市,325027
3 悉尼大学医学院Kolling医学研究院,悉尼再生发育医学中心,澳大利亚新威尔士州,2065
0 引言
人类体外辅助生殖技术(Assisted Reproductive Technologies, ART)是治疗不孕不育的有效方法。ART产品种类繁多,包括培养液类产品、洗涤液类产品、冷冻复苏类产品、穿刺针类产品、导管类产品、培养用耗材类产品等。由于ART的特殊性,这些产品的质量检测不可能直接通过人类胚胎而是通过小鼠为模型来完成[1-4]。常用的小鼠胚胎试验(Mouse Embryo Assay, MEA)的基本指标是囊胚的生成率,然后这指标已不能完全符合辅助生殖技术质量的要求。例如,小鼠受精卵在低氧浓度(5%)的条件下培养能获得更好的胚胎发育力[5]。然而,小鼠受精卵在5%和20%氧浓度的条件下培养96 h都能获得相同的囊胚形成率,但是所形成的囊胚的细胞数及囊胚孵化率不同[5]。MEA的结果也受到小鼠品系、培养液种类、培养体系等影响[6-8]。理想的MEA应该包括检测所有影响发育的变量因素,这明显是不可能达到的。即便如此,利用动物模型的数据也不能与人类体内胚胎发育的要求一致。在目前尚未发现最优化检测ART质量的方法之前,MEA仍不失为一种有效的手段。然而,在我们已经知道目前MEA缺点的情况下,必须建立一种较敏感而更有效地检测ART胚胎质量的方法。大量研究已经发现胚胎细胞数及囊胚细胞系分类计数是一种简单实用的首选方法[9-12]。该方法的特征是在原有鼠胚试验的基本标准方法的基础上,增加了两个检测指标,分别为胚胎的细胞总数和囊胚期胚胎中内细胞团细胞和滋养层细胞的总数。其方法包括下述步骤:①胚胎的细胞总数的检测方法,比较受精卵体外培养发育的胚胎与体内发育的同期胚胎内的细胞总数;②囊胚期胚胎中内细胞团细胞和滋养层细胞的总数的检测方法,比较体外培养生成的囊胚和体内发育的囊胚内细胞团表达UTF1和滋养层细胞表达CDX2的细胞数,及其两者分别占囊胚总细胞数的比率。
人类ART胚胎质量是提高ART成功率的关键,建立以动物模型为基础的ART质控体系保证了ART适应日益增长的临床需要和高质量新产品的开发。
1 材料和试剂
1.1 动物
试验动物品系:F1杂交CBA/C57小鼠。
超排计划:获取受孕小鼠的1-细胞受精卵。4~8周龄雌鼠,经腹腔注射PMSG(孕马血清促性腺激素)5 IU/只;48 h后经腹腔注射hCG(人绒毛膜促性腺激素)5 IU/只,注射hCG当日雌鼠与同品系成熟已证实生育正常的雄鼠(鼠龄不超过6个月)合笼过夜。第二天上午8点检查交配情况,选择见栓小鼠备用。
1.2 试剂
固定液:由磷酸盐缓冲液PBS加2 g/100 mL的多聚甲醛(Para dehydrofloride, PFA)组成,pH值为7.4。
胚胎漂洗液:PBS加0.01 μL/100 mL的聚山梨酯(TWEEN-20)。
细胞膜打孔液:固定液加0.3 μL/100 mL的TWEEN-20和0.2 μL /100 mL的聚乙二醇对-(1, 1, 3, 3-四甲基丁基)-苯基醚(Triton X 100)。
固定染色液:由PBS加PFA 2 g/100 mL 和10 μg/mL的双苯甲亚胺(bisBenzimide trihydrochloride,Hoechst33342)组成;
制片液:磷酸盐缓冲液P B S加抗淬灭剂DABCO。
DNA染色液:①磷酸盐缓冲液PBS加0.1 μg/mL的碘化丙啶 (Prepedium Iodine, PI);②磷酸盐缓冲液PBS加10 μg/mL的4', 6-二脒-2-苯基吲哚(DAPI)。
以上试剂均购于Sigma公司。
抗体:UTF1抗体 (Rabbit anti-UTF1 polyclonal IgG)和CDX2抗体(Mouse anti-CDX2 polyclonal IgG)(购于Abcam公司)。二抗为goat anti-rabbit FITC conjugated IgG和goat anti-mouse texas red conjugated IgG(购于Sigma公司)。
2 试验过程和结果
2.1 体外胚胎培养
1-细胞鼠胚收集:注射hCG后18~20 h断颈处死见栓雌鼠,在输卵管壶腹部收集1-细胞鼠胚。将收集到的絮状受精卵团放置到透明质酸酶(150 μg/mL)中,当胚胎周围的卵丘和颗粒细胞被消化分离后立即取出。用卵母细胞缓冲液(购于南京优而生物)清洗3次后,挑选出正常形态的胚胎,转移到培养微滴中,用于1-细胞鼠胚检测试验。胚胎在培养液中的浓度为每10 μL液滴中放入10个胚胎。
胚胎培养:小鼠受精卵移至10~50 μL培养液微滴,上面覆盖大约2 mm厚的矿物油(Sigma);37oC恒温、保湿, 5% CO2的条件下培养;加入胚胎前,培养液必须在孵化箱内平衡2~4 h,pH值为7.4;使用目前常用的培养液(KSOM, 购于南京优而生物公司)和人类胚胎培养液作为对照。鼠胚数为10个,以10 μL大小的液体微滴培养的密度为标准[5]。
2.2 囊胚质量判断
每24 h在倒置显微镜下记录胚胎发育动态过程。培养96 h的囊胚形态观察:发育良好的囊胚,囊胚腔充分扩张,内细胞团大小适中,滋养层细胞连接紧密且大小均匀。发育差的囊胚,囊胚腔小,内细胞团小或无内细胞团,滋养层细胞稀疏。
(1)囊胚形成率。1-细胞胚胎体外培养96 h后记录囊胚数量,对形成囊胚的受精卵比例进行计算。

(2)囊胚总细胞数。检测利用Hoechst33342可以穿透正常和凋亡细胞的细胞膜,对细胞核染色,发蓝色荧光的原理。收集的优质囊胚,在胚胎漂洗液中漂洗3次,将胚胎转移至固定染色液中,转移过程中尽可能携带少量的PBS液,避光染色10 min。取抗淬灭剂10 μL滴于载玻片上,将胚胎移到液滴上,液滴四周以凡士林支撑,将盖玻片轻轻压到液滴上,与凡士林接触后适当加压,使囊胚充分延展。用荧光显微镜观察。Hoechst33342染色的细胞核DNA,可作为小鼠囊胚期胚胎的总细胞计数的有效手段。箭头所指的是含DNA碎片细胞核。染色结果见图1。UTF1的阳性细胞,对比度较强的部分(红色)表示滋养层细胞表达CDX2的阳性细胞。较浅的部分(蓝色)为Hoechst33342 DNA染色,代表了囊胚的总细胞数。利用以上染色方法,成功对内细胞团和滋养层细胞细胞进行了染色和区分。这有助于对囊胚细胞进行计数和质量判断。

图1 小鼠囊胚DNA染色Fig.1 The staining of DNA of mouse embyro
(4)试验方法在产品上的验证。使用本染色和技术方法,在市售的4种培养基上做了验证工作。比较几种培养基的体外培养的囊胚与体内发育的囊胚,结果见表1所示。KSOM培养基和KSOM+AA培养基的UTF1阳性的细胞总数显著低于体内发育的囊胚。KSOM培养基的细胞数显著低于体内发育的囊胚。说明本方法对于评价囊胚质量的可靠性好。
(3)囊胚内细胞团及滋养层细胞的双荧光染色。根据囊胚内细胞团表达UTF1和滋养层细胞表达CDX2,这两个分子标记,进行双荧光染色。体囊胚在胚胎漂洗液内漂洗3次;漂洗后移入固定液,在室温下固定30 min,然后移至细胞膜打孔液30 min,再以胚胎漂洗液漂洗10 min,重复3次。将上述处理后的胚胎在室温下置于体积比为30%的与二级抗体相同源的动物血清中3 h以封杀非特异性的抗体结合位点。在4oC条件下将处理后的胚胎与初级抗体(抗UTF1和CDX2)结合8~16 h,再以胚胎漂洗液漂洗胚胎10 min,重复3次;然后在室温避光条件下与二级抗体结合1 h;再以胚胎漂洗液漂洗胚胎10 min,重复3次;根据二级抗体所联结荧光色谱,将胚胎移至DNA染色液中,在室温避光条件下孵化10 min;DNA染色液的荧光色素必须与二级抗体所联结荧光色素不同,以区分DNA和被标记的抗原UTF1或CDX2;将孵化后的胚胎移至制片液,制片;置于室温避光条件下10 min;采用荧光显微镜技术检查胚胎表达UTF1和CDX2的细胞总数和DNA染色的总细胞数(图2)。高亮部分(绿色)荧光表示内细胞团
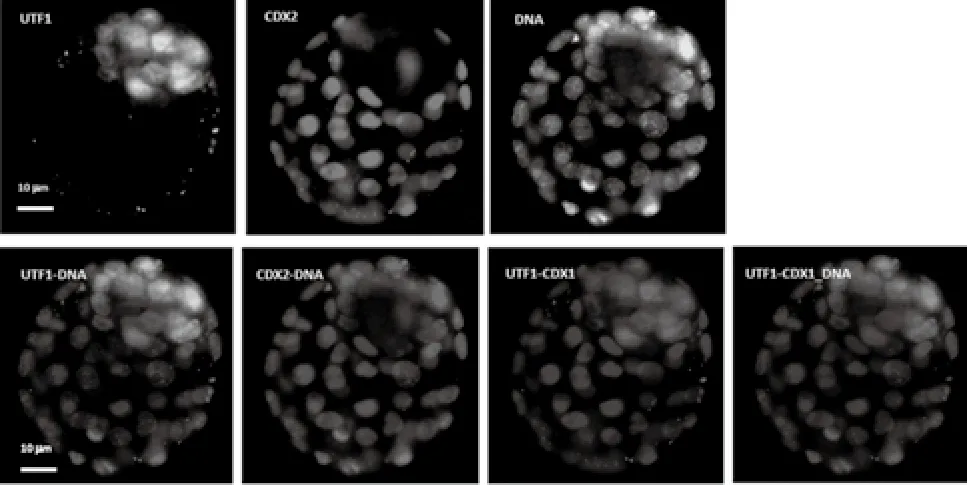
图2 囊胚内细胞团及滋养层细胞的双荧光染色Fig.2 The double fl uorescent staining of inner cell and trophoblastic cell
(5)优质囊胚的标准研究。分析合笼96 h体内发育的囊胚的细胞数>50个,ICM细胞> 14个以上,其所占细胞总数的比例是30%左右,碎裂核较少(表1)。比较胚胎培养液对小鼠受精卵96 h胚胎发育的影响(表1),发现简单培养液(KSOM)和几个临床常用的ART培养液都可以产生80%以上的囊胚形成率,但囊胚计数发现简单培养液中形成的囊胚的细胞总数较低(<50个),碎片细胞核多(>3个)。双荧光染色进一步发现ICM细胞数少(<8个),ICM占囊胚细胞总数不到20%。KSOM培养液中加氨基酸后,胚胎发育有所改善细胞总数可达到50个,但ICM数不到10个。当受精卵在临床用的ART培养液所产生的囊胚的细胞总数都大于50个,ICM细胞及其所占细胞总数的比例都明显增加,碎片细胞核减少。

表1 几种培养液对胚胎发育的影响Tab.1 The in vitro culturing results of four kinds of medium
3 讨论
ART主要包括IVF(In Vitro Fertilization,体外受精) 和ICSI-IVF两种主要技术。ART是解决不育不孕症的重要手段,也是人类获得人类胚胎干细胞的唯一途径。通过选择优质胚胎移植,植入前基因诊断(Preimplantation Genetic Diagnosis, PGD)和植入前胚胎筛选技术(Preimaplantation Genetic Screen,PGS),是实现优生优育的重要技术手段。在ART的过程中需要一系列的试剂类和器具类医疗器械来实现配子的获得、受精和发育等过程。液体类医疗器械如取卵液、精子洗涤液、体外受精液、卵裂液、囊胚培养液,用于胚胎保存的胚胎冷冻液、囊胚冷冻液、胚胎解冻液以及用胚胎活检液等一系列产品。器具类医疗器械产品包括取卵针、囊胚培养用平板、取卵管等。近年来国内已有数十种相关产品出现,随着使用人群的不断扩大,产品的安全性问题会进一步加大。因此,制定相应的安全性评价检测方法已迫在眉睫。鼠胚试验是在体外观察受精卵发育程序及状态的一个常用试验方法,可以用来评价体外生殖用医疗器械对受精卵及受精卵发育的毒性影响。但是在鼠胚试验标准中,仅仅依靠囊胚形成率来评判产品合格与否是远远不够的。囊胚形成率仅依靠形态学的观察是不够的,囊胚的外形与囊胚的质量并不相关,一个质量好的囊胚仅靠外形是无法判断其质量的。
本研究建立了对囊胚内外细胞团进行鉴定和计数的方法,并且建立了评价试验体系和评价指标。根据体内发育囊胚分析,建议细胞总数至少50个以上,而细胞核碎裂等异常不应大于3%,UTF1阳性的ICM细胞数14个以上,才符合优质囊胚的要求。液体类医疗器械主要是培养液。器具类医疗器械也是要通过其浸提液来完成质量检测。本研究通过分析简单培养液和人类ART用的几种培养液,发现传统的囊胚率80%的标准较低,KSOM培养的囊胚细胞总数明显低于标准,加氨基酸后的细胞总数增加了,但ICM细胞数还是较低,而临床用的Vitrolife(分程培养液)和Sage的全程培养液已经达到了基本要求。因此囊胚细胞总数结合内细胞团细胞数及其占细胞总数的比例才可以比较出不同培养液的优缺点。这个方法可用于辅助生殖用医疗器械的上市前质量评价和生产质控中。因为对于辅助生殖用医疗器械产品,出厂前必须通过鼠胚试验来检测产品的安全性,所以一个全面的鼠胚试验方法是非常重要的。
必须指出的是,鼠胚试验受到多种因素的影响[13]。其中小鼠品系和培养的氧浓度是最敏感的两大因素。目前通常用F1小鼠进行MEA,这明显降低了其敏感性,而氧浓度等因素都没有完全优化,因此目前的鼠胚试验处于次优化条件下。除了对鼠胚试验方法进行完善,也需要建立一个标准的阴性对照。本文研究者将继续开发用于鼠胚试验的标准培养基和阴性对照标准品及阳性对照标准品。

