医用聚乳酸材料的化学等同性研究
【作 者】秦静,康亚红,沈永,宋馨,骆红宇,姜洪焱
1 上海微创医疗器械(集团)有限公司,上海市,201203
2 山东省医疗器械产品质量检验中心,济南市,250000
聚乳酸(PLA)具有优良的力学性能、化学稳定性和生物降解性,降解中间产物乳酸是体内正常糖代谢产物,终产物是二氧化碳和水,对人体无毒害作用,具有良好的生物相容性和安全性[1],因此是理想的医疗器械材料;还可通过携带药物防止血管再狭窄发生[2],被公认为是最有前途的生物医用材料,符合可持续发展战略[3-4]。
聚乳酸医用材料的主要供应商为荷兰Corbion公司和德国Evonik公司[5]。国外供应的进口聚乳酸材料已在临床中应用,经过临床前生物学检测和动物实验验证,已确立生物相容性和临床安全性。而国内无供应商能大量提供医用聚乳酸材料,国内医疗器械开发商存在供方单一、采购周期长、价格昂贵和供应不足等潜在风险。因此为降低PLA供应风险,需大力推进PLA的国产化。
本研究通过聚合法间接合成聚乳酸,将聚乳酸国产化,并依据《医疗器械生物学评价和审查指南》规定[6]和GB/T 16886.18—2011[7]要求,对国产和进口聚乳酸材料进行化学表征,通过两者的化学等同性说明国产PLA的使用安全性,为国产PLA作为合格的植入级医疗器械材料奠定基础。
1 材料与测试方法
1.1 材料合成
《“十三五”材料领域科技创新专项规划》中对新一代生物医用材料的期望是高端医疗植/介入器械原材料能够国产化。目前生物可降解冠脉支架用PLA国内基本依赖于进口,为打破其垄断,本研究采用图1方式经过乳酸聚合成环得到丙交酯,而后在催化剂的作用下,将丙交酯开环高温聚合[4,8]得到高分子量聚乳酸。为验证其性能,与进口(Corbion)PLA对比,依据YY/T 0661—2017[9]进行化学等同性研究。由于两供应商的PLA均为粒子形态,本研究采用经过相同工艺加工成的片材样品进行测试,相同工艺包括粒子挤出、管材切割、清洗、包装和灭菌等。
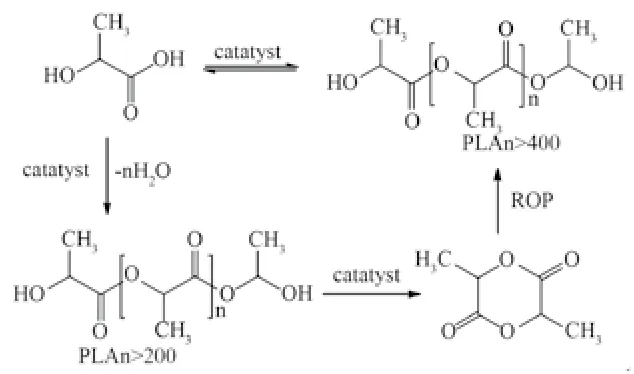
图1 聚乳酸合成反应方程Fig.1 Polylactic acid synthesis reaction equation
1.2 测试方法
1.2.1 聚乳酸的表征
1.2.1.1 结构表征
由于PLA为饱和线性聚酯结构的均聚物,只含有一个甲基侧基,不存在长链侧基和分支,不存在交联结构,因此不测试双键、不饱和度、交联度、侧基及共聚物相关表征分析。按YY/T 0661—2017[9]标准,化学结构用红外(FT-IR)和核磁共振光谱(1H-NMR和13C-NMR)来鉴定表征。FT-IR以衰减全反射法(ATR)测定,NMR是以氘带氯仿为溶剂,四甲基硅烷(TMS)做内标测定,分别通过观察光谱的主要吸收峰,来比较表征国产和进口PLA的材料特征谱图是否一致,其他吸收峰表征已知或未知杂质,包括残留溶剂和残留单体等。
1.2.1.2 分子量表征
分子量是每一种化学物质的重要参数,PLA作为聚合物其分子量表征尤为重要。按ASTM F 1925—17[10]标准,用乌氏粘度计测特性粘度和凝胶渗透色谱(GPC)测重均相对分子量和分子量分散系数(PDI)来表征PLA的分子量特性。
1.2.1.3 物理性能测试
PLA物理性能主要包括光学特性、热力学及结晶性等。由于光学活性不同,PLA聚集态的微观结构有差异,会导致热稳定性不同;而结晶性能影响PLA力学性能和降解性能,甚至影响加工特性;因此按ASTM F 1925—17标准和美国药典USP781,以氯仿为溶剂,用自动旋光仪测定比旋光度;按标准YBB 00132003—2015密度测定法,以无水乙醇为浸渍液,用浸渍法测定密度;按标准GB/T 2918—1998[11]中7.1规定用差示扫描量热仪(DSC)分别测定玻璃化转变温度Tg、熔点及熔融热焓;用X射线衍射仪(XRD)分析晶体结构。
1.2.1.4 物质残留
由于PLA合成中加入单体丙交酯、催化剂、链引发剂和溶剂丙酮,未引入其它物质,因此按YY/T 0661—2017标准,采用气相色谱法(GC)测定丙交酯单体及丙酮残留量,以表征产品的纯度;用等离子体发射光谱仪测定锡残留量,以确保催化剂量对双方聚合物影响的一致性;用马弗炉、电子万用炉和电子天平测定硫酸盐灰分,以表征碳化后的残留物;按美国药典USP 231重金属方法2,用马弗炉测定重金属残留量,用等离子体质谱仪(ICP-MS)和超高压微波系统测定重金属组分残留量,以表征重金属对聚合物的影响程度。
1.2.2 可沥滤物的分析
由于PLA合成中含有组分杂质等可沥滤物,如丙酮、丙交酯、乳酸和十二烷醇,它们均可溶于水或正己烷,因此按GB/T 16886.12—2017[12],用浸提温度为50oC,浸提时间为72 h,浸提比例为6 cm2/mL,浸提介质为极性纯水和非极性正己烷,对可沥滤物进行分析。纯水和正己烷为浸提溶剂,顶空条件下,用气相色谱-质谱联用仪(GC-MS)分析挥发性有机化合物(VOC)含量。纯水为浸提溶剂,用ICP-MS分别对PLA浸提液及其用1%的稀硝酸稀释10倍的稀释液进行全质量数扫描分析重金属含量。纯水和正己烷为浸提溶剂,采用乙腈复溶进样,用高效液相色谱仪(HPLC)分析可沥滤物类型。
1.2.3 降解性能
降解是PLA的重要性能,降解产物监控和质量损失是表征降解等同的重要指标。依据YY/T 0474—2004[13]和GB/T 16886.13—2017标准[14]分析PLA降解和降解产物,测试加速降解特性,分析降解液产物和降解产物类型。拟采取加速降解温度为70oC,溶剂为磷酸缓冲液,时间点为0、3 d、1周、4周、8周、12周和16周,得到降解检验液,将检验液用1%的稀硝酸稀释10倍后得到稀释液。取各时间点的降解液,过滤分离定容后进行GPC、质量损失分析,并用FT-IR测定各时间点的降解样品,得到光谱主要吸收峰。用ICP-MS对检验液及其稀释液进行全质量数扫描分析降解液中重金属含量。用GC-MS分析降解液中VOC的含量。用HPLC分析降解液中主要降解产物类型。
2 测试结果
2.1 化学表征结果
PLA化学表征测试结果,如表1所示。
2.2 可沥滤物测试结果
国产和进口PLA浸提液中VOC种类和含量一致;国产PLA重金属种类和含量没有显著超过进口PLA,国产PLA浸提液中无新的重金属物质出现;国产PLA浸提液中无新的可沥滤物出现,且可沥滤物含量均不超过进口PLA。
2.3 降解性能测试结果
各降解时间点分析得到国产和进口PLA分子量下降曲线一致,降解后分子量损失率一致,PDI均≤2.5。国产和进口PLA质量损失曲线一致,说明降解趋势一致。PLA分子量下降曲线和质量损失曲线见图3。国产和进口PLA的各降解时间点样品的红外光谱主要吸收峰一致。
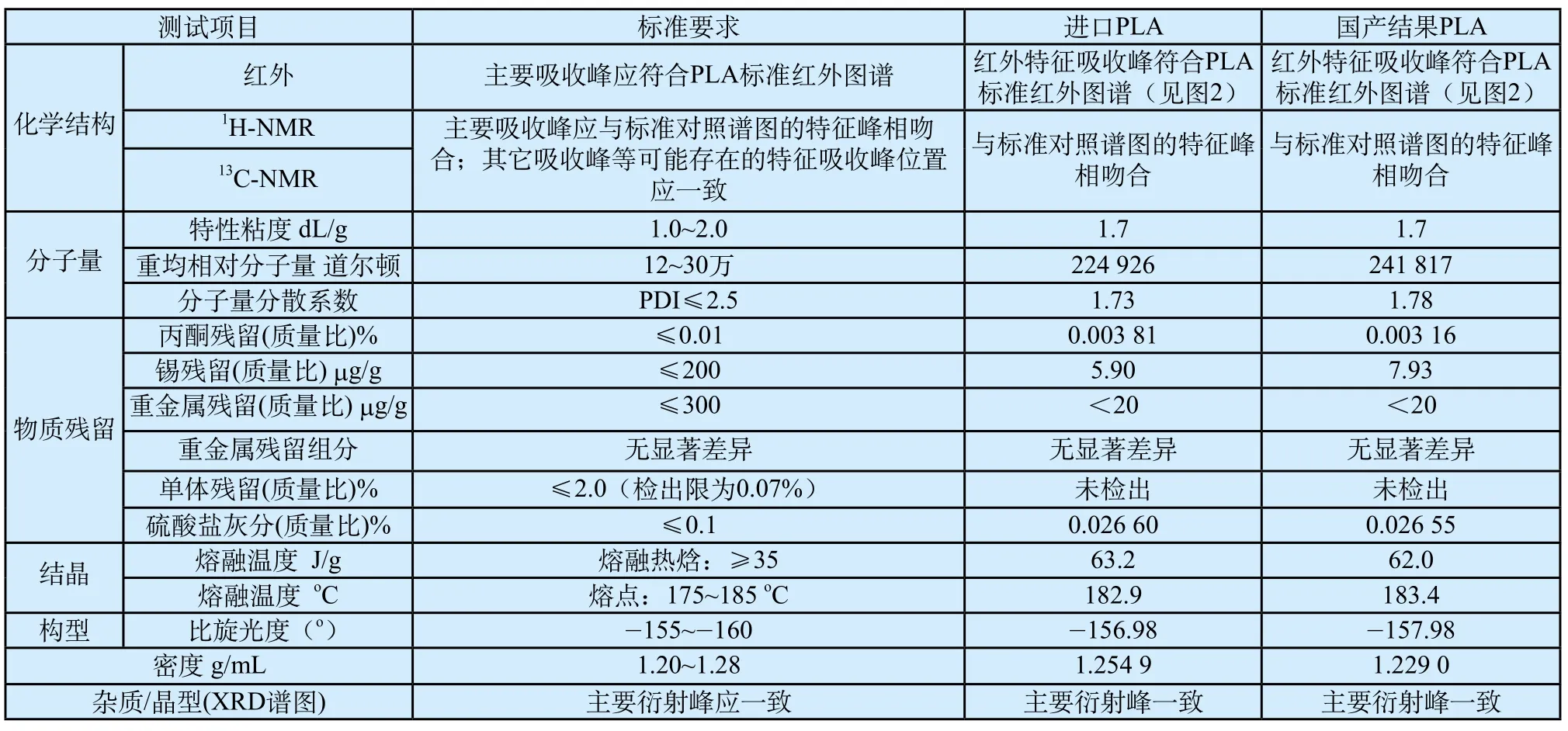
表1 PLA表征测试结果Tab.1 Test results of PLA chemical characterization
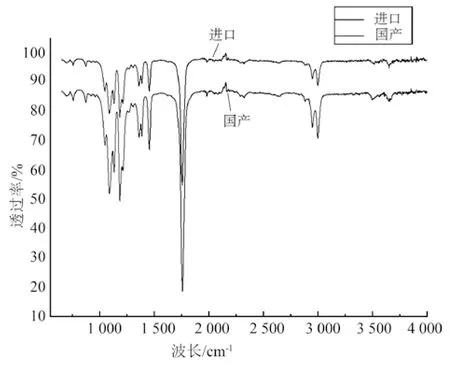
图2 红外光谱图Fig.2 Infrared spectra
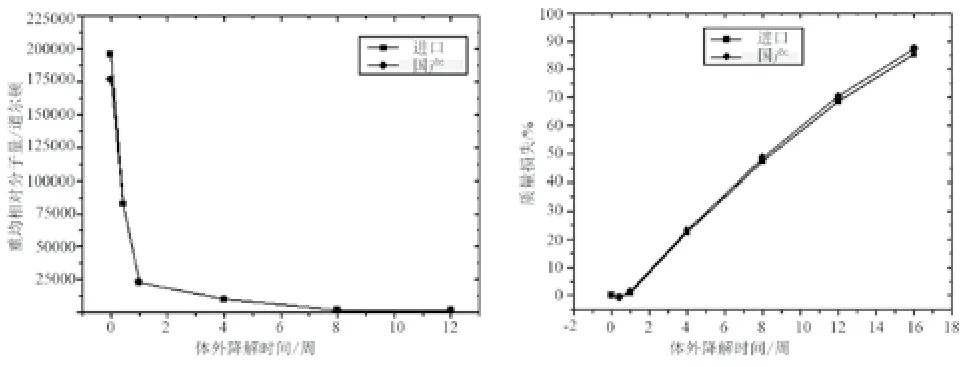
图3 PLA分子量和质量丢失曲线Fig.3 Curves of molecular weight decrease and mass loss of PLA
国产和进口PLA降解液中VOC、重金属在类型和含量上均一致;国产PLA降解液中VOC含量、重金属含量均没有显著超过进口PLA;国产和进口PLA降解液中主要降解产物均为乳酸,其它液相色谱峰位置均一致,国产PLA降解液中无新物质出现。
3 讨论与分析
从红外、核磁谱图峰一致证明了进口和国产PLA材料两者是同系物,并没有出现新的物质;从平均分子量和特性粘数一致表明平均分子大小等同;从旋光度证明了聚合物内结构单元的手性结构未发生改变;广角X-射线谱图一致以及热分析结果说明结晶度和晶型一致,表明分子堆积、排列方式一致;从重金属、可挥发物、可滤物分析可以看出没有出现新的物质,且残留量很低,符合质控要求;因此从高分子科学的角度可以认定国产聚乳酸材料和对照的进口材料具有等同性。
支架PLA材料在70 ℃加速降解条件下,无论是质量丢失还是重均分子量丢失,降解曲线吻合度都很好,表明降解行为基本一致;降解产物分析中,进口材料和国产材料降解液的VOC类型和含量一致,国产材料降解液中未产生新物质,符合聚乳酸材料的安全性要求; 两个供方材料降解液中主要降解产物为乳酸,其它液相色谱峰位置一致;国产PLA材料降解液中没有产生新的物质,降解液的色谱峰强度与进口材料相似,表明国产材料和进口材料在降解行为和降解产物方面是一致的。
PLA制造工艺中使用有机锡类催化剂,而有机锡化合物对人体有一定的危害性,为确保PLA在人体中使用的安全性,需对锡残留进行监测。聚乳酸基外科植入物的相关标准(YY/T 0661—2017[9]、ASTM F1925-17[10]、ASTM F2313-10[15])规定外科植入物中锡残留量应低于200 μg/g,ASTM F2579-10[16]中规定锡残留量的限量水平为≤150 μg/g。由锡残留检测结果可知,国产PLA锡残留量均值为7.93 μg/g,虽比进口PLA高出2.03 μg/g,但仍处于相同水平,并且远远低于标准规定的限量水平,所以国产PLA锡残留的风险可忽略。
4 结论
综合以上分析,国产PLA的各项化学表征结果较进口PLA均无显著性差异,充分说明两者具有化学等同性特征,证实国产PLA合成方法的有效性、可靠性和适用性。根据GB/T 16886.1—2011第4.1部分[17]和《医疗器械生物学评价和审查指南》[6]规定,在进行生物学试验之前,对材料化学表征、可沥滤物等进行测试,得到材料化学表征信息,为医疗器械材料进一步豁免生物学试验等提供资料性数据。因此,本研究预测国产与进口PLA的生物学风险相同,进一步为国产化聚乳酸在植入级医疗器械上应用提供技术依据。

