miR- 34a通过MMP2抑制脑胶质瘤细胞侵袭和转移
涂其武,沈晓黎
(南昌大学第二附属医院, 江西 南昌 330000)
恶性脑肿瘤(主要为神经胶质瘤)占颅内肿瘤的40%~50%。近20年来,胶质瘤患者的中位生存期无明显改善,以各种疗法均难以达到根治程度,几乎毫无例外地迟早要复发[1]。最近几年,细胞分子机制的深入研究成为有效治疗肿瘤的关键。自1993年发现miRNAs,现已发现1 000多种miRNAs。miR- 34家族为近年来备受关注的miRNA之一,miR- 34a是其中一种且其作用机制已经明确[2]。目前已有研究证实,肿瘤细胞内miR- 34a的表达异常与细胞增殖及凋亡相关。在神经母细胞瘤中,染色体1p的杂合缺失导致miR- 34a表达减少,进而引起肿瘤异常增殖及侵袭能力减弱[3]。另外,miR- 34a可以通过AKT和Wnt信号通路抑制脑胶质瘤细胞增殖[4]。
目前研究证实,在许多肿瘤中基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)都呈高表达,与肿瘤侵袭迁移密切相关,且是Wnt信号通路下游靶基因[5- 6]。在预测miRNA靶基因数据库中,发现MMP2是miR- 34a潜在的靶基因。MMP2与miR- 34a在脑胶质瘤细胞中侵袭和迁移的研究未见报道,其机制尚不清楚。本研究中,为了证实miR- 34a是否通过MMP2影响脑胶质瘤细胞的生物学功能,检测脑胶质瘤细胞株中miR- 34a及MMP2的表达情况,并且观察miR- 34a及MMP2对脑胶质瘤细胞侵袭迁移的影响。
1 材料与方法
1.1 材料
脑胶质瘤细胞系A172、U251、U373、 U87及人正常脑胶质细胞(HEB)(ATCC公司);胎牛血清和DMEM培养液(Gibco 公司);LipofectamineTMLTX and Plus Reagent(3000) 转染试剂盒(Invitrogen 公司); Trizol(RNA提取试剂盒)、PrimeScriptTMRT reagentKit with gDNA Eraser(Perfect Real Time)和SYBR® Premix Ex TaqTM(Tli RNaseH Plus)试剂盒(大连宝生物工程有限公司);一步法RT反转录试剂盒及大肠杆菌DH5α感受态细胞(TaKaRa公司);microRNA提取试剂盒、反转录及荧光定量试剂盒(北京诺博莱德科技有限公司);RIPA蛋白裂解液(北京普利莱基因技术有限公司);BCA蛋白浓度测定试剂盒(碧云天生物技术研究所);鼠抗人MMP2和兔抗人微管蛋白(Tubulin)抗体(武汉三鹰公司);山羊抗兔IgG(二抗)和山羊抗鼠IgG(二抗)(北京中杉金桥生物技术有限公司);Western blot曝光化学发光检测试剂盒(北京天根生物科技有限公司);pcDNA5和PGL3质粒载体,双荧光素酶报告基因试剂盒(Promega公司);限制性内切酶T4DNA连接酶、XhoⅠ、BamHⅠ、XbaⅠ、pyrobest DNA聚合酶、DpnⅠ酶、大量质粒提取试剂盒和DNA凝胶回收试剂盒;设计的miR- 34a、MMP2等DNA序列,miR- 34a、RNU6B、MMP2、GAPDH荧光定量相关引物、MMP2 3′UTR区野生型及突变型的荧光素酶质粒(上海生工公司)。
1.2 方法
1.2.1 细胞培养及转染:于37 ℃、CO2体积分数为5% 的培养箱中培养脑胶质瘤细胞及HEB,传代培养使用含10% 胎牛血清DMEM 培养液。筛选MMP2相对高表达的细胞株后,按新型脂质体LipofectamineTMLTX and Plus Reagent(3000)转染试剂说明书用DMEM培养液进行转染,设置空白对照组同时分别转染miR- 34a mimic和抑制剂, 6 h 后换含有10%胎牛血清的DMEM 培养液继续培养48 h,待质粒高表达后提取细胞RNA和总蛋白。在pcDNA5-miR- 34a与PGL3-MMP2 3′UTR-WT或PGL3-MMP2 3′UTR-mut共转染和分别转染pcDNA5-miR- 34a及pcDNA5-MMP2时,方法同上。
1.2.2 设计引物及构建pcDNA5-miR-34a、pcDNA5-MMP2质粒:根据GenBank的基因序列设计引物如下:miR- 34a上游引物5′-TGGCAGTGTCTTAGCTG GTTGT-3′,下游引物5′-AACCAGCTAAGACACTGCC ATT-3′;RNU6B上游引物5′-TCGCTTCGGCAGCAC-3′,下游引物5′-AACGCTTCACGAATTTGCG-3′;MMP2上游引物5′-AGAAGGCTGTGTTCTTCGCA-3′,下游引物5′-AAAGGCAGCGTCTACTTGCT-3′;GAPDH上游引物5′-TGTTCGACAGTCAGCCGC-3′,下游引物5′-GTTAAAAGCAGCCCTGGTGAC-3′。用T4 DNA连接酶连接miR- 34a全长片段与pcDNA5空载体,MMP2全长片段与pcDNA5载体链接,然后将连接产物转化到DH5α感受态大肠杆菌,扩增后大量抽提质粒DNA,酶切及测序验证。
1.2.3 microRNA靶基因的预测:使用TargetScan(http://www.targetscan.org)、Pictar(http://pictar.mdcberlin.de)、microRNA(http://www.microrna.org)和miRecord(mirecords.biolead.org)4个数据库预测miR- 34a与MMP2的结合区域。
1.2.4 双荧光素酶报告基因:将预测的与成熟miR- 34a mRNA结合的MMP2 mRNA 3′UTR区域野生型及突变型的特定序列克隆整合到PGL3-promoter-vector载体里,构建出PGL3-MMP2 3′UTR-WT和PGL3-MMP2 3′UTR-mut两个质粒。具体按双荧光素酶报告基因试剂盒说明书操作。
1.2.5 RT-qPCR 法检测各基因的mRNA表达水平;用Trizol试剂提取各组细胞的总RNA,按PCR试剂盒说明书操作。在ABI 7300实时荧光定量机器上PCR 反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共40 个循环。以2—ΔΔCt值表示各基因 mRNA 的相对表达水平。
1.2.6 Western blot、Transwell侵袭实验和划痕实验:其步骤方法参考相关文献[7]。
1.3 统计学方法
2 结果
2.1 在多株脑胶质瘤细胞株里miR- 34a和MMP2的表达情况
MMP2的蛋白含量在各脑胶质瘤细胞株内呈高表达,其中U87和A172相对高表达(P<0.05)(图1A)。MMP2的mRNA呈高表达,而miR- 34a的mRNA水平相对呈低表达(P<0.01)(图1B)。
2.2 在U87和A172细胞株内miR- 34a可以下调MMP2的蛋白及mRNA水平
选用MMP2表达高的U87和A172细胞,转染miR- 34a mimic及抑制剂后,明确过表达及抑制有效果(图2A),转染mimic的细胞株内MMP2的蛋白及mRNA水平相对空白对照组均下降(P<0.05),转染抑制剂的细胞株内MMP2的表达均上升(P<0.05)(图2B,C)。
2.3 miR-34a通过结合MMP2 mRNA 3′UTR区特定序列下调MMP2的表达
将野生型的MMP2 3′UTR区与突变型的MMP2 3′UTR区的荧光素酶质粒分别与pcDNA5-miR- 34a质粒共转入U87和A172细胞,进行荧光素酶报告基因实验。野生型实验组荧光素酶活性明显下降(P<0.05)(图3)。
2.4 miR- 34a通过调控MMP2进而抑制脑胶质瘤细胞的侵袭迁移
在U87细胞株内分成3组,空白对照组、MMP2过表达组、miR- 34a 和MMP2过表达组。过表达MMP2组细胞侵袭迁移能力增强,但是miR- 34a 和MMP2过表达组的侵袭迁移能力下降(图4)(表1)。
3 讨论
恶性脑肿瘤的综合治疗将不再是传统的手术、放疗和细胞毒化疗,正在飞速发展的分子生物学和基因工程技术提供了解决这一难题的有力武器。肿瘤细胞侵袭迁移的能力直接影响了肿瘤细胞的扩散,导致肿瘤治疗的难度增加,降低患者的术后放化疗疗效[8]。目前许多研究已经证实MMP2参与了肿瘤细胞的侵袭迁移, 在脑胶质瘤、 结肠癌、 胰腺癌和肺癌中都有类似报道[7,9]。MMP2表达水平与脑胶质瘤患者的预后呈负相关,暗示MMP2是个癌基因在脑胶质瘤中[10]。另外,miR- 34a 可以通过靶向结合Bcl- 2参抑制脑胶质瘤细胞增殖和促进脑胶质瘤细胞凋亡[11]。因此,推测可能miR- 34a和MMP2都与脑胶质瘤发生发展有着密切关联。
miR- 34a在许多恶性肿瘤内低表达。在60例脑胶质瘤患者临床术后标本和A172细胞株中发现miR- 34a低表达[12],这与本研究中检测的多株脑胶质瘤细胞株中miR- 34a表达情况一致。在U87细胞株中研究miR- 34a通过调控Dll- 2的表达影响U87细胞株的生物学功能[13]。在本研究中选用了U87和A172细胞株进行研究。MMP2参与了许多恶性肿瘤的侵袭迁移,其成为肿瘤靶向治疗的一个新的靶点。在U87细胞株内p53可以通过MMP2增加侵袭能力[9],而检测了45例儿童脑胶质瘤临床标本发现MMP2呈高表达[14],这与MMP2抑制脑胶质瘤的侵袭迁移报道一致。所以将miR- 34a与MMP2结合起来研究对脑胶质瘤的生物学功能影响的机制。miR- 34a可以通过结合MMP2 3′UTR区域抑制脑胶质瘤细胞侵袭迁移,这与目前大多数研究报道miR- 34a在肿瘤里低表达是抑癌基因的结果一致。

A.Western blot analysis of MMP2 expression in HEB cell and cancer cell lines;B.RT-qPCR analysis of miR- 34a and MMP2 expression in HEB,U251,A172, U373 and U87 cell lines;*P<0.05,**P<0.01 compared with HEB

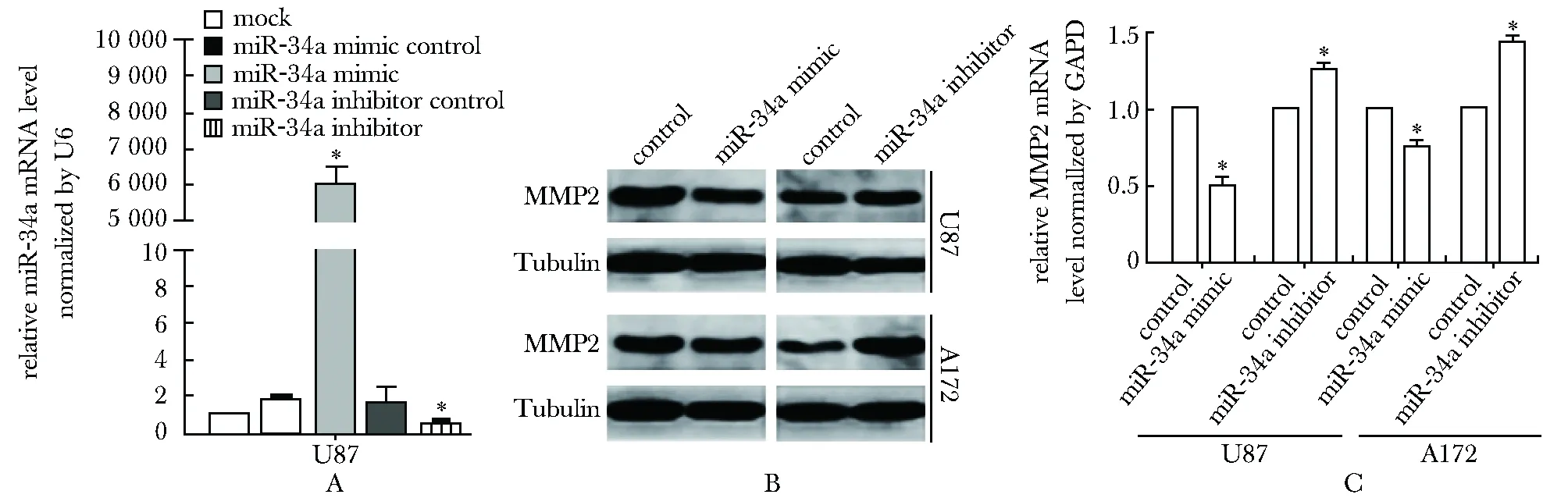
A.RT-qPCR was performed to confirm the transfection efficiency of miR- 34a mimic and inhibitor in U87 cells;B.miR- 34a downregulated MMP2 protein level in U87 and A172 cells;C.miR- 34a downregulated Notch1 mRNA expression in U87 and A172 cells;*P<0.05 compared with control

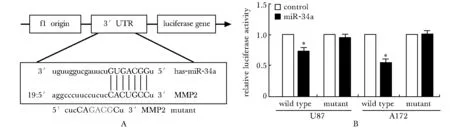
A.Human MMP2- 3′UTR binding site for miR- 34a,and mutant MMP2- 3′UTR;B.miR- 34a significantly suppressed the luciferase activity of Wt MMP2- 3′UTR reporter gene, but not the Mt MMP2- 3′UTR;*P< 0.05 compared with the control
图3 miR- 34a通过结合MMP2 mRNA 3′UTR来下调MMP2的表达 Fig 3 miR- 34a downregulated MMP2 by binding to the mRNA n=3)
*Compared with control,using scheffe to perform multiple comparisons in the post-hoc.

A.the effect of invasive ability (crystal violet staining ×400); B.migration capacity (microscopy × 100)图4 miR- 34a调节MMP2对脑胶质瘤侵袭迁移能力的影响Fig 4 miR- 34a regulated MMP2 on invasion and metastasis of glioma cells n=3)
综上所述,本研究在脑胶质瘤中将miR- 34a与MMP2结合起来研究,而且报道证实miR- 34a结合MMP2 mRNA 3′UTR区的特定序列,进而抑制了脑胶质瘤的细胞侵袭迁移,为脑胶质瘤靶向治疗提供了新的理论依据和实验基础。

