大骨节病病区水-土体系中硒的赋存形态和吸附特征研究
张 鑫,李敏敏,高旭波
(中国地质大学(武汉)环境学院,湖北 武汉 430074)
硒(Se)是人体必需的微量元素之一,其在人和动植物健康方面具有重要的生物化学功能[1-2],当人体血硒和发硒浓度分别高于或低于0.1~0.44 μg/mL和0.2~3.76 μg/g时,将产生人体硒营养异常,导致大骨节病、克山病、硒中毒和消化道癌症等硒反应症。人体摄入硒的途径有食物、水和空气3种,但从饮用水摄入的硒仅占人体摄入硒的1%,大气中硒浓度一般为n×10-9,对人体影响很小,所以人体主要通过食物摄入硒,而土壤中硒含量是影响食物链中硒水平的决定因素[3],故土壤中硒含量和赋存状态是影响人体健康的主要因素。一般情况下,我国大骨节病、克山病等缺硒区的土壤中总硒含量小于或等于0.125 mg/kg,土壤中水溶硒小于或等于0.002 6 mg/kg[4]。在不同地区,众多学者从地球化学和生物地球化学特征以及赋存形态等方面对土壤中硒进行了多角度的研究[5-10],研究中发现土壤中硒含量受母质和土壤形成时的地球化学环境的控制[11-12]。土壤中硒的赋存形态分析方法中较易实现和应用广泛的是连续化学浸提技术,Martens等[13]在1997年提出了较为简单的分类和提取方案,将土壤中硒的结合态分为水溶态、可交换态、有机态和不溶态4类;Kulp等[14]于2004年提出了七级连续化学浸提方案,将土壤中硒的结合态分为水溶态、可交换态、有机结合态、元素态、碳酸盐结合态、硫化物/硒化物结合态和残渣态[15]。
山西省运城市垣曲县为大骨节病区,野外调查结果表明在垣曲县历山镇存在相当数量的大骨节病患者,且病情都较为严重;同时,野外水文地球化学调查显示,该地区地下水水样中硒的含量远远低于其他非病区地下水水样中硒的含量。为了探究垣曲县历山镇大骨节病区地下水中硒含量低的原因,本文测定了该地区土壤中硒的含量和赋存形态,并通过土壤对硒的吸附试验,研究土壤中硒的迁移特征,进而了解垣曲县历山镇大骨节病区水-土体系中硒元素的化学特征。
1 样品采集与方法
1.1 样品采集
研究区位于山西省垣曲县历山镇大骨节病区,4个地下水水样(YQ01、YQ02、YQ03和YQ04)和3个土样(1个含水层岩样YQ-S-01和2个土样YQ-S-02和YQ-S-03)均采集于厉山镇常家坪村,另在运城市临猗县七级镇和运城市盐湖区金井县两个非病区采集了4个地下水水样(QJ01、QJ02和JJ01、JJ02)和2个土样(J-S-01和QJ-S-07)。采集的土样现场装入布袋子,等待进一步实验室处理;采集的地下水水样现场测量水温、pH值、电导率(EC)、氧化还原电位(Eh)、溶解氧(DO)等基本水化学参数,并取250 mL水样现场过滤后装入聚乙烯瓶中,加浓硝酸密封后放置于阴凉干燥处保存,待用。
1.2 试验材料与方法
1.2.1 试验仪器和试剂
试验仪器:AFS-2202E双道原子荧光光度计、L420台式低速离心机、恒温振荡器;消化罐、超声清洗器、水浴锅、烘箱、50 mL聚四氟乙烯离心管、50 mL和500 mL容量瓶、20 mL和10 mL移液管、烧杯、锥形瓶等。
试验试剂(优级纯):硒标准液、KBH4、HCl、去离子水、KH2PO4、K2HPO4、NaOH、Na2SO3、CH3COOH、KClO3、HNO3、HClO3。
1.2.2 土壤样品预处理
将野外采集的土样按序号整理,放在锡箔纸上于105℃烘箱中烘24 h,然后进行碾磨,过100目筛,将得到的土样移至封口袋密封,待用。
1.2.3 土壤中总硒含量的测定
称取待测土样2.00 g(过100目筛)于消解罐中,加入混合酸溶液10 mL[V(HNO3)+V(HClO3)=3+2],于160℃烘箱中消化12 h,冷却至室温,加入10 mL盐酸溶液(1+1),沸水浴加热10 min,冷却后用去离子水将消化液转入50 mL容量瓶,定容,摇匀,保留试液待测。
1.2.4 土壤中硒的连续化学浸提试验
本次采用连续化学浸提试验,将土壤中硒的结合态分为水溶态、可交换态、有机结合态、元素态、碳酸盐结合态、硫化物结合态和残渣态7种,土壤中各种赋存形态硒的提取方法如下:
(1) 水溶态硒:用天平称取经过预处理的土样1.000 0 g,置于50 mL塑料离心管中(每个土样做3个平行样),并加入20 mL去离子水,摇匀,于振荡器上振荡2 h,用离心机(3 500 r/min,10 min) 分离,将上清液转入50 mL离心管中;加入5 mL去离子水,重复上述操作步骤,合并25 mL提取液,混匀备用。
(2) 可交换态硒:向上一步的残渣中加入20 mL 0.1 mol/L K2HPO4-KH2PO4缓冲溶液(pH=7.0,配制好后静置24 h后使用),摇匀,在振荡器上振荡2 h,用离心机(3 500 r/min,10 min) 分离,将上清液转入50 mL的离心管中;加入5ml去离子水,重复上述操作步骤,合并25 mL提取液,混匀备用。
(3) 有机结合态硒:向上一步的残渣中加入20 mL 0.1 mol/L NaOH溶液,摇匀,在振荡器上振荡2 h,用离心机(3 500 r/min,10 min)分离,将上清液转入50 mL的离心管中;加入5ml去离子水,重复上述操作步骤,合并25 mL提取液,混匀备用。
(4) 元素态硒:向上一步的残渣中加入20 mL 1 mol/L Na2SO3溶液(pH=7.0,用6 mol/L HCl调节酸度,现用现配),摇匀,在振荡器上振荡30 min,混匀,超声浴3 min,重复振荡、超声1次,混匀,再超声浴2 h,用离心机(3 500 r/min,10 min)分离,将上清液转入50 mL的离心管中;加入5 mL去离子水,重复上述操作步骤,合并25 mL提取液,混匀备用。
(5) 碳酸盐结合态硒:向上一步的残渣中加入20 mL 15%CH3COOH溶液,摇匀,在振荡器上振荡2 h,用离心机(3 500 r/min,10 min) 分离,将上清液转入50 mL的离心管中;加入5 mL去离子水,重复上述操作步骤,合并25 mL提取液,混匀备用。
(6) 硫化物结合态硒:向上一步的残渣中加入0.5 g KClO3,然后缓慢加入20 mL浓HCl溶液并混匀,在通风橱中放置45 min,其间轻摇数次,用离心机(3 500 r/min,10 min) 分离,将上清液转入50 mL的聚乙烯试管中;加入5 mL去离子水,重复上述操作步骤,合并25 mL提取液,混匀备用。
(7) 残渣态硒: 残渣态硒的提取方法同土壤中总硒测定的前期处理。
1.2.5 土壤对硒的等温吸附试验
配置硒浓度分别为0 mg/L、0.2 mg/L、0.4 mg/L、0.6 mg/L、0.8 mg/L、1 mg/L、2 mg/L的硒溶液,分别取20 mL依次加入到7支装有1.000 0 g土样的50 mL塑料离心管中,各加入1滴1 mol/L 盐酸溶液,置于振荡器于25℃下振荡5 h;振荡结束后,于离心机上离心15 min(4 500 r/min),将上清液小心移出,待测。
1.2.6 土壤对硒的动力学吸附试验
称取21份0.500 0 g土样分别置于50 mL塑料离心管中;向其中的7支离心管中加入已配制的0.6 mol/L硒溶液10 mL,7支离心管中加入已配制的1 mol/L硒溶液10 mL,向最后7支离心管中加入已配制的2 mol/L硒溶液10 mL,并依次滴加1 mol/L 盐酸1滴;将离心管置于振荡器上振荡,0.5 h、1 h、2 h、3 h、4 h、6 h、8 h后分别取出初始硒浓度为0.6 mol/L、1 mol/L、2 mol/L的离心管各一支,放于离心机中离心分离15 min(4 500 r/min),将上清液小心移出,待测。
1.2.7 溶液中硒含量的测定
本次使用原子荧光光度法测定溶液中硒含量,通过测量待测元素的原子蒸气在辐射能激发下产生的荧光发射强度,来确定待测元素的含量。
2 结果与分析
2.1 研究区病区与非病区地下水的水化学特征
研究区地下水水样中主要阳离子和阴离子采用离子色谱仪(IC)进行测定,分别使用InoPac AS19阴离子分离柱和InoPac CS12阳离子分离柱;地下水水样中硒等微量元素利用电感耦合等离子体发射光谱仪(ICP-OES,iCAP 6300)进行测定。研究区病区与非病区主要地下水饮用水源中硒等微量元素含量的检测结果见表1。

表1 研究区病区与非病区主要地下水饮用水源中硒等微量元素含量的检测结果(n=4)Table 1 Determination results of selenium and other trace elements in main drinking water sources in the study area(n=4)
注:“”表示低于检出限。
由表1可见,对比研究区病区与非病区地下水水样中微量元素的含量可以发现,病区地下水水样的pH值范围为7.60~8.10,非病区地下水水样的pH值范围为7.57~7.96,都呈弱碱性;病区地下水水样的电导率范围为355~413 μs/cm,为淡水,非病区地下水水样的电导率范围为1 285~6 600 μs/cm,为咸水;病区地下水水样中硒元素的含量范围为0.0~8.8 μg/L,平均值为2.6 μg/L,远低于非病区地下水水样中硒元素的含量(范围为15.7~51.0 μg/L,平均值为31 μg/L),而且病区地下水水样中Li、Sr、Na和Mg元素的含量也远低于非病区。
2.2 研究区病区与非病区土壤中硒含量及赋存形态特征
图1为研究区病区与非病区土壤中总硒含量的柱状图,并参考前人对我国土壤中硒含量的划分标准,对研究区病区与非病区土样中总硒含量进行了划分。

图1 研究区病区与非病区土样中总硒含量的划分结果Fig.1 Division results of total selenium content in soil samples of the study area
由图1可见,研究区病区3个土样中总硒的含量范围为161.8~242.2 μg/kg,其中含水层岩样YQ-S-01中的总硒含量最低,属低硒土范围,土样YQ-S-02中的总硒含量最高,与土样YQ-S-03都属于中等硒土范围;非病区的两个土样中的总硒含量范围为182.3~225.4 μg/kg,其中土样QJ-S-07中的总硒含量较低,属于低硒土范围。总的来说,研究区病区与非病区土壤中总硒的含量水平基本相当。
对研究区病区与非病区土壤中各种赋存形态的硒含量进行分析,其结果见表2和图2。
由表2和图2可见,在研究区病区与非病区土壤中7种硒的赋存形态含量大小表现为:元素态>可交换态>有机结合态>硫化物结合态>残渣态>水溶态>碳酸盐结合态,其中土壤中元素态硒含量占总硒含量的百分比超过了50%。

表2 研究区病区与非病区土壤中各种赋存形态的硒含量及其百分比Table 2 Content and percentages of selenium species in soil/sediment samples of the study area
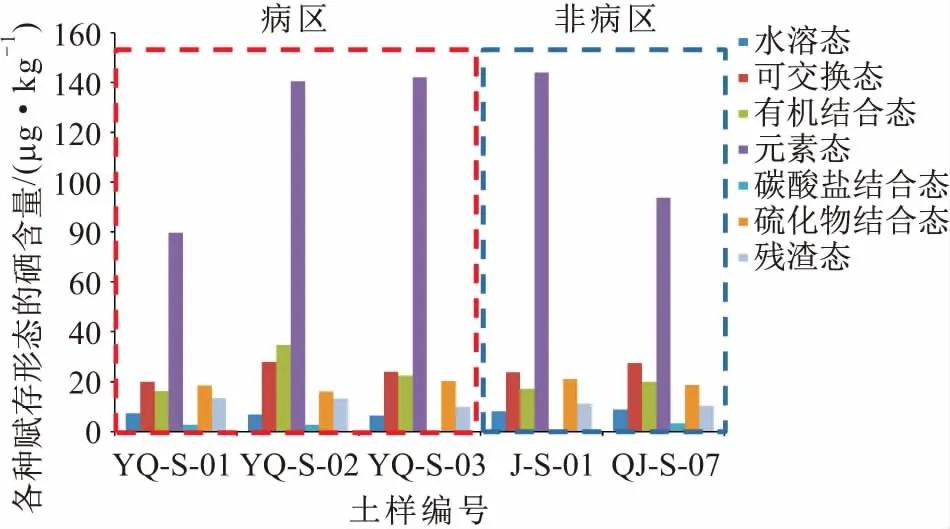
图2 研究区病区与非病区土样中的各种赋存形态的硒含量柱状图Fig.2 Histogram of selenium profile in soil samples from endemic and non-endemic areas
本文按照硒元素各种赋存形态的提取顺序对硒的每种赋存形态进行分析:
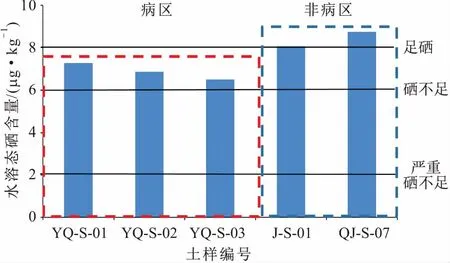
图3 研究区病区与非病区土样中水溶态硒含量的划分结果Fig.3 Division results of soluble selenium content in soil samples from endemic and non-endemic areas
(1) 水溶态硒:水溶态硒是硒在土壤中最易迁移的形态。研究区病区与非病区5个土样中水溶态硒含量都较低,其中研究区病区土样中水溶态硒平均含量为6.88 μg/kg,低于非病区土样中水溶态硒的平均含量(8.73 μg/kg);研究区病区含水层岩样YQ-S-01的水溶态硒含量占总硒含量的比例为4.65%,其他两个土样仅占2.83%和2.89%,非病区土样中水溶态硒含量占总硒含量的比例略高,分别为3.58%和4.80%。根据前人对我国土壤中硒含量的划分标准对研究区病区与非病区土样中水溶态硒含量进行了划分(见图3),结果表明:研究区病区3个土样中可溶态硒含量都在硒不足与足硒之间,而非病区2个对比土样中可溶态硒含量都在足硒以上;研究区病区土样中水溶态硒含量明显低于非病区土样中水溶态硒含量。


(4) 元素态硒:元素态硒作为土壤微生物还原亚硒酸盐或硒酸盐的产物,在氧化性土壤中易被氧化而含量极低,在还原性土壤中较为稳定,是土壤中硒的主要赋存形态。研究区病区土壤/含水介质中元素态硒的平均含量为120.81 μg/kg,非病区土样中元素态硒的均值为118.87 μg/kg,其中研究区病区含水层岩样YQ-S-01中元素态硒含量稍低,为79.78 μg/kg。
(5) 碳酸盐结合态硒:碳酸盐结合态硒属于潜在可利用态硒,是可利用态硒的直接提供者。研究区病区与非病区5个土样中碳酸盐结合态硒含量都较低,其中研究区病区岩样YQ-S-01和土样YQ-S-02以及非病区土样QJ-S-07中碳酸盐结合态硒含量稍高,分别为2.56 μg/kg、2.62 μg/kg、3.34 μg/kg,其余两个土样中其含量仅为0.10 μg/kg和0.10 μg/kg,占总硒含量的比例最小,平均占比小于1%。
(6) 硫化物结合态硒:硫化物结合态硒在研究区土样中含量较高,其中研究区病区土样中硫化物结合态硒的平均含量为18.21 μg/kg,非病区土样中硫化物结合态硒的平均含量为19.87 μg/kg。
(7) 残渣态硒:残渣态硒在研究区病区土壤/含水介质中的平均含量为12.16 μg/kg,在非病区其平均含量为10.81 μg/kg,土壤中残渣态硒平均含量占总硒含量的比例为5.81%,表明试验所用的连续化学浸提方法对土壤中硒的提取效果较好。
综上可见,作为土壤中有效态硒,水溶态硒和可交换态硒在研究区病区土壤中的含量都小于非病区;研究区病区土壤中硒主要以不易迁移转化的硒形态为主,而水溶态硒这种土壤中最易迁移的硒形态含量在总硒含量中占很少的部分,这可能是研究区病区土壤中缺硒和地下水饮用水源中硒含量低的原因之一。
2.3 土壤对硒的吸附特性研究
本研究开展了土壤中硒的吸附试验,以进一步了解土壤中硒的迁移特性。
2.3.1 土壤对硒的等温吸附试验
土壤对硒元素的吸附是一个动态平衡的过程,在一定的温度下,当吸附达到平衡时,土壤颗粒表面对硒的吸附量与溶液中硒元素的平衡浓度之间的关系可以用吸附等温线来表达。经过拟合,土壤对硒元素的吸附符合Freundlich方程,该方程的一般形式为X=K·C1/n,也可写成直线型方程[16]:
lgX=lgK+(1/n)lgC
(1)
式中:X为土壤对硒的吸附量(mg/g);C为溶液中硒的平衡浓度(mg/L);K、n为吸附常数。
将土壤对硒的吸附量(X)单位和溶液中硒的平衡浓度(C)单位分别换算为μg/g和μg/L后,该方程变为
lgX=(lgK+3/n-3)+(1/n)lgC
(2)
以lgX为y轴、lgC为x轴分别作研究区病区3个土样对硒的吸附等温线,见图4。
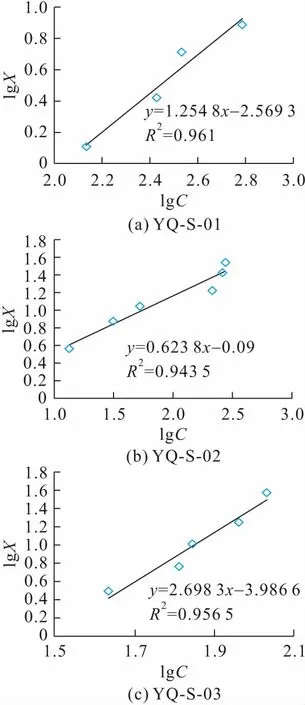
图4 研究区病区土壤/含水介质对硒的吸附等温线Fig.4 Adsorption isotherms of selenium in soil/aqueous medium in endemic areas
由图4可见,研究区病区3个土样对硒元素的吸附都符合Freundlich方程,根据公式(2)和作图得到的直线方程,可进一步计算得到研究区病区3个土样YQ-S-01、YQ-S-02和YQ-S-03对硒的吸附常数分别为:K=0.095 5,n=0.797;K=10.986,n=1.605;K=8.467,n=0.371。
2.3.2 土壤对硒的动力学吸附试验
通过对设定时间的不同初始硒浓度土样对硒的吸附量进行测定,得到不同吸附时间对应的土壤对硒的吸附量(μg/g),以时间为横坐标、对硒的吸附量为纵坐标作图,可得研究区病区土壤对硒的动力学吸附曲线,见图5。

图5 研究区病区土壤对硒元素吸附量-吸附时间的关系图Fig.5 Relationship between adsorption amount of selenium and adsorption time of soil samples in endemic areas注:土壤中初始硒浓度为2.0 mg/L时对应右侧坐标轴数据。
由图5可见,研究区病区土壤对硒的吸附平衡时间约为180 min,在到达平衡时间之前随着吸附时间的推移,研究区病区土壤对硒的吸附量呈上升趋势,在到达平衡时间后其吸附量不再增长;当土壤中初始硒浓度增加时,土壤对硒的吸附量也增加。
为了研究土壤中硒元素吸附过程的反应机理,对研究区病区土壤对硒的吸附动力学过程进行了拟合,其拟合结果见图6。

图6 研究区病区土壤对硒的吸附动力学拟合曲线Fig.6 Adsorption kinetic fitting curves of selenium in soil of endemic areas
由图6可见,研究区病区土壤对硒元素的吸附动力学能很好地拟合准二级动力学模型,其模型方程式[17-18]为
(3)
式中:qe为土壤对硒的平衡吸附量(mg/g);qt为t时刻土壤对硒的吸附量(mg/g);ks为准二级动力学吸附速率常数(h-1);t为反应时间(h)。
根据公式(3)和作图得到的直线方程(见图6),可以得到研究区病区土壤对硒的平衡吸附量qe和准二级动力学吸附速率常数ks,见表3。
由表3可知,随着土壤中初始硒浓度的增加,研究区病区土壤对硒的平衡吸附量从11.44 mg/kg增加到33.21 mg/kg,准二级动力学吸附速率常数减小,这反映出研究区病区土壤对硒具有较强的吸附能力。

表3 研究区病区土壤对硒的吸附动力学拟合结果Table 3 Kinetic fitting results of selenium adsorption to soil samples from the endemic areas
3 结 论
本文采用连续化学浸提法和原子荧光光谱法对山西省垣曲县大骨节病病区土壤中硒含量及其赋存形态进行了研究,并利用等温吸附试验和吸附动力学试验研究了土壤对硒元素的吸附特性,主要得出以下结论:
(1) 与非病区相比较,研究区病区地下水饮用水源中总硒含量偏低,平均含量为2.6 μg/L;而土壤/含水介质中的总硒含量在研究区病区与非病区没有显著差别。
(2) 提取了研究区土壤中硒的赋存形态,有水溶态、可交换态、有机结合态、元素态、碳酸盐结合态、硫化物结合态和残渣态7种,其中不可利用的元素态硒的含量最高。研究区病区土壤中较易迁移的水溶态硒和可交换态硒的平均含量分别为6.88 μg/kg和23.98 μg/kg,都明显低于非病区土壤。
(3) 研究区病区土壤/含水介质对硒的吸附等温线符合Freundlich方程,吸附动力学为准二级动力学模型。研究区病区土壤/含水介质中较低的易溶态硒含量及其对硒具有较强的吸附能力是导致该地区地下水饮用水源中硒含量低的主要原因之一。
通讯作者:高旭波(1975—),男,副教授,主要从事水文地质、地下水污染与防治、环境生物地球化学等方面的研究。E-mail:xubo.gao.cug@gmail.com

