虾肝肠胞虫环介导等温扩增法(LAMP)的建立
孙妍,董学旺,魏俊利,薛淑霞
虾肝肠胞虫环介导等温扩增法(LAMP)的建立
孙妍,董学旺,魏俊利,薛淑霞通信作者
(天津市水生动物疫病预防控制中心,天津 300221)
为建立一种快速检测虾肝肠胞虫(EHP)的环介导等温扩增法(LAMP),根据GenBank中登录的EHP-SSU基因序列设计6条特异性引物,成功建立了EHP-LAMP检测方法。该方法检出限为3.71个质粒拷贝/μL,并且与虾其他常见病毒病的病原(WSSV、IHHNV、CMNV)均无交叉反应。采用LAMP方法和常规PCR方法对30份具有典型EHP感染症状的对虾样品进行检测,结果显示:LAMP和PCR方法的阳性检出率均为100%。结果表明,建立的EHP-LAMP方法具有高灵敏度、高特异性、高准确度的优点,为对虾肝肠胞虫的快速早期诊断奠定基础。
对虾;肝肠胞虫;环介导等温扩增;检测
虾肝肠胞虫(, EHP)又称肠胞虫,属于微孢子虫,于2009年在泰国养殖的生长缓慢的斑节对虾()中首次被分离和命名[1],主要感染南美白对虾()、中国对虾()、斑节对虾()等重要养殖对虾,是近几年新发现的寄生于对虾肝胰腺组织的新病原。早期感染EHP的对虾一般不会立即出现死亡,也没有明显的症状,仍然可以正常摄食,且体色正常,使得该病很难在养殖前期发现,通常养殖30~45 d后才会出现生长缓慢或生长停滞的症状[2-3],且EHP的感染会导致对虾消瘦,大小和重量不均[4],造成一定的经济损失。因此,在养殖生产中也将患病虾称作“老头虾”。自2013年以来,我国广东、浙江、江苏、辽宁、天津等地区的南美白对虾苗种和养殖虾的EHP阳性检出率逐年升高,几乎成为这些地区的主要流行病原[5-7],严重影响了我国对虾进出口贸易和对虾养殖产业的发展。因此,建立快速、有效、准确的检测方法对及时发现EHP携带和感染对虾、减少病原传播扩散有积极意义。
环介导等温扩增(Loop mediated isothermal amplification,LAMP)技术是Notomi等[8]创建的另一种形式的核酸扩增技术,针对靶基因的6个不同区域,同时使用3对引物对靶基因进行扩增,6个区域中任何区域与引物不匹配均不能完成扩增反应。因此,LAMP的特异性和敏感性均比PCR 高。LAMP仅要求一台可调的恒温水浴锅等类似的简单仪器,不苛求昂贵的仪器设备,能在60 min内完成反应,扩增产物无需电泳分析,直接肉眼观察,操作简单,非专业技术人员同样可以完成检测,更适合于基层或现场快速诊断。目前,该技术已应用于生物医学各个领域,对虾白斑综合症病毒和传染性皮下及造血组织坏死病毒的LAMP快速检测方法也已经广泛应用于实际生产[9-10]。本研究拟建立EHP-LAMP可视化快速检测方法,为EHP的苗种检疫、生产监测和流行病学调查分析提供技术支持。
1 材料与方法
1.1 主要的试验材料和仪器设备
采自天津市东丽区某养殖场的南美白对虾样品,具有典型的EHP感染症状,经PCR检测[11]并测序后确认为EHP感染,由本实验室保存;经检测未感染EHP的对虾基因组、仅感染对虾白斑病毒(WSSV)的对虾基因组、仅感染对虾皮下及造血组织坏死病毒(IHHNV)的对虾基因组、仅感染偷死野田村病毒(CMNV)的对虾RNA均由本单位病原检测室提供;海洋动物组织基因组DNA提取试剂盒购自天根生物;10 mmol/L dNTP、质粒提取试剂盒均购自大连宝生物(TakaRa);Bst DNA聚合酶(NEB)、钙黄绿素染料(北京蓝谱)、甜菜碱(Sigma)。PCR仪(ABI)、凝胶成像系统(Biometra)、金属浴(天根生物)、离心机(Sigma)、电泳仪(北京六一)。
1.2 方法
1.2.1 LAMP引物设计与合成
根据GenBank发布的EHP基因序列及相关文献资料,选取EHP-SSU(登录号:FJ496356.1)为靶基因,按照LAMP引物设计原则,使用在线设计软件Primer Explorer version 5(http:// primerexplorer.jp/e)设计6条引物(表1),分别为外引物F3/B3,内引物FIP/BIP和环引物LF/LB,引物由上海生工合成。

表1 EHP-LAMP引物序列表
1.2.2 LAMP反应条件优化
按照海洋动物组织基因组DNA提取试剂盒说明书提取感染EHP对虾的基因组DNA,作为LAMP扩增反应的模板。EHP-LAMP的基础反应体系(25 μL):2.5 μL 10×DNA聚合酶buffer,3.5 μL 10 mmol/L dNTP,1.5 μL 100 mmol/L MgSO4,0.4 μL 100 μmol/L FIP,0.4 μL 100 μmol/L BIP,0.2 μL 100 μmol/L LF,0.2 μL 100 μmol/L LB,0.05 μL 100 μmol/L F3,0.05 μL 100 μmol/L B3,8 UnitsDNA聚合酶,1 μL钙黄绿素染料,3 μL 5 mol/L甜菜碱,灭菌水适量,2 μL模板。基础反应条件:63 ℃ 60 min,80 ℃ 10 min。为了能得到最佳扩增效果,在基础反应体系上对其可能影响较大的试剂,如甜菜碱、dNTP、MgSO4、DNA聚合酶等的用量及反应条件进行优化。
1.2.3 LAMP反应体系的灵敏度试验
将用于EHP-LAMP引物设计的SSU基因序列与pUC57载体连接,构建SSU-pUC57质粒,质粒构建工作由上海生工完成。利用质粒提取试剂盒提取SSU-pUC57质粒,利用核酸检测仪测定所提取质粒的初始浓度,根据公式:质粒拷贝数/μL=质粒浓度(g/μL)/质粒分子量×阿佛加德罗常数,计算出SSU-pUC57质粒拷贝数为3.71×109,用灭菌水按10倍递进稀释法将质粒稀释至3.71个质粒拷贝/μL,取2 μL各浓度稀释液分别进行LAMP和PCR扩增(以F3/B3为上下游引物进行PCR扩增,产物大小为191 bp),比较两种方法的最低检测量。
1.2.4 LAMP反应体系的特异性试验
将本单位病原检测室提供的仅感染WSSV的对虾基因组、仅感染IHHNV的对虾基因组、仅感染CMNV的对虾RNA(反转录成cDNA后作为模板)以及感染EHP的对虾基因组,及同时设阴性对照和阳性对照(SSU-pUC57质粒),按照上述建立的LAMP方法进行EHP-LAMP检测体系的特异性分析。
1.2.5 临床样品的检测
同时利用本研究建立的EHP-LAMP检测技术和PCR方法,分别对挑选出的30尾具有典型感染EHP症状的对虾进行检测,并将这两种方法得到的结果进行比较。
2 结果
2.1 EHP-LAMP的优化结果
试验结果综合分析发现,甜菜碱、MgSO4和dNTP的加入量对EHP-LAMP反应体系的扩增效率影响较大。最终确定EHP-LAMP的最佳反应体系为:2.5 μL 10×Bst DNA聚合酶buffer,2.5 μL 10 mmol/L dNTP,2 μL 100 mmol/L MgSO4,0.4 μL 100 μmol/L FIP,0.4 μL 100 μmol/L BIP,0.2 μL 100 μmol/L LF,0.2 μL 100 μmol/L LB,0.05 μL 100 μmol/L F3,0.05 μL 100 μmol/L B3,8 Units Bst DNA聚合酶,1 μL钙黄绿素染料,1 μL 5 mol/L甜菜碱,2 μL模板灭菌水定容总体积至25 μL。反应条件为:63 ℃ 40 min,80 ℃ 5 min。在此条件下,LAMP扩增的产物经过琼脂糖凝胶电泳检测及肉眼观察反应液颜色变化结果见图1。

图1 EHP-LAMP检测结果
注:图A为EHP-LAMP电泳检测图,其中,M为DNA marker,1为EHP阳性结果,2为EHP阴性结果;图B为EHP-LAMP肉眼观察结果,其中,1为EHP阳性结果,2为EHP阴性结果
2.2 灵敏度试验结果
利用优化条件后的EHP-LAMP和PCR检测方法对不同稀释倍数的模板进行扩增,结果显示:LAMP检测方法的检出限为3.71个质粒拷贝/μL,PCR检测方法的检出限为371个质粒拷贝/μL,LAMP检测方法的灵敏度高于PCR(图2)。
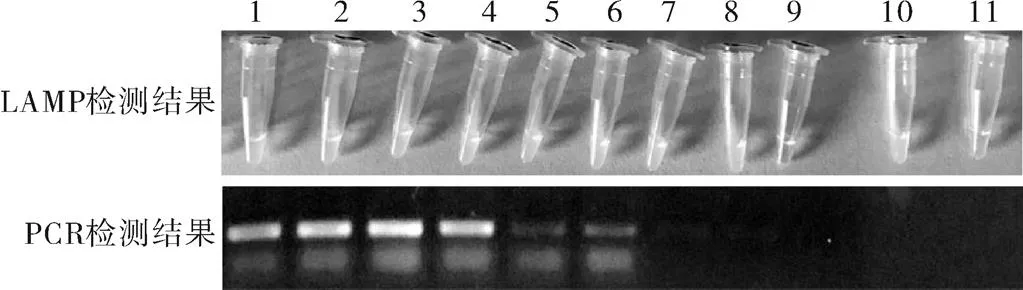
图2 EHP-LAMP灵敏度检测结果
注:1为3.71×109;2为3.71×108;3为3.71×107;4为3.71×106;5为3.71×105;6为3.71×104;7为3.71×103;8为3.71×102;9为3.71×101;10为3.71;11为阴性对照
2.3 特异性试验结果
利用优化条件后的EHP-LAMP反应体系对含有WSSV、IHHNV、CMNV和EHP的对虾基因组及SSU-pUC57质粒进行检测,结果显示:只有含有EHP对虾基因组和SSU-pUC57质粒出现阳性扩增,而含有WSSV、IHHNV和CMNV的对虾基因组以及阴性对照检测结果为阴性(图3),表明建立的EHP-LAMP方法与对虾其他常见病毒病的病原均无交叉反应,特异性良好。

图3 EHP-LAMP反应体系特异性检测结果
注:1为SSU-pUC57质粒;2为含有EHP的对虾基因组;3为含有WSSV的对虾基因组;4为含有IHHNV的对虾基因组;5为含有CMNV的对虾cDNA;6为阴性对照
2.4 临床样品检测结果
利用优化条件后的EHP-LAMP和PCR方法分别对30份具有典型EHP感染症状的对虾样品进行检测,同时设立阳性和阴性对照。结果显示:EHP-LAMP和PCR方法的阳性检出率均为100%,其中5份样品PCR检测条带较弱,为弱阳性。LAMP和PCR检测结果见表2。
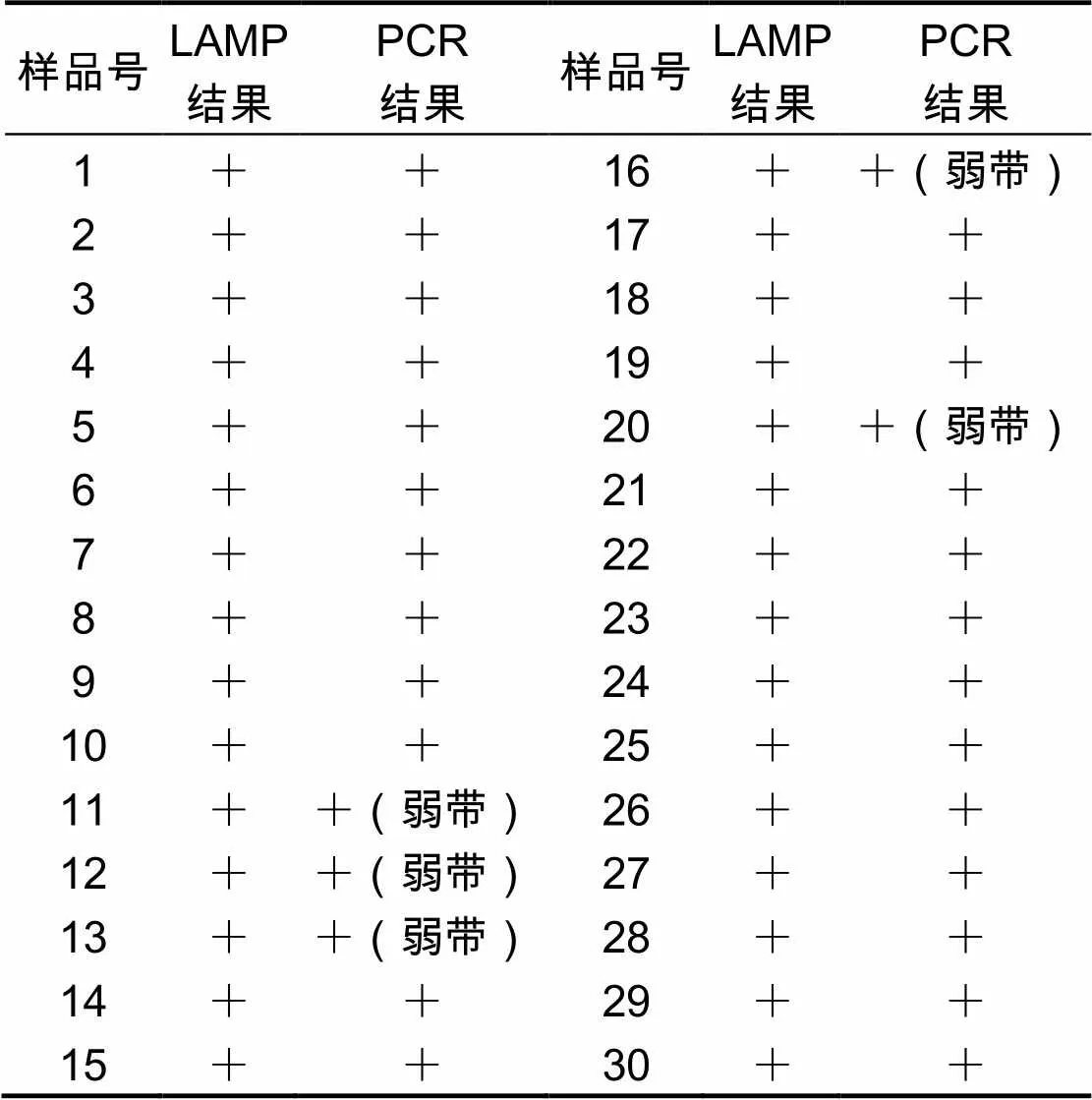
表2 LAMP和PCR检测对虾病样的结果比较
3 讨论
EHP属于微孢子虫,其个体小于细胞,很难通过显微镜观察到,重症感染的对虾肝胰腺在常规苏木精-伊红(HE)染色下也很难观察到特征性病理变化[1],而通过原位杂交则能显示对虾感染EHP后其肝胰腺小管上皮细胞中存在明显杂交信号[12],因此分子检测是微孢子虫的有效检测手段。目前,相关EHP检测方法主要包括实时荧光定量PCR法[13]、普通PCR法[14]、巢式PCR法[11]等,而这些检测手段需要专业的技术操作人员在专业的分子实验室中才能完成。我国2013—2015年的养殖对虾EHP携带情况调查数据显示:EHP具有较高的阳性检出率[15],已经成为导致对虾生长缓慢的主要病原。EHP主要侵染虾苗和幼虾,且在感染早期没有明显症状,在购买苗种的时候很难引起人们的注意,严重影响了虾农的经济收益。因此,建立一种快速、简便、适用于实际生产的EHP检测方法十分必要。本文根据环介导等温扩增(LAMP)原理,基于SSU基因设计6个引物,建立了快速检测EHP的LAMP方法。该方法仅35~40 min即可达到反应的平台期;对反应装置要求较低,恒温水浴锅、金属浴或PCR仪均能作为LAMP的恒温反应装置,非常适用于生产一线使用;结果观察简单,反应完毕用肉眼观察反应液的颜色变化即可判断结果;特异性良好,与对虾常见病毒均无交叉反应;灵敏度是普通PCR方法的100倍。通过30份样品的检测结果比较发现,LAMP法与PCR法的检测结果符合率为100%,PCR法检测结果为弱阳性的样品,LAMP法的检测结果仍然为阳性,与其他阳性样品的显色并无差异,证明LAMP法的准确率高且比PCR法更加灵敏。
EHP具有垂直传播和水平传播两种感染方式,且与其他疾病的重要区别是EHP可通过同类间的残食实现水平传播[16],这使得控制养殖池中的疾病扩散变得尤为困难,截止目前,还没有治疗该疾病的药物。因此养殖过程中需要认真关注重要的易感染环节,从苗种检测、饲料检测、饵料控制、水体等方面控制EHP的传播和发病。上述建立的EHP-LAMP法满足了对虾养殖中对EHP快速检测的需要,为EHP的早期诊断及防控技术研究和效果评估等方面提供了技术支撑。
[1] Tourtip S,Wongtripop S,Stentiford G D,et al.sp. nov.(Microsporida: Enterocytozoonidae),a parasite of the black tiger shrimp(Decapoda: Penaeidae):Fine structure and phylogenetic relationships[J]. J Invert Pathol,2009,102(1):21-29.
[2] 骆云慧,石坚,方磊,等. 虾肝肠胞虫TaqMan实时荧光定量PCR检测方法的建立及应用[J]. 中国兽医科学,2016,46(7):847-852.
[3] 施慧,许文军,谢建军,等. 舟山地区大棚凡纳滨对虾生长缓慢病因的调查分析[J]. 中国水产科学,2017,24(2):387-394.
[4] 刘雅梅,邱亮,程东远,等. 检出虾肝肠胞虫()的凡纳滨对虾()群体的体长和体重关系[J]. 渔业科学进展,2017,38(4):96-103.
[5] 刘珍,张庆利,万晓嫒,等. 虾肝肠胞虫()实时荧光定量PCR检测方法的建立及对虾样品的检测[J]. 渔业科学进展,2016,37(2):119-126.
[6] 王博雅,王力,刘美如,等. 凡纳滨对虾3种主要病毒和虾肝肠胞虫在辽宁地区的流行情况分析[J]. 大连海洋大学学报,2017,32(2):150-154.
[7] 陈禄芝,余霞艳,胡一丞,等. 粤西地区凡纳滨对虾虾肝肠胞虫、传染性皮下和造血组织坏死病毒感染情况的初步调查[J]. 渔业研究,2016,38(4):273-280.
[8] Notomi T,Okayama H,Masubuchi H,et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research,2000,28(12):e63.
[9] 庞耀珊,谢芝勋,谢丽基,等. 对虾白斑综合症病毒可视化环介导等温扩增(LAMP)检测技术的建立与应用[J]. 农业生物技术学报,2013,21(8):1002-1008.
[10] 李红梅,江晓,任春华,等. 对虾传染性皮下及造血组织坏死病毒实时荧光LAMP检测方法的建立及应用[J]. 热带生物学报,2016,7(3):307-313.
[11] Jaroenlak P,Sanguanrut P,Williams B A,et al. A nested PCR assay to avoid false positive detection of the microsporidian(EHP)in environmental samples in shrimp farms[J]. Plos One,2016,11(11):e0166320.
[12] Tanga K F,Pantoja C R,Redman R M,et al. Development of in situ hybridization and PCR assays for the detection of(EHP),a microsporidian parasite infecting penaeid shrimp[J]. J Invertebr Pathol,2015,130:37-41.
[13] 张娜,谢艳辉,陈进会,等. 虾肝肠胞虫Taqman荧光PCR方法的建立与应用[J]. 中国动物检疫,2017,34(10):98-103.
[14] Rajendrana K V,Shivam S,Praveena P Eet al. Emergence of(EHP)in farmed()in India[J]. Aquaculture,2016,454:272-280.
[15] 刘宝彬,杨冰,吕秀旺,等. 凡纳滨对虾()传染性皮下及造血组织坏死病毒(IHHNV)及虾肝肠胞虫(EHP)的荧光定量PCR检测[J]. 渔业科学进展,2017,3(2):158-166.
[16] Tangprasittipap A,Jiraporn S,Chouwdee S,et al. The microsporidianis not the cause of white feces syndrome in whiteleg shrimp()[J]. BMC Veterinary Research,2013,9(1):139.
责任编辑:张爱婷
Establishment of a LAMP assay for detection of
SUN Yan, DONG Xue-wang, WEI Jun-li, XUE Shu-xiaCorresponding Author
(Tianjin Diseases Prevention and Control Center of Aquatic Animals, Tianjin 300221, China)
In order to develop a rapid method for detecting the(EHP), a loop-mediated isothermal amplification (LAMP) assay was established for targetinggene with six specific primers following the optimization of the reaction. The results showed that the lowest limit detection of EHP-LAMP assay was 3.71 copies/μL, then its specificity was verified, and no cross-reactions was found for other shrimp pathogenic viruses including WSSV, IHHNV and CMNV. Moreover, 30 samples of shrimp with typical EHP infection symptoms were detected with the LAMP and PCR method, respectively. The results showed that the positive rates of LAMP and PCR were both 100%. In conclusion, the EHP-LAMP method is suitable for EHP early diagnosis with the advantages of high sensitivity, specificity and accuracy.
shrimp;(EHP); loop-mediated isothermal amplification (LAMP); detection
Q786;S917.4
A
2018-01-31
天津市农业科技成果转化与推广项目(201502070)
孙妍(1985-),女,工程师,硕士,主要从事水产动物病害学方面研究。E-mail:sunyan19850409@aliyun.com。
薛淑霞(1979-),女,副研究员,博士,主要从事水产动物分子免疫学研究。E-mail:xueshuxia_79@126.com。
1008-5394(2018)02-0051-04
10.19640/j.cnki.jtau.2018.02.013

