樱桃李休眠芽提早萌发及茎段灭菌培养研究
侍艺,柴慈江,冯涛,黄蕾
樱桃李休眠芽提早萌发及茎段灭菌培养研究
侍艺,柴慈江通信作者,冯涛,黄蕾
(天津农学院 园艺园林学院,天津 300384)
为探讨赤霉素对樱桃李休眠芽萌发的促进效果及樱桃李茎段灭菌培养技术。将12月上旬和1月中旬采集的樱桃李一年生休眠枝用赤霉素药液浸泡后进行水培萌芽试验;用次氯酸钠和酒精对樱桃李茎段外植体灭菌后接种于不同培养基中进行培养。结果表明,与清水浸泡相比,赤霉素(100 mg/L或200 mg/L)浸泡1或2 h,可明显促进樱桃李休眠芽提早萌发,并增加嫩梢长度,赤霉素(100 mg/L或200 mg/L)浸泡2 h可明显提高12月上旬采集的樱桃李休眠枝的萌芽率。结合酒精浸蘸,用次氯酸钠(2%)对樱桃李休眠枝水培萌生的嫩梢茎段浸泡6~9 min、对春季采集的樱桃李田间当年生新梢茎段浸泡10~25 min,污染率接近于0,存活率为100%。在附加6-BA 0.5 mg/L的MS培养基中,樱桃李休眠枝水培萌生茎段的萌芽率达到71.4%、春季田间新梢茎段的萌芽率达到80.0%~95.5%。本研究可以为延长樱桃李外植体取材时间和完善其外植体灭菌培养技术提供参考。
樱桃李;休眠芽;赤霉素;茎段;灭菌;培养
樱桃李(Ehrh.)为蔷薇科李亚科李属植物,是一种重要的野生果树资源,在我国仅分布于新疆,在新疆霍城县大西沟较开阔的河流岸边有小面积的纯林。新疆野生樱桃李在《中国珍稀濒危保护植物名录》中,被列为国家Ⅱ级重点保护物种和自治区Ⅱ级重点保护物种,在生物多样性中是具有国际意义的优先保护物种[1]。
樱桃李营养全面且价值较高,其果实的K含量很高,氨基酸丰富,可滴定酸和可溶性固形物水平较高,富含维生素以及胡萝卜素[2]。张士康等将樱桃李与蓝莓进行营养成分的对比,发现樱桃李某些营养指标高于蓝莓,认为其开发利用的前景较好[3]。刘伟等研究表明,樱桃李叶提取物有不同程度的抗氧化活性和α-葡萄糖苷酶抑制活性,具有开发治疗糖尿病降血糖药物的价值[4]。张静茹等发现,樱桃李果实在多酚组成和含量上存在丰富的多样性,酚类物质以原花青素B1、儿茶素、绿原酸、原花青素B2、表儿茶素和原花青素C为主,并且筛选出具有较高多酚含量的株系[5]。
大量培育樱桃李优质苗木对于樱桃李资源保护及其优良单株的引种推广具有重要意义。植物组织培养快速繁殖技术具有繁殖速度快、有利于无病毒苗木培育及工厂化规模化育苗等诸多优点[6]。采用植物组织培养快速繁殖技术是快速获得樱桃李大量优质苗木的有效途径。但是,目前关于樱桃李组织培养快速繁殖技术的研究仅见少数报道[7-9],该项技术尚不成熟。本项研究旨在探讨赤霉素促进樱桃李休眠芽萌发及樱桃李茎段的灭菌培养技术,为完善樱桃李外植体灭菌技术环节提供参考,同时获得樱桃李无菌试管苗材料,为进一步研究其试管苗的增殖、生根及移栽技术奠定基础。
1 材料与方法
1.1 材料
试验所用材料取自引自新疆并种植于天津农学院实验园内的樱桃李(Ehrh.)5年生植株。
1.2 方法
1.2.1 赤霉素促进樱桃李休眠芽提早萌发试验
2016年12月8日,取樱桃李1年生休眠枝,用赤霉素(GA3)溶液进行浸泡处理,以探讨赤霉素对休眠芽萌发的影响。试验共设以下4个处理:GA3(100 mg/L)浸泡1 h,GA3(100 mg/L)浸泡2 h,GA3(200 mg/L)浸泡1 h,GA3(200 mg/L)浸泡2 h,清水浸泡1 h。浸泡时将整个枝条完全浸入赤霉素溶液(或清水)中,浸泡后将枝条基部浸入水中约5 cm进行水培,每隔3~4 d换一次水,换水时将枝条基部在水中剪去约1 cm,然后将枝条浸泡部位的表面用酒精(70%)擦拭后继续水培。水培过程中每5 d调查一次萌芽率,每处理所有枝条上浸水部位以上的芽数之和为调查的总芽数,萌芽率等于每次调查的萌芽数占总芽数的百分数,每处理调查的总芽数均大于120个芽。水培2周后,每处理选取10个较长的嫩梢调查萌发嫩梢的长度,并调查可用嫩梢率,可用嫩梢率是指茎长≥2 mm的嫩梢占萌芽总数的百分数,因为茎长≥2 mm的嫩梢比较方便用于灭菌接种。水培场所位于向阳室内窗前的暖器旁,温度为20~27 ℃。
2018年1月18日再取樱桃李1年生休眠枝,设GA3(200 mg/L)浸泡2 h和清水浸泡2 h两个处理,重复上述试验过程,按同样方法调查萌芽率、嫩梢长度和可用嫩梢率。
1.2.2 樱桃李水培枝萌发茎段灭菌接种培养试验
将试验1.2.1中樱桃李休眠枝萌芽形成的嫩梢剪下进行灭菌接种培养试验。灭菌方法设3个处理:次氯酸钠(2%)浸泡6 min,酒精(70%)蘸2~3 s+次氯酸钠(2%)浸泡6 min,酒精(70%)蘸2~3 s+次氯酸钠(2%)浸泡9 min。每个处理在次氯酸钠浸泡后均用无菌水冲洗4次,在酒精浸蘸后用无菌水冲洗1次、用滤纸吸干表面水分再放入次氯酸钠溶液中浸泡,并用酒精浸蘸后再将嫩梢从母枝上剪下,以免伤口吸收过多的酒精。每个处理经过灭菌后的嫩梢均剪成约1 cm长的茎段并分别接种于下列4种培养基上,即3/4MS+6-BA 1.0 mg/L+IBA 0.3 mg/L,3/4MS+6-BA 1.0 mg/L+IAA 0.3 mg/L,1/2MS+IBA 0.3 mg/L,MS+6-BA 0.5 mg/L。接种后在培养室培养,培养条件为:温度22~28 ℃,光照1 500~2 000 lx,每天光照14 h。
在培养室培养1周后,每处理随机调查30个接种茎段统计污染率和存活率。污染率等于污染茎段数占调查茎段数的百分数,存活率等于存活茎段数占调查茎段数的百分数,茎段存活的标志是无褐化、保持接种时的新鲜绿色。
培养3周后,调查4种培养基上未污染茎段的萌芽状况。
1.2.3 樱桃李春季田间萌发新梢茎段灭菌接种培养试验
2017年5月下旬,取樱桃李田间当年萌生的半木质化新捎,去掉叶片,剪成长度略小于灭菌液容器直径的茎段,进行灭菌处理。灭菌时先将茎段用70%酒精蘸2~3 s,用无菌水冲洗后晾干,然后再放入次氯酸钠(2%)浸泡,在次氯酸钠(2%)溶液中浸泡的时间设4个处理,分别是10、15、20、25 min,在次氯酸钠溶液中浸泡后用无菌水冲洗4次,然后将茎段剪成长度约1.5 cm、带1~2个芽的茎段接种于培养基上,培养基为附加6-BA 0.5 mg/L的MS培养基,接种后于培养室培养,培养2周后调查茎段的污染率和萌芽情况。
2 结果与分析
2.1 赤霉素对樱桃李休眠芽萌发的影响
赤霉素浸泡处理对樱桃李休眠芽萌发及嫩梢生长的影响效果见图1、图2和表1。
由图1可见,水培5 d时,所有赤霉素浸泡处理的樱桃李休眠芽萌发率均达到10%以上,其中赤霉素(200 mg/L)浸泡2 h处理萌芽率接近25%,而清水浸泡处理几乎没有芽萌动。水培10 d后,所有赤霉素浸泡处理萌芽率达到15%以上,赤霉素(200 mg/L)浸泡2 h处理萌芽率达到其最高值37.3%,清水浸泡处理萌芽率此时仅为5%左右。上述结果表明,与清水浸泡相比,本试验中所有赤霉素浸泡处理均可以促进樱桃李休眠芽提早萌发,其中以赤霉素(200 mg/L)浸泡2 h处理效果最好。
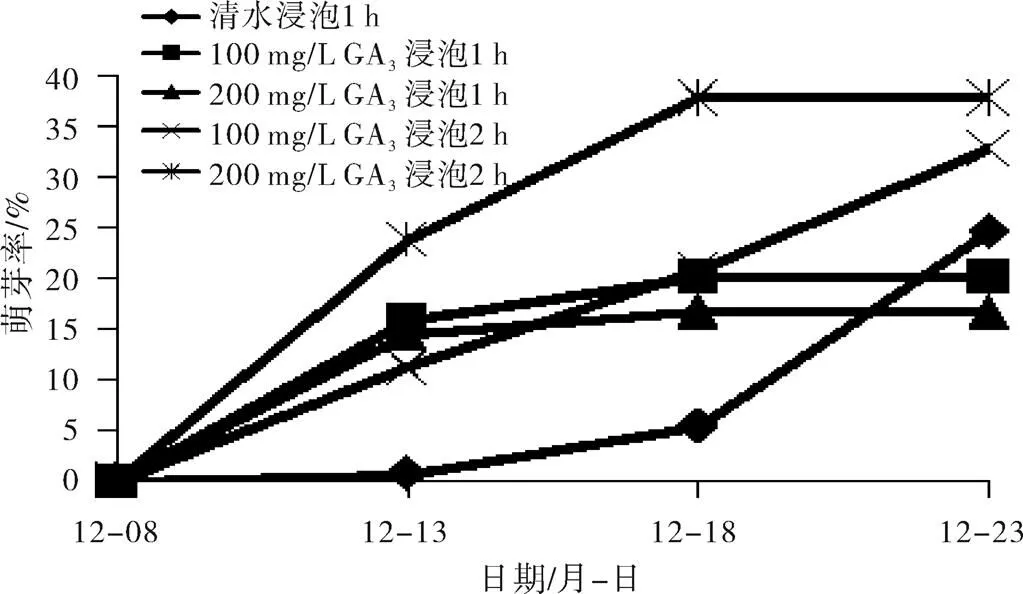
图1 赤霉素(GA3)溶液浸泡后樱桃李休眠芽的萌发动态(一)
图2中也可以看出,赤霉素(200 mg/L)浸泡2 h处理的萌芽时间比清水浸泡处理的明显提前,这与图1结果相似。与图1不同的是,图2中无论是赤霉素浸泡还是清水浸泡其萌芽都明显早于图1。图2中赤霉素浸泡处理的萌芽率在水培3 d时就达到了35%左右,在水培5 d时则接近50%,清水浸泡处理的萌芽率在水培5 d时也达到25%左右。这一结果表明,1月18日取样的樱桃李休眠枝可以明显比12月8日取样的提早萌芽,其原因可能是1月18日取样的樱桃李休眠芽获得了较多的打破休眠所需的低温,其休眠已经部分解除的缘故。
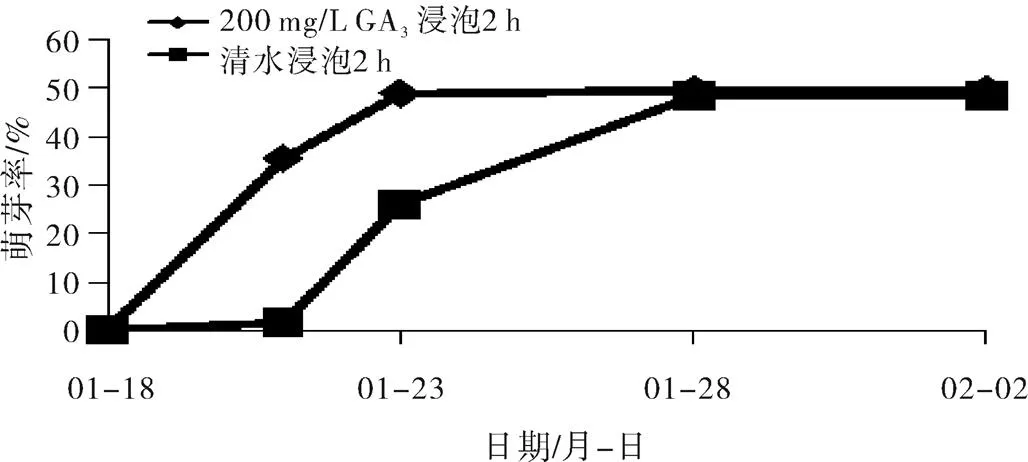
图2 赤霉素(GA3)溶液浸泡后樱桃李休眠芽的萌发动态(二)
由表1可见,水培2周后,对于12月8日取样的樱桃李休眠枝,赤霉素(200 mg/L)浸泡2 h和赤霉素(100 mg/L)浸泡2 h处理的萌芽率较高,分别为37.7%和32.8%,这两者之间差异不显著,但均显著高于其他3个处理。两个赤霉素浸泡1 h的处理与清水浸泡之间的萌芽率无显著差异。结果表明,与清水浸泡相比,不同浓度赤霉素浸泡2 h的处理不仅可以促使樱桃李休眠芽提早萌发,而且可以明显提高萌芽率。对于1月18日取样的樱桃李休眠枝,水培2周后,赤霉素(200 mg/L)浸泡2 h处理与清水浸泡之间萌芽率无显著差异,均明显高于12月8日取样的萌芽率,其原因可能仍然与其获得低温量较多、部分解除休眠有关。
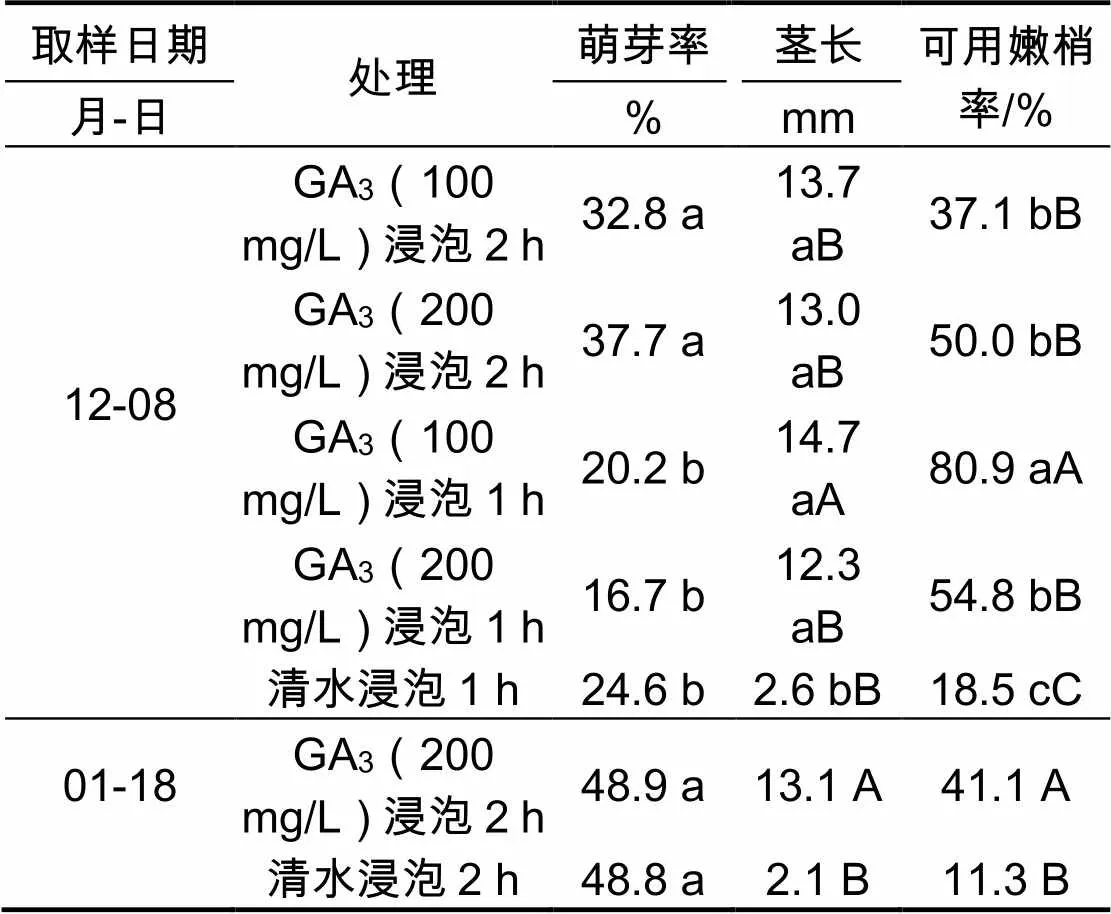
表1 赤霉素对樱桃李休眠芽萌发和萌生嫩梢茎长的影响(水培2周后调查)
注:表内数据后大写字母不同表示1%水平差异极显著,小写字母不同表示5%水平差异显著。下同
由表1还可看出,水培2周后,无论是12月8日取样还是1月18日取样,赤霉素浸泡处理的樱桃李休眠芽萌发后形成的嫩梢长度及可用嫩梢率均显著或极显著地高于清水浸泡,其原因一方面可能是赤霉素浸泡处理促进了樱桃李休眠芽提早萌发,因而增多了嫩梢的生长时间;另一方面的原因可能是因为赤霉素具有促进茎加长生长的作用。
综合上述,与清水浸泡相比,赤霉素(100 mg/L或200 mg/L)浸泡1 h或2 h,可以明显促进樱桃李休眠芽提早萌发和嫩梢的加长生长,并明显提高可用嫩梢率,赤霉素(100 mg/L或200 mg/L)浸泡2 h还可以明显提高12月上旬取样的樱桃李休眠枝的萌芽率,赤霉素处理的这些结果可以导致获得更多的用于灭菌接种的茎段外植体,这对于完善樱桃李组培快繁中的外植体灭菌接种技术环节具有实践意义。
2.2 酒精和次氯酸钠对樱桃李水培萌发茎段的灭菌效果
樱桃李水培萌发茎段的灭菌试验结果见表2。
由表2可见,对于樱桃李水培萌发形成的嫩梢,在用次氯酸钠灭菌前用酒精(70%)浸泡2~3 s(蘸一下)处理的污染率极显著地低于未用酒精浸泡的处理,其原因一方面可能是酒精(70%)本身具有较强的杀菌效果,另一方面可能是酒精能够帮助次氯酸钠药液更好地展着于外植体表面,提高了次氯酸钠的灭菌效果。用酒精(70%)浸蘸后,再用次氯酸钠(2%)药液浸泡6 min和9 min均可使外植体的污染率降低为0,而且外植体的存活率均为100%,没有造成对外植体的伤害,表明这两种灭菌方法对于樱桃李水培萌发嫩梢都是适宜的。而从经济角度考虑,以酒精(70%)浸蘸结合次氯酸钠(2%)浸泡6 min的灭菌方法更好。
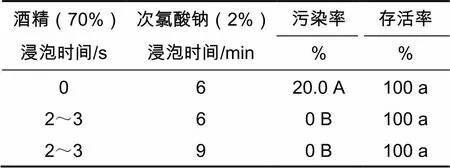
表2 酒精和次氯酸钠对樱桃李水培萌发茎段灭菌效果的影响
2.3 不同培养基对樱桃李茎段初代培养的影响
樱桃李茎段在不同培养基上的萌芽状况调查结果见表3。
由表3可见,樱桃李茎段在MS+6-BA(0.5 mg/L)培养基上的萌芽率最高为71.4%,在3/4MS+6-BA(1.0 mg/L)+IBA(0.3 mg/L)培养基上的萌芽率居第二为64%,这两者之间萌芽率差异不显著,但均极显著高于3/4MS+6-BA(1.0 mg/L)+IAA(0.3 mg/L)和1/2MS+IBA(0.3 mg/L)两种培养基上的萌芽率。后两种培养基上的萌芽率之间差异也不显著。结果表明,对于樱桃李茎段的初代培养,可以采用MS+6-BA(0.5 mg/L)培养基或3/4MS+6-BA(1.0 mg/L)+IBA(0.3 mg/L)培养基,这两种培养基均可获得较高的萌芽率,其中以MS+6-BA(0.5 mg/L)培养基更好,因为该培养基使用的植物激素种类少且含量更低。
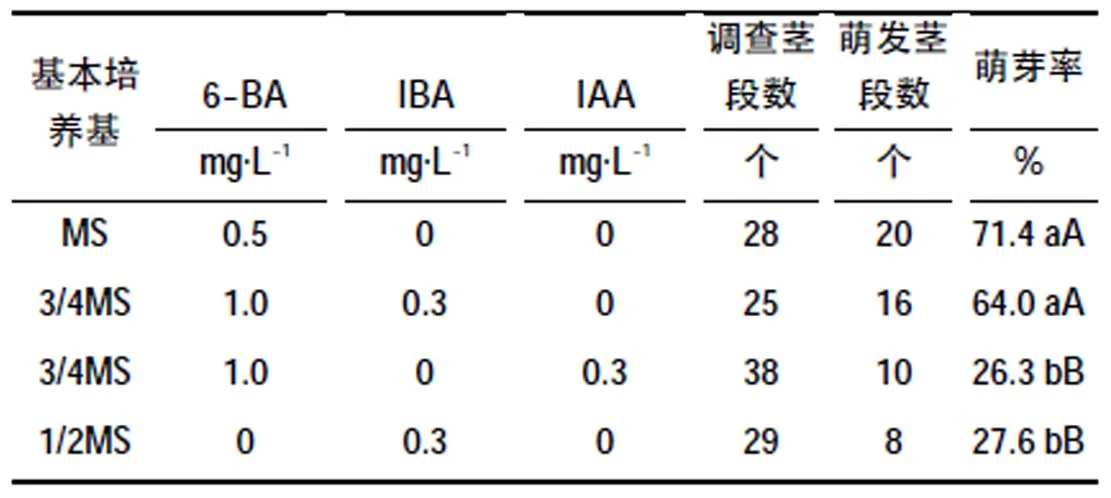
表3 不同培养基对樱桃李茎段初代培养效果的影响
2.4 次氯酸钠对樱桃李田间当年萌发茎段的灭菌效果
次氯酸钠对樱桃李当年新梢茎段的灭菌效果见表4。
由表4可见,对于5月下旬田间采集的樱桃李当年生新梢茎段,用酒精(70%)浸蘸后,次氯酸钠(2%)不同的浸泡时间处理之间在接种茎段的污染率、存活率和萌芽率等指标上均没有显著差异,而且污染率小于5%、存活率达到100%、萌芽率达到80%以上,结果表明次氯酸钠(2%)浸泡时间在10~25 min之间均可以达到比较理想的茎段灭菌效果,而从经济角度考虑,以次氯酸钠(2%)浸泡10 min更好。

表4 次氯酸钠浸泡时间对樱桃李田间当年新梢茎段灭菌效果的影响
3 讨论与结论
外植体的灭菌培养是植物离体快速繁殖技术的首要环节,而带芽茎段是木本植物离体快繁中较为常用的外植体,因其遗传稳定、易于培养且便于灭菌操作[6]。木本植物茎段外植体适宜的采集时间受到季节的影响而比较短暂,一般认为5月份是最佳时期,这时可以采集当年生新梢茎段做外植体,带菌量小易于灭菌,且枝条生长旺盛。秋季采集的茎段带菌量大不易灭菌,休眠期的茎段灭菌更为困难且萌芽率低,这两个时期都不适合采集茎段直接灭菌培养。为延长茎段外植体的取材时间,人们也做了一些尝试。延志莲等3月初采集大木枣休眠枝进行水培,萌芽率可达95.8%,对萌发的嫩梢灭菌培养获得了较为理想的结果[10]。赵锦等研究表明,12月份至次年3月份采集枣休眠枝进行水培,萌芽率达到90%以上,对水培萌发的嫩梢灭菌培养后,其灭菌效果明显好于7、8月份田间采集的茎段并与5、6月份田间采集的茎段相当[11]。这两项研究也指出11月份采集的枣休眠枝萌芽率明显偏低,只有40%~50%左右,而且发芽延迟,并且认为这与枣枝条仍处于休眠阶段有关。本项结果表明,1月采集的樱桃李休眠枝可以达到50%左右的萌芽率,而12月初采集的萌芽率只有24.6%,且发芽明显推迟,这与枣休眠枝的表现相似。有研究表明赤霉素(GA3)可以打破盆栽桃芽的休眠而使其提早发芽[12-13]。本研究中,用赤霉素溶液对12月初和1月中旬采集的樱桃李1年生休眠枝做浸泡处理,可使其提早发芽,并可明显增加萌发嫩梢的茎长,12月初处理的还可明显提高萌芽率,这些结果可以导致获得明显增多的用于灭菌接种的茎段外植体,对于延长樱桃李茎段外植体的取材时期和完善樱桃李外植体灭菌技术环节具有实践意义。
升汞是外植体灭菌中常用的灭菌剂[14-18]。刘崇琪等和李海臣等在樱桃李当年生茎段的灭菌中均以升汞做主要灭菌剂[7-8]。升汞杀菌效果较好,但使用过的升汞废液容易对环境造成污染,因此应尽量减少升汞的使用。本试验中,结合酒精浸蘸,用次氯酸钠(2%)对樱桃李休眠枝水培萌发形成的嫩梢茎段浸泡6~9 min、对春季采集的樱桃李田间当年生新梢茎段浸泡10~25 min均可以获得理想的灭菌效果,这一结果显示对于带菌量较少的茎段外植体可以采用次氯酸钠做主要灭菌剂进行灭菌,这对于减少外植体灭菌过程中升汞的使用和减轻环境污染具有积极意义。
茎段外植体灭菌接种后,其上的芽萌发后就可以形成无菌嫩梢用于继代培养,而茎段的萌芽率决定着形成无菌嫩梢的数量,萌芽率越高越有利于获得较多的无菌嫩梢。刘崇琪等研究结果表明,在附加6-BA 0.8 mg/L和IAA 0.4 mg/L的MS培养基上樱桃李茎段外植体的成苗率为70%,在附加6-BA 1.0 mg/L和IAA 0.3 mg/L的3/4MS培养基中茎段的增殖系数可达到6.2[7]。本试验中,在附加6-BA 1.0 mg/L和IAA 0.3 mg/L的3/4MS培养基中樱桃李茎段外植体的萌芽率仅为26.3%,这一结果与刘崇琪等人的研究不一致,其原因可能是所用樱桃李茎段的生理状态不同所致。本试验中,在附加6-BA 0.5 mg/L的MS培养基中,樱桃李休眠枝水培萌发茎段的萌芽率达到71.4%、樱桃李春季田间新梢茎段的萌芽率达到80.0%~95.5%,表明该种培养基比较适合于樱桃李茎段外植体的初代培养。
综上所述,与清水浸泡相比,赤霉素(100 mg/L或200 mg/L)浸泡1 h或2 h,可以明显促进樱桃李休眠芽提早萌发,并增加嫩梢长度,赤霉素(100 mg/L或200 mg/L)浸泡2 h还可以明显提高12月上旬采集的樱桃李休眠枝的萌芽率。结合酒精浸蘸,用次氯酸钠(2%)对樱桃李休眠枝水培萌生的嫩梢茎段浸泡6~9 min、对春季采集的樱桃李田间当年生新梢茎段浸泡10~25 min,污染率接近于0,存活率为100%。在附加6-BA 0.5 mg/L的MS培养基中,樱桃李休眠枝水培萌生茎段的萌芽率达到71.4%、樱桃李春季田间新梢茎段的萌芽率达到80.0%~95.5%。本项结果可以为延长樱桃李外植体取材时间和完善其外植体灭菌培养技术提供参考。
[1] 刁永强,许正,陈淑英,等. 新疆野生樱桃李种质资源研究现状及保护对策[J]. 中国野生植物资源,2017,36(3):57-61.
[2] 车凤斌,何琼,苏馨华,等. 樱桃李营养成分分析及产业化发展相关问题的探讨[J]. 新疆农业科学,2007,44(1):59-62.
[3] 张士康,肖正春,张广伦,等. 樱桃李与蓝莓果的营养价值[J]. 中国野生植物资源,2004,23(3):1-3.
[4] 刘伟,腊萍,杨如箴,等. 野生樱桃李清除DPPH自由基能力及抑制α-葡萄糖苷酶活性[J]. 江苏农业科学,2017,45(17):183-185.
[5] 张静茹,孙海龙,陆致成,等. 野生樱桃李()果实多酚多样性分析[J]. 果树学报,2017(5):567-575.
[6] 彭立新. 园艺植物生物技术[M]. 北京:中国农业出版社,2014.
[7] 刘崇琪,陈学森,吴传金,等. 新疆野生樱桃李()茎段与叶片培养及其植株再生[J]. 果树学报,2008,25(1):49-53.
[8] 李海臣,兰士波,罗旭. 樱桃李茎段离体培养与快速繁殖技术[J]. 中国林副特产,2011(3):14-16.
[9] 浦艳吉. 李茎尖离体培养与植株再生的研究[D]. 武汉:华中农业大学,2008.
[10] 延志莲,贺彦武. 大木枣休眠枝水培芽及其离体培养芽诱导的研究[J]. 延安大学学报(自然科学版),2000,19(1):66-71.
[11] 赵锦,代丽,刘孟军. 水培方法在枣无菌繁殖系外植体建立中的应用[J]. 河北农业大学学报,2005,28(5):45-47.
[12] 范伟国,孔凡来,贾霞. 新川中岛桃花期及花果质量的赤霉素调控[J]. 山西果树,2009(2):8-10.
[13] 江雪飞,乔飞,邹志荣,等. 硫脲、GA3打破不同需冷量观赏桃花品种自然休眠的效果研究[J]. 西北植物学报,2005, 25(5):1017-1021.
[14] 苏文潘,於艳萍, 陆祖正. 越南抱茎茶的外植体灭菌研究[J]. 农业研究与应用,2016(5):19-21.
[15] 杨舒婷,林茂,王华新,等. 崇左金花茶的外植体灭菌研究[J]. 北方园艺,2013(3):124-126.
[16] 李彬,岑秀芬,韦鹏霄,等. 影响广西柳州野生葡萄外植体灭菌效果的相关因子研究[J]. 南方园艺,2015,26(4):11-14.
[17] 李畅,傅建敏,王森,等. 阳丰甜柿组织培养外植体的选择与灭菌[J]. 经济林研究,2016,34(1):158-163.
[18] 岑湘涛,沈伟. 外植体选择和灭菌对杧果组织培养影响的初步研究[J]. 安徽农学通报,2016,22(2):16-17.
责任编辑:杨霞
Studies on gibberellin advancing dormant buds germinating and sterilizing and culturing technique of stem sections of myrobalan plums (Ehrh.)
SHI Yi, CHAI Ci-jiangCorresponding Author, FENG Tao, HUANG Lei
(College of Horticulture and Landscape, Tianjin Agricultural University, Tianjin 300384, China)
This paper aimed at researching on the hastening effect of GA3on dormant buds germination and on the sterilizing and culturing technique of stem sections of. The annual dormant shoot oftaken in the first ten-day period of December and middle ten-day period of January were soaked in GA3solution and then cultured in water for bud busting. The stem sections ofwere sterilized with alcohol and sodium hypochlorite and then inoculated in different media. The result showed that soaked in GA3(100 mg/L or 200 mg/L) solution for 1 or 2 hours the dormant buds of thegerminated obviously earlier and the shoot was marvelously longer compared with the control soaked in water. For annual dormant shoot taken in the first ten-day period of December the treatment of soaked in GA3(100 mg/L or 200 mg/L) solution for 2 hours, the germination rate increased obviously. After soaked in alcohol not only the young shoot fromdormant buds germinating cultured in water were soaked in sodium hypochlorite (2%) solution for 6-9 minutes but also the stem section oftaken in field in spring were soaked in sodium hypochlorite (2%) solution for 10-25 minutes. The both obtained the same result that the pollution rate was near to 0 and the survival rate was 100%. In MS medium added 0.5 mg/L of 6-BA the young shoot fromdormant buds germinating cultured in water had the germination rate of 71.4% while the stem section oftaken in field in spring had the germination rate of 80.0%-95.5%. These results can supply reference for prolonging the period when theexplants were taken and perfecting the sterilizing and culturing technique of theexplants.
; dormant buds; gibberellin; stem section; sterilizing; culturing
S604.3;S723.132.6
A
2018-02-27
国家星火计划项目(2008GA610015);天津市星火计划项目(08ZHXHNC07000);天津市林果现代农业产业技术体系创新团队项目(ITTFPRS2018002)
侍艺(1996-),女,本科在读,主要从事园艺植物组织培养方面的研究。E-mail:shiyigood@qq.com。
柴慈江(1960-),男,教授,硕士,主要从事园艺植物组织培养方面的研究。E-mail:cijiang666@163.com。
1008-5394(2018)02-0024-06
10.19640/j.cnki.jtau.2018.02.007

