胃异位胰腺6例
王 华 王伯胤 王 挺 卢增新 赵振华
临床资料
病例1:患者女性,49岁,半年前无明显诱因下感上腹部不适,进食后明显,无明显腹痛。入院前一周感恶心伴伴反酸嗳气。CT检查显示胃体小弯侧椭圆形实性占位(图1),大小约1.5cm×0.9cm,病灶密度均匀,边缘光整。平扫与双期增强扫描病灶CT值分别约为52HU、81HU、95HU;同期胰腺CT值分别约为50HU、85HU、94HU。遂行胃镜下胃壁全层切除术,术后病理病例证实为异位胰腺组织。随访患者症状明显好转。
病例2:患者女性,19岁,入院前一周上腹部饱胀不适,无疼痛,无反酸、嗳气,无恶心、呕吐,无黑便。CT检查显示胃体胃大弯侧中下部后壁类圆形实性占位(图2),大小约2.0cm×1.9cm,病灶边缘局部欠光整。平扫与双期增强扫描病灶CT值分别约为38HU、110HU、128HU;同期胰腺CT值分别约为45HU、112HU、125HU。遂行胃肿瘤切除术,术后镜下可见腺泡和导管样结构,免疫组化显示:IHC:CA199(+)、CD117(-)、CD34(-)、CK(+)、DM(-)、DoG-1(-)、EMA(+)、Ki-67(-)。 病 理 诊断为胃壁异位胰腺组织。
病例3:患者男性,57岁,入院1个月前无明显诱因下出现乏力伴消瘦,无反酸、嗳气,无腹痛、腹泻。血常规、肿瘤指标未见异常。CT检查显示胃体小弯侧类圆形实性占位,大小约2.5cm×2.2cm,病灶密度均匀,局部边缘欠光整。平扫与双期增强扫描病灶CT值分别约为44HU、48HU、93HU;同期胰腺CT值分别约为55HU、84HU、95HU。遂行肿瘤切除术,术后镜下可见腺泡和导管伴有普通的小叶结构。免疫组化显示:CA199(+), CD68(-),CEA(-), CgA(灶 +), CK(+), CK20(-), CK7(+),Ki-67(+3%), P53(-), S-100(弱 +), Syn(弱 +)。病理证实为胃壁异位胰腺组织。
病例4:患者男性,57岁,入院20余天前无明显诱因下出现乏力,纳退,伴有上腹部轻微不适,无隐痛,无腹胀,无呕吐,无返酸、嗳气,无黑便。CT检查显示胃窦部大弯侧见椭圆形囊性占位(图3),大小约1.2cm×0.6cm,病灶边缘光整,增强扫描病灶内囊性部分未见明显强化。遂行胃肿瘤切除术,术后镜下见大量平滑肌组织和导管,少量腺泡在其中穿插性生长,部分导管扩张成囊性,部分区域胰腺实性腺泡成巢团状生长。免疫组化显示:CK7(-)、CK20(-)、SMA(+)、DM(+)、P53(-)、Ki-67<5%(+)、Syn(±)、CgA(-)、S-100(-)。病理证实为胃壁异位胰腺。
病例5:患者男性,42岁,4年前因进食梗噎及恶心感,胃镜检查提示胃窦部大弯黏膜下肿物,考虑间质瘤。入院前1周腹部气窜感及腹泻。CT检查显示胃窦部大弯侧椭圆形实性占位,大小约2.0cm×1.4cm,病灶密度均匀,边缘光整。双期增强扫描病灶CT值分别约为 35HU、70HU、106HU;同期胰腺CT值分别约为 43HU、75HU、108HU。术后病理诊断为胃壁异位胰腺组织。
病例6:患者女性,59岁,入院1个月前无明显诱因下出现上腹部不适,无恶心、呕吐,无明显腹痛、腹胀,无乏力、纳差。CT检查显示胃窦部实性结节,大小约1.0cm×0.8cm,病灶边缘欠光整,中心见脐凹征象。双期增强扫描病灶CT值分别约为:30HU、51HU、70HU;同期胰腺CT值分别约为46HuU、75HU、90HU。术后病理诊断为胃窦部异位胰腺组织。随访患者症状明显好转。
讨 论
异位胰腺又称迷走胰腺或者副胰腺,是指发生于正常胰腺组织位置以外的胰腺组织,与胰腺本身无解剖学关系,异位胰腺是一种先天性异常,其发生机制一般认为是由于胚胎时期胰腺原基与胃、肠壁产生非炎性粘连,在发育过程中粘连的原基逐渐分离,在临近的胃壁或肠壁等位置继续发育形成异位胰腺。目前CT诊断误诊率极高,因此,笔者分析我院6例经手术病理证实的胃部异位胰腺并结合相关文献,着重分析其CT特征,为术前影像学诊断提供依据。
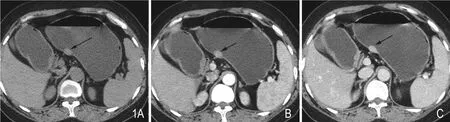
图1 A. CT平扫示胃体小弯侧椭圆形实性肿块(箭),病灶密度均匀,边缘光整。B、C. 动脉期增强病灶强化较明显,CT值约81Hu,静脉期持续强化,CT值约95Hu。与正常胰腺强化程度基本一致。
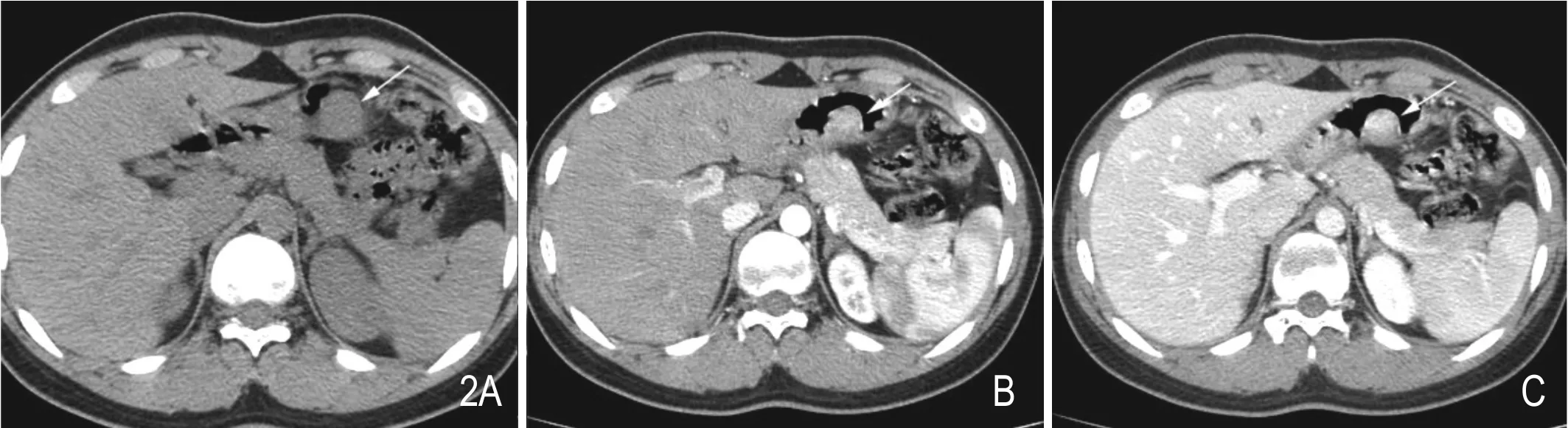
图2 A.平扫胃体大弯侧中下部后壁类圆形软组织肿块,病灶与周围正常胃壁分界不清,局部边缘欠光整。B、C. 动脉期增强病灶强化明显,CT值约110Hu,静脉期持续强化,CT值约128Hu。与正常胰腺强化程度基本一致。
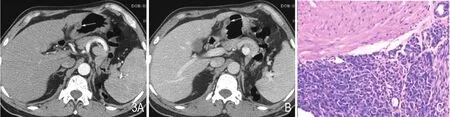
图3 A、B.胃窦部囊性椭圆形结节(箭),双期增强扫描病灶未见明显强化。C.HE染色×200,镜下见大量平滑肌组织及导管,少量腺泡在其中穿插性生长,部分导管扩张成囊性,部分区域胰腺实性腺泡成巢团状生长。IHC:CK7(-)、CK20(-)、SMA(+)、DM(+)、P53(-)、Ki-67<5%(+)、Syn(±)、CgA(-)、S-100(-)
1.临床及病理学特点
异位胰腺可见于消化道任何部位,最常见的部位为胃、十二指肠及近端空肠,而发生于胃部占所有异位胰腺的75%[1]。胃异位胰腺好发于胃窦,多见于大弯侧[2],在本组资料中,发生于胃窦部比率为50%,其余分别位于胃体小弯侧和大弯侧。胃异位胰腺临床表现以上腹部胀痛不适为主,表现类似胃炎,缺乏特异性。
胃异位胰腺主要病理成分主要为腺泡和导管,根据构成组织成分比例的不同分为4型:Ⅰ型由具有胰腺完整结构腺泡、导管和胰岛成分构成;Ⅱ型由导管构成;Ⅲ型由腺泡组织构成;Ⅳ型由胰岛细胞构成。在增强扫描时Ⅰ型的强化程度接近正常胰腺组织;Ⅱ型由导管为主要成分者,强化程度通常弱于正常胰腺;Ⅲ型由腺泡为主要成分者强化程度通常高于正常胰腺[3]。
2.CT 特点
胃异位胰腺具有一定的影像学特征,本组资料中病灶大小范围0.6cm×1.2cm~2.2cm×2.5cm,平均大小约1.3cm×1.7cm。形态上4例呈椭圆形表现,2例呈类圆形,1例显示中央脐凹征。发生部位胃窦部3例,胃体小弯侧2例,胃体小弯侧1例。在陈振东[4]报道的13 例胃异位胰腺中,77%(10/13)病灶最长径<3.0cm,92%(12/13)发生于胃窦和胃体部,77%(10/13)病灶形态为椭圆形。
本组病例均经平扫+双期增强扫描,1例病灶呈囊样改变,双期增强未见明显强化,后经病理证实主要成分为大量增生的平滑肌、胰腺导管和少量腺泡,这也印证了Claudon 等[5]报道的胃异位胰腺囊性变与胰腺导管不规则扩张有关。其余5例增强后强化较明显,与正常胰腺比较,有4例类似胰腺持续强化,其中2例双期增强病灶CT值与胰腺相当,2例强化程度较正常胰腺低,但CT值增加幅度接近,另1例增强后与胰腺比较无明显规律性。上述病例在镜下观察均显示胰腺腺泡和导管混合存在,本文未对病理再做详细分型,但可以推断异位胰腺在增强扫描时与正常胰腺所表现出的差异应为腺泡和导管比例不同所致。
参阅国内外文献发现有不少作者[6-7]在寻找胃异位胰腺影像学特点时,对病灶长径/短径(LD/SD)比值进行过分析研究,认为当比值>1.4时对提示本病有重要帮助,但在本组资料研究过程中发现,本组中有2例类圆形病灶,若病灶呈类圆形改变则并不适合此种观点,何况本病病灶一般较小,同胃壁组织分界未必十分清晰,测量时产生的误差会给长短径比值带来很大影响,国外也有学者[8]研究发现胃异位胰腺腺与其他黏膜下肿瘤之间的LD/SD值差异无统计学意义,因此笔者并不认同把长短径比值作为本病诊断的重要鉴别点。“脐凹征”即病灶中央可见有腺管开口的脐样凹陷,被认为是诊断胃异位胰腺的特异性征象[9],但在本文及相关文献报道中出现此典型征象比率均较低。
综上分析,在对胃异位胰腺进行诊断时,笔者认为应首先观察病灶基本情况,对好发部位(胃窦周围)、最大径在3cm以内突向胃腔生长的病灶应认真对比观察病灶与正常胰腺双期增强扫描情况,若两者之间强化程度或增加幅度类似,则要考虑到本病的可能。在鉴别诊断中,最主要需与常见的胃间质瘤区别:一般胃间质瘤呈外生性或混合性生长,而异位胰腺向腔内突出生长,另外胃间质瘤通常较大(>5cm)且易囊变坏死及增强后不均匀强化。

