基于高考化学复习的核心目标谈高三课堂范例的编制与利用——以“电解质溶液”复习为例
浙江 俞真蓉 屠飞杰
高考化学复习的核心目标是帮助学生夯实基础,建构更为全面的中学化学知识网络和认知体系。本文基于高考化学复习的核心目标,提出高三课堂范例编制的原则和具体操作的范式,对溶液中的离子反应复习进行实例分析,并提出解题模板,有效提升高三课堂的复习效果。
1.问题的提出
随着新课改进一步实施、新高考改革的不断推进,教师的教学理念也与时俱进。目前许多教师采用课堂范例习题教学模式展开高三复习,在这种复习模式中,教师通常会选用最新的高考试题或者各地模拟试题作为课堂范例,采用“学生做题→教师讲解→知识的发散与归纳总结”,帮助学生构建全面的化学知识系统、养成良好的解题能力和习惯。
教学实践表明,盲目地拿一套题来考试或练习,试题量大质量又差。有部分教师喜欢题海战术,甚至把高三复习课变成简单机械的习题训练。教育心理学告诉我们:“大运动量”的习题会使学生的大脑由兴奋转向抑制,大多数学生只求能完成作业即可,对试题往往是走马观花,哪谈得上真正理解!高三复习课实践和高考成绩表明,学生成绩的好坏并非与习题的数量成正比,而是与习题的质量紧密相关。题海战术并不能起到有效提高成绩的作用,只有有效的编制习题才能起到举一反三、减负增效的教学效果。
2.问题的解决
高考化学复习的核心目标是帮助学生夯实基础,建构更为全面的中学化学知识网络和认知体系,进一步提升学生学习能力(包括接受、吸收、整合信息的能力,分析和解决化学问题的能力,化学实验与探究的能力),进一步熟练运用化学学科规律、思想方法解决实际问题。因此高三复习课堂范例应该基于高考化学复习的核心目标进行编制,课堂范例应该要凸显高考化学复习的核心目标,编制的原则如下:
(1)范例内容选择的针对性:①针对不同复习阶段的实际情况;②针对高考实际要求,与高考化学《考试说明》一致;③针对学生易错易漏易混的知识点。
(2)范例呈现形式的多样性:通过改变课堂范例的呈现形式,能够很好地判断学生对该知识点是否真正理解和掌握,并能有效地加强学生对知识的巩固和提高。如一道选择题能覆盖较多的考点,可以了解学生对知识的掌握情况,但不能排除学生随意猜对的可能性,如果改变此题的呈现方式,比如改为一组填空题(即一组问题链),就可以真正判断学生对该知识点的掌握情况。
高考试题灵活多样,如何提高学生的解题和应变能力,这就需要教师在训练时要选择拓展性强、形式多样的习题来提高学生灵活应变的能力,培养和锻炼学生思维的灵活性、敏捷性和广阔性。
(3)范例编写的层次性:高三复习阶段,依据学生的不同层次,编写难度不同的课堂范例,使课堂范例体现递进性和层次性。
基于上述认识,在实际操作过程中,可以按如下所示具体操作范式进行。

下面以“溶液中的离子反应”的复习为例,基于高三复习课堂范例编制的原则,对试题进行有目的的重组和改编,探讨高三复习课堂范例的编写与利用,既为教师不断改进高三复习课教学,提高课堂教学的有效性提供范例,也可以为学生创造更为高效、更有深度的复习课堂。
3.高三复习课堂范例分析——以“电解质溶液”复习为例
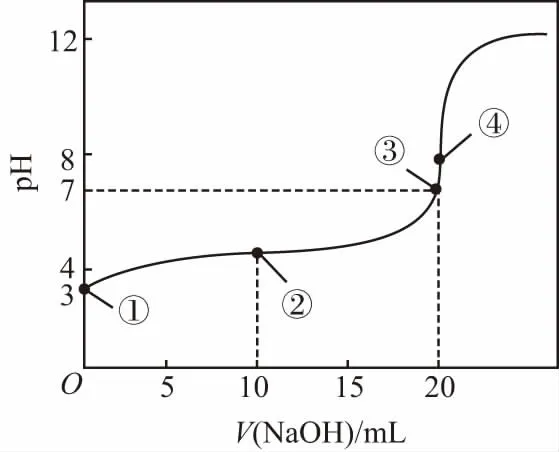
【案例】(2013年·浙江·12题)25℃时,用浓度为 0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.100 0 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )
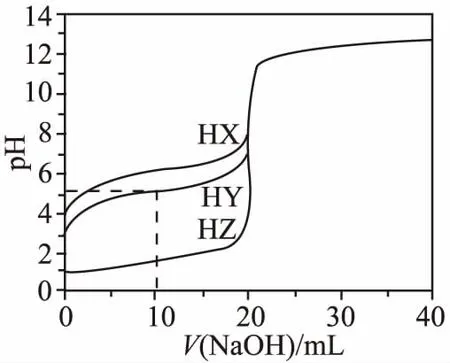
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ B.根据滴定曲线,可得Ka(HY)≈10-5 C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) 【答案】B 显然,这样4个选项如果直接用于课堂,毫无教学性可言,只是为了解题而解题。但是将试题进行合理改编,将选项去除,依次设计如下问题: 问题1:写出HY、HZ的电离方程式。 问题2:比较相同条件下,三种酸溶液的导电能力顺序。 问题3:升温,则HY溶液中c(H+)、α(HY)如何变化? 问题5:计算Ka(HY)和pH=4时的α(HX)。 问题6:(1)三种酸被NaOH溶液恰好中和时溶液中X-、Y-、Z-浓度大小顺序。 (2)将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时溶液中离子浓度大小顺序。 (3)用10.00 mL浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL浓度为0.100 0 mol·L-1的HY溶液,得到的溶液中粒子浓度大小顺序。 问题7:正误判断,并说明理由。 (2)用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL 浓度为0.100 0 mol·L-1的HY溶液,恰好呈中性时,c(Na+)=c(HY)+c(Y-)=0.100 0 mol·L-1。 (3)用浓度为0.100 0 mol·L-1的NaOH溶液滴定20.00 mL 浓度为0.100 0 mol·L-1的HY溶液,恰好中和时,c(H+)=c(HY)+c(OH-)。 问题8:常温下0.1 mol·L-1H2A溶液中有H2A、HA-、A2-,三者中物质的量分数(分布系数)随pH变化的关系如图所示,求H2A的Ka1、Ka2的值。 问题9:常温下pH均为2的HX和HY的稀溶液各 10 mL,分别稀释至1 000 mL,在图中画出,溶液pH与溶液体积(V)的关系。 问题10:现用0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1HY溶液,请绘制滴定过程中pH-V(NaOH)关系图象。并在图中画出符合c(Na+)>c(Y-)>c(OH-)>c(H+)的点或区域。 【解题模板】基于教学实践并结合溶液中的离子反应相关化学知识和原理,总结了如下的解题模板: 溶质成分 首先根据已知的化学情境判断溶质的成分是什么,然后根据溶质分析溶液中存在的“两大平衡”和“三大守恒”:①弱酸、弱碱,则考虑电离平衡;②含有弱酸根的正盐,则考虑水解平衡;③弱酸的酸式盐,则既要考虑电离平衡,又要考虑水解平衡。最关键的是,如果多个电离平衡或者多个水解平衡或者电离平衡和水解平衡同时存在,则还需要进一步判断电离或水解进行的程度,并按进行程度由大到小的顺序排列,即需要确定哪个更“强势”。最后根据“两大平衡”和“三大守恒”进行试题的定性分析或定量计算。 问题2:三种酸的酸性强弱顺序如下:HZ>HY>HX。相同条件下,酸性越强,电离程度越大,离子浓度越大,则溶液的导电能力:HZ>HY>HX。 问题6:(1)三种酸被NaOH溶液恰好中和,溶质是单一的,分别是NaX、NaY和NaZ。HZ是强酸,则NaZ不水解;弱酸的酸性强弱:HY>HX,根据“越弱越水解”的规律,可以判断盐溶液中c(Y-)>c(X-)。综上所述,离子浓度大小顺序为c(Z-)>c(Y-)>c(X-)。 (2)因为弱酸的酸性大小:HY>HX,用NaOH溶液滴定至HX恰好完全反应时,相当于HY和HX实际上都已恰好完全中和,此时溶质有两个组分:NaY和NaX,且物质的量之比是1∶1。根据“越弱越水解”的规律,可以判断溶液中离子浓度大小顺序为c(Na+)>c(Y-)>c(X-)>c(OH-)>c(H+)。 (3)此时,溶质有两个组分:NaY和HY,物质的量之比是1∶1。综合考虑NaY的水解平衡和HY的电离平衡,由图象pH≈5可知溶液呈酸性,表明电离更“强势”,因此得到的溶液中粒子浓度大小顺序为c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-)。 (2)错误,NaOH溶液滴定HY溶液,因为NaY溶液水解呈碱性,所以恰好呈中性时,溶质为NaY和过量的HY,即c(Na+) (3)错误,NaOH溶液滴定HY溶液,恰好中和时,溶质只有NaY,列出电荷守恒:c(Na+)+c(H+)=c(Y-)+c(OH-),物料守恒:c(Na+)=c(HY)+c(Y-),得到质子守恒:c(H+)+c(HY)=c(OH-)。 问题9:由上述分析可知,HX和HY均为弱酸且酸性强弱HY>HX,稀释过程中较弱酸的电离程度增大得多,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HY的pH变化比HX的大,如下图所示。 问题10:因NaOH溶液和HY溶液恰好中和生成NaY,水解呈碱性,因此滴定曲线如下图所示;④点就是恰好中和的点,因此之后的点均符合c(Na+)>c(Y-)>c(OH-)>c(H+)。 【设计意图】从范例内容选择的针对性看,本案例针对高考《考试大纲》和学生易错易漏易混的知识点,针对电离平衡、水解平衡、电解质溶液中的三大守恒和酸碱中和滴定进行复习。从范例呈现形式的多样性看,本案例有填空题、判断题、简述题、图象题等,降低学生随意猜对的可能性,真正判断学生对该知识点的掌握程度。从范例编写的层次性看,本案例中问题1~5设置为基础知识巩固题,重在强化学生对强弱电解质、电离平衡、电离常数、溶液的酸碱性或pH、盐类水解和酸碱中和滴定的掌握。问题6~10设置为能力拓展题,学生需要分门别类地考虑电离、水解、过量等内外因素,充分利用化学平衡移动原理、几大常数之间的计算关系、电荷守恒关系、物料守恒关系、质子守恒关系进行分析和解答。 学生通过这一组习题的练习,对电离平衡、水解平衡、电解质溶液中的三大守恒、酸碱中和滴定等方面进行针对性复习,提高学生运用化学原理解决电解质溶液实际问题的能力。 教学实践:课堂实践表明,学生通过题组训练,可以了解自己对“溶液中的离子反应”相关知识的掌握程度,清楚自己知识的薄弱点,从而弥补自己学习上的不足,修正自己的学习计划。通过题组形式,使知识结点成线,提升学生综合能力,激发学生综合运用已学的知识,从不同层次进行思考,创造性地解决问题,达到复习效果,强化了“知识立意”向“能力立意”的转换。 本文基于高考化学复习的核心目标,就高考化学复习课堂范例的编制与利用进行了阐述。值得一提的是,试题的合理分类和对学生错题的统计是基础而艰苦的工作,但也是后续工作的前提。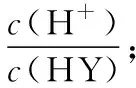



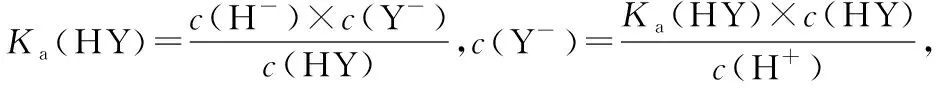


4.结束语