液氮冷冻处理对养殖大黄鱼保鲜品质及菌群结构的影响
张登科,陈 姣,吴林洁,杨巨鹏,陈世达,张慧恩,杨 华,*,娄永江
(1.宁波大学海洋学院,浙江宁波 315211;2.浙江万里学院生物与环境学院,浙江宁波 315100)
大黄鱼(Pseudosciaenacrocea)是中国海水养殖产量最高和最具出口优势的水产品之一[1]。大黄鱼肉质细嫩,蛋白质含量高,胆固醇含量低,含有丰富的无机盐及微量元素,具有延缓衰老,提高机体免疫力,治疗贫血等多重功效[2]。大黄鱼肌肉中水分含量高达74%[3],腐败菌组成复杂,比动物组织更易腐败,不易贮藏,现阶段实际生产中对于大黄鱼等水产品的保藏,国内外依旧主要采用低温保藏技术[4-5],但一般的冰温和冷藏保鲜不能大幅度延长水产品的货架期,而经过冻藏后易出现口感降低、营养价值损失的问题[6-7]。所以寻求一种适于大黄鱼的冻藏前处理方式对促进养殖、加工及贮运等产业极为重要。
液氮冷冻是将食品放入液氮中或将液氮喷洒在食品表面,让液氮与食品表面充分接触,巨大的温差使液氮在极短的时间内除去食品中的热量,从而使食品达到冻结状态。液氮的冻结速度快,能够在较短的时间内度过食品的冰晶形成期,对食品原有的营养和质构特性影响很小[8]。液氮处理食品超低温会改变食品中原有的微生物群落结构,冻结状态使食品本身的化学变化变得更加缓慢,从而达到食品保鲜效果[9]。目前液氮冻结技术在水产品上的运用逐渐增多,鲁珺等[7-8]研究结果表明液氮深冷速冻对三疣梭子蟹、带鱼及银鲳的冻藏品质均具有较好的维持效果。
现阶段国内外研究重点侧重于液氮冷冻处理对水产品理化品质的影响,对于水产品在液氮冷冻处理在储藏过程中理化指标与内源酶、菌群结构等因素的相关联系研究较少。本文以新鲜养殖大黄鱼为原料,采用液氮浸渍冻结处理,分析养殖大黄鱼在低温贮藏条件下新鲜度品质及菌群结构的变化情况,为养殖大黄鱼的液氮冷冻处理保鲜提供理论依据。
1 材料与方法
1.1 材料与仪器
养殖新鲜大黄鱼 购于宁波路林市场,用冰盒运回实验室;硫代巴比妥酸、甲基红、溴甲酚绿、硼酸、盐酸、三氯乙酸、乙醇、甲苯、甲醛、碳酸钾、盐酸三甲胺、苦味酸、无水硫酸钠、氢氧化钠、高氯酸、氢氧化钾、磷酸二氢钾、磷酸氢二钾、氯化钠 纯度≥99.5%,均为分析纯(AR),国药集团化学试剂有限公司;营养琼脂培养基 杭州微生物试剂有限公司。
PL2002型电子分析天平 梅特勒-托利多仪器(上海)有限公司;Forma-725型超低温冰箱 澳柯玛股份有限公司;Centrifuge 5804R型离心机 德国Eppendorf 5804R;YXQ-LS-50SII型立式压力蒸汽灭菌锅 上海申安医疗器械厂;HWS型恒温恒湿培养箱 宁波江南仪器厂;7230G可见光光度计 上海舜宇恒平科学仪器有限公司;SKD-1000型自动凯氏定氮仪 上海天齐生物科技有限公司;e2695型高效液相色谱仪 上海瑞玢国际贸易有限公司;FE20型pH计 梅特勒-托利多仪器(上海)有限公司;DK-8D型恒温水浴锅 上海维诚仪器有限公司;BCD-216ZDJ型可调式冰箱 青岛海尔股份有限公司。
1.2 实验方法
1.2.1 样品的预处理及分组 将养殖的新鲜大黄鱼去鳞、去内脏,剖成两片,取去皮鱼肉切分成5 g的小块。一部分进行真空包装,另一部分直接放入液氮中浸渍5 min后真空包装。未进行液氮浸渍处理的样品为空白组,经液氮浸渍处理的样品为液氮组,将所有样品放入4 ℃冰箱储藏14 d,在储藏过程中,菌落总数1 d测定一次,测定前7 d;其它品质指标每2 d测定一次。
1.2.2 硫代巴比妥酸值(TBA)的测定 参照胡庆兰[10]的方法,各取5 g样品研碎,加入25 mL 7.5%的三氯乙酸(含有0.1% EDTA),振荡摇匀,静置30 min后用双层滤纸过滤2次。取5 mL上清液于离心管内,加入5 mL 0.02 mol/L TBA溶液,放入沸水浴40 min后取出冷却1 h,10000 r/min离心25 min,取清液于试管内,加入5 mL氯仿摇匀,静置分层后取上清液分别在532 nm和600 nm波长处比色。
K(%)=(WHχR+WHχ)/(WATP+WADP+WAMP+WIMP+WHχR+WHχ)×100
1.2.3 三甲胺(TMA)的测定 参照姜兴为[11]的方法进行检测。称取5 g搅拌均匀的鱼肉于250 mL具塞三角烧瓶中,加入20 mL 7.5%三氯醋酸(TCA),摇晃使混合均衡,在室温下静置30 min后用滤纸过滤。吸取4 mL萃取液到25 mL的比色管内,然后分别再加入3 mL饱和碳酸钾溶液、10.00 mL甲苯、1 mL碳酸镁甲醛溶液,用力振摇1 min后,静置5 min。然后将上层甲苯层分别移入内有0.5 g无水硫酸钠的有盖试管中,进行脱水处理。取5.00 mL处理过的甲苯溶液,再加苦味酸甲苯溶液5.00 mL,混匀后。用1 cm比色皿,参比液为空白试剂,在波长410 nm处测定各样品的吸光值。
按照以下公式计算TMA值。
式中:A为测定管TMA含量(μg)。
1.2.4 挥发性盐基氮(TVB-N)的测定 参照SC/T3032-2007水产品中挥发性盐基氮的测定[12]进行检测。
1.2.5 K值的测定 参照SC/T3048-2014鱼类鲜度指标K值的测定高效液相色谱法[13]进行测定。称取大黄鱼样品(2±0.02) g于烧杯,均质后放入离心管内,加人20 mL 10%(v/v)高氯酸溶液,振荡1 min,然后在4 ℃,8000 r/min离心10 min,取出上清液。再用10 mL 5%(v/v)高氯酸溶液提取沉淀物中的待测物,4 ℃,8000 r/min离心10 min。重复操作一次,合并上清液。用10 mol/L的氢氧化钠溶液调节提取液pH至近6.0,然后再用1 mol/L的氢氧化钠溶液继续调节pH至6.0~6.4。将已调节pH后的溶液转移至50 mL容量瓶中,用4 ℃水定容。将定容后的溶液4 ℃,8000 r/min离心10 min,然后用0.22 μm微孔滤膜过滤,最后将滤液放入高效液相色谱仪检测。按照以下公式计算K值。
K(%)=(WHχR+WHχ)/(WATP+WADP+WAMP+WIMP+WHχR+WHχ)×100
式中:WATP-样品中腺苷三磷酸的含量,μmol/g;WADP-样品中腺苷二磷酸的含量,μmol/g;WAMP-样品中腺苷酸的含量,μmol/g;WIMP-样品中肌苷酸的含量,μmol/g;WHxR-样品中次黄嘌呤核苷的含量,μmol/g;WHx-样品中黄嘌呤的含量,μmol/g。
1.2.6 菌落总数的测定 参照GB/T4789.2-2010食品卫生微生物学检测-菌落总数测定[14]进行检测。
1.2.7 微生物菌群结构的鉴定 样品前处理:将用液氮浸渍5 min和未浸渍的鱼肉置于37 ℃培养箱中24 h,然后加入适量无菌生理盐水,匀浆,稀释后用PCA培养后,选取各个菌落进行分离纯化。
细菌DNA提取:用无菌的接种环提取分离纯化后的菌体,接种到10 mL的TSB培养液中培养过夜(增菌)。取1 mL过夜培养的菌液,加入1.5 mL离心管中,室温8000 r/min离心1 min,弃上清液,收集菌体。加入180 μL溶菌酶溶液,重悬菌液,37 ℃水浴30~60 min。再加入20 μL PrpteinaseK溶液,振荡均匀。56 ℃水浴30 min至细菌完全裂解。依次加入200 μL BufferBD、200 μL无水乙醇充分颠倒混匀。将吸附柱放入收集管中,用移液器将溶液和半透明纤维状悬浮物全部吸入吸附柱中,静置2 min,再12000 r/min室温离心1 min,倒掉收集管中的废液。将吸附柱放回收集管,加入500 μL PW Solution,10000 r/min离心30 s倒掉滤液。将吸附柱放回收集管,加入500 μL Wash Solution,10000 r/min离心30 s倒掉滤液。将吸附柱重新放回收集管中,于12000 r/min室温离心2 min,离去残留的Wash Solution。取下吸附柱,放入一个新的1.5 mL的离心管中,加入50~100 μL CE Buffer静置3 min,12000 r/min室温离心2 min,收集DNA溶液。DNA产物经1%琼脂糖凝胶电泳分析,在凝胶成像系统中成像观察,并将提取后的DNA置于-20 ℃下保存备用[15]。此DNA即PCR反应模板。
PCR扩增16S rDNA基因片段:采用通用引物PCR扩增16S rDNA基因片段,建立25 μL PCR反应体系,包括:7.8 μL rTaq酶、1.0 μL DNA模板、上下游引物25 μmol/L各1 μL,用灭菌的去离子水(ddH2O)补至总体积25 μL。扩增程序:95 ℃预变性5 min,95 ℃变30 min,53 ℃退火1 min,72 ℃延伸90 s;30个循环,最后72 ℃保持10 min。纯化的PCR产物于-20 ℃保存[16]。16S rDNA扩增引物采用通用引物,正向引物有27F:5′-AGAGTTTGATCC TGGCTCAG-3′,反向引物为1492R:5′-GGTTACCTT GTTACGACTT-3′,由上海捷瑞生物工程有限公司合成。扩增产物经1%琼脂糖凝胶电泳分析,然后在凝胶成像系统中成像观察。
16S rDNA序列测定及分析:将扩增成功的PCR产物送至上海生物工程有限公司进行测序,将测序结果导入NCBI的Blastn检索系统,在Nucleotide 数据库中进行序列同源性比对。
1.3 数据处理
使用Office excel 2003软件进行数据处理及绘图。
2 结果与分析
2.1 TBA的变化与分析
养殖大黄鱼在贮藏过程中,鱼体内的油脂会自发的发生氧化反应,氧化产物分解生成低级脂肪酸、醛、酮等物质。硫代巴比妥酸(TBA)反应的原理是脂肪氧化产生的1分子丙二醛(MDA)与2分子TBA反应生成复合物,此复合物的最大吸收峰在532 nm处[17]。丙二醛的浓度和吸收强度在一定范围内呈线性关系,由此可以确定脂肪氧化程度[18]。从图1中可以看出2种不同的养殖大黄鱼样品的初始TBA值非常接近,液氮组的样品为(0.60±0.12) mg/100 g,空白组的样品为(0.65±0.05) mg/100 g。从TBA值的增长趋势可以看出,养殖大黄鱼储藏初期的脂肪氧化较为缓慢,储藏后期脂肪氧化的速度开始加快。在第14 d的时候,液氮组样品的TBA值为(1.71±0.08) mg/100 g,空白组样品的TBA值为(2.10±0.43) mg/100 g,可以看出在储藏终点时两者的脂肪氧化程度相差较大,液氮组与空白组拟合方程斜率分别为0.07和0.10,液氮组的脂肪氧化程度的平均增长速率低于空白组。
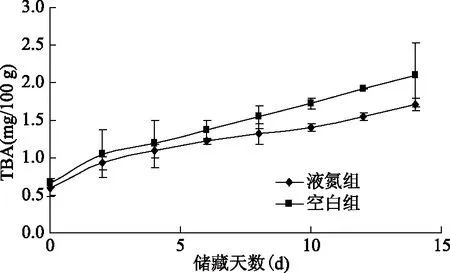
图1 养殖大黄鱼贮藏过程中TBA变化Fig.1 Changes of TBA during storage of cultured large yellow croaker
2.2 TMA的变化与分析
氧化三甲胺(TMAO)是一种广泛分布于海产硬骨鱼类肌肉中的内源性物质。TMAO经兼性厌氧菌的还原会产生三甲胺(TMA),鱼体内三甲胺的含量随鲜度的下降而逐渐增加[19]。鱼类(主要是海水鱼)含有的氧化三甲胺含量与鱼的种类和生长环境有关。Huss等[20]曾报道过冷水鱼高品质期的TMA值小于1.5 mg/100 g,可接受界限为10~15 mg/100 g。从图2中可以看出液氮组和空白组的初始TMA值都较低,分别为(0.47±0.02) mg/100 g和(0.52±0.01) mg/100 g,储藏初期,TMA值的增长速度很慢,随着时间的延迟,TMA值的增长也开始加快,第14 d时液氮组和空白组的TMA分别为(5.46±0.037) mg/100 g和(6.99±0.008) mg/100 g,但是液氮组与空白组拟合方程斜率分别为0.36和0.46,液氮组样品的TMA值增长速度更为缓慢。
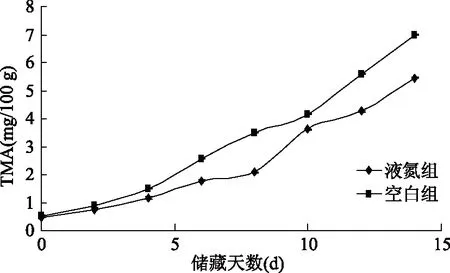
图2 养殖大黄鱼贮藏过程中TMA的变化Fig.2 Changes of TMA during storage of cultured large yellow croaker
2.3 TVB-N的变化与分析
挥发性盐基氮(TVB-N)是一个衡量肉质新鲜度的理化指标,TVB-N越低,则表示肉质越新鲜。挥发性盐基氮主要由三甲胺,二甲胺和氨组成,这些物质来自于内源性酶蛋白和非蛋白氮化合物的降解[21]。很多鱼类TVB-N的变化与肉质新鲜度指标之间有很好的相关性,我国以及多数国家已将TVB-N作为鉴定水产品腐败程度的标准。我国国标规定30 mg/100 g是水产品品质可接受范围的上限,高于这个值将不能被食用。TVB-N值低于13 mg/100 g时为一级鲜度,低于30 mg/100 g为二级鲜度[22]。由图3可知,液氮组和空白组的样品初始TVB-N分别为(10.28±0.40) mg/100 g和(10.06±0.23) mg/100 g,处于一级鲜度范围内,说明此时养殖大黄鱼样品的还是很新鲜的。随着储藏时间的增长,养殖大黄鱼样品的TVB-N值也在不断变大。空白组在储藏第2 d时,TVB-N值已达到(14.7±0.16) mg/100 g,已属于二级鲜度范围内,而液氮组在储藏第4 d时,TVB-N值才达到(15.6±0.34)mg/100 g,此时仍属于二级鲜度范围内。两者的趋势线相比,液氮组与空白组拟合方程斜率分别为1.08和1.20,液氮组平均增长速率和空白组相近。
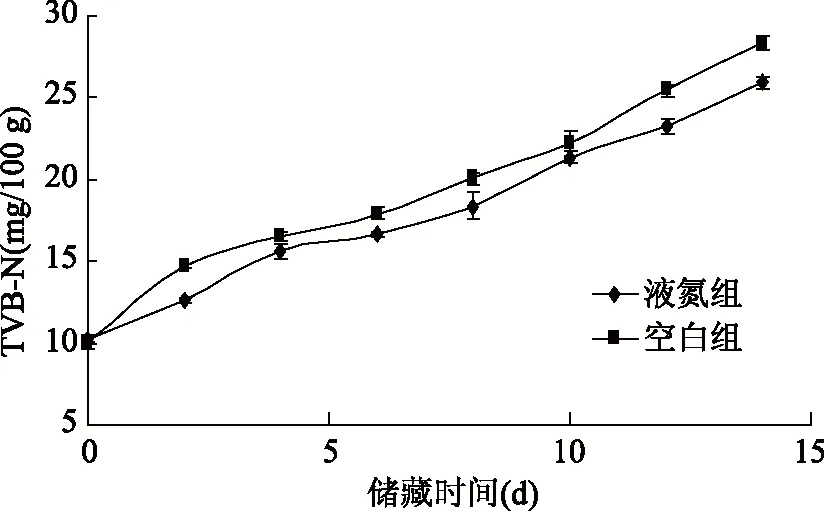
图3 养殖大黄鱼贮藏过程中TVB-N的变化Fig.3 Changes of TVB-N during storage of cultured large yellow croaker
2.4 K值的变化与分析
K值是腺苷三磷酸降解产物次黄嘌呤核苷、次黄嘌呤量之和与腺苷三磷酸关联化合物总量的百分比。鱼类死后K值的变化能够很好的反映其营养成分与鲜活质量的变化。K值低于20%时鱼类为一级鲜度,低于50%为二级新鲜,高于70%则被定义为完全腐败。K值越小则表示鱼类越新鲜。一般鱼类死亡后受到微生物和自身酶的作用,营养成分逐渐降解,鲜度逐渐下降。在鲜度下降过程中,肌肉中的腺苷三磷酸(ATP)会逐渐分解,依次分解为腺苷二磷酸(ADP),腺苷酸(AMP),肌苷酸(IMP),次黄嘌呤核苷(HxR),黄嘌呤(Hx),导致肌肉呈苦味[23]。从图4可知,两组样品的初始K值分别为液氮组9.5%±0.1%,空白组为9.1%±0.06%,表示液氮处理对K值的初始值没有影响。储藏早期K值的增长较缓慢,第14 d时液氮组和空白组的K值分别为45.1%和55.6%。随着时间的延迟,增长速度变大。两者的趋势线相比,液氮组与空白组拟合方程斜率分别为2.55和3.36。液氮处理的养殖大黄鱼样品的K值在后期储藏中始终低于未处理的养殖大黄鱼样品。
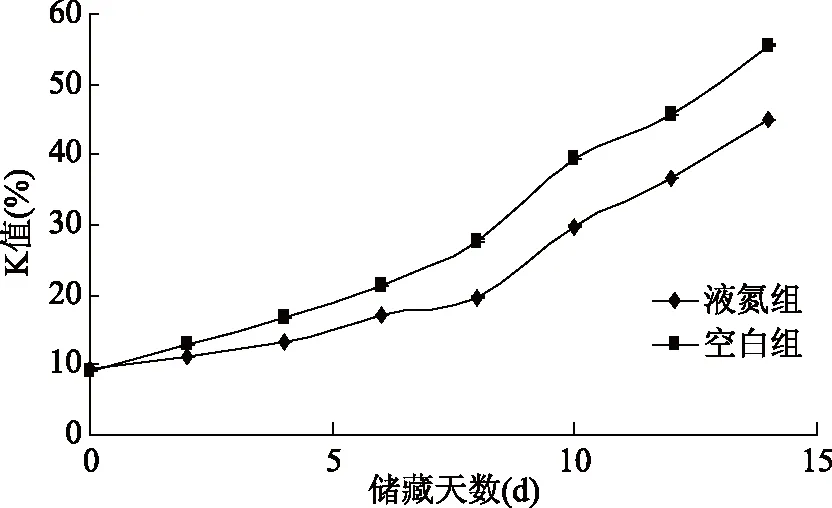
图4 养殖大黄鱼贮藏过程中K值的变化Fig.4 Changes of K value during storage of cultured large yellow croaker
2.5 菌落总数的变化与分析
初始菌落总数是一个非常重要的指标,它不仅能指示鱼类的初始新鲜程度,而且会影响养殖大黄鱼在冰藏期间的腐败进程[24-25]。从图5中可以看出,经过液氮处理后,养殖大黄鱼样品的初始菌落总数有了明显的减少,液氮组的初始菌落总数的对数值为(3.63±0.016) cfu/g,空白组的对数值为(5.38±0.019) cfu/g;液氮组与空白组相比,经液氮处理后的样品,菌落总数下降了98.21%;说明液氮冷冻处理抑制了大部分的微生物的增殖,只有少数耐低温的微生物得以繁殖,液氮处理养殖大黄鱼具有良好的抑菌效果。在储藏过程中,两组的菌落总数都呈对数增长,从增长趋势可以看出,液氮组与空白组拟合方程斜率分别为0.76和0.65,菌落总数的平均增长率液氮组高于空白组,这是由于空白组中初始菌落总数高于液氮组,而样品中微生物的增殖需要适宜的条件,两组鱼肉中营养物质大致相同,所以在储存过程中液氮组的菌落总数增长率高于空白组,但是液氮组菌落总数一直低于空白组。
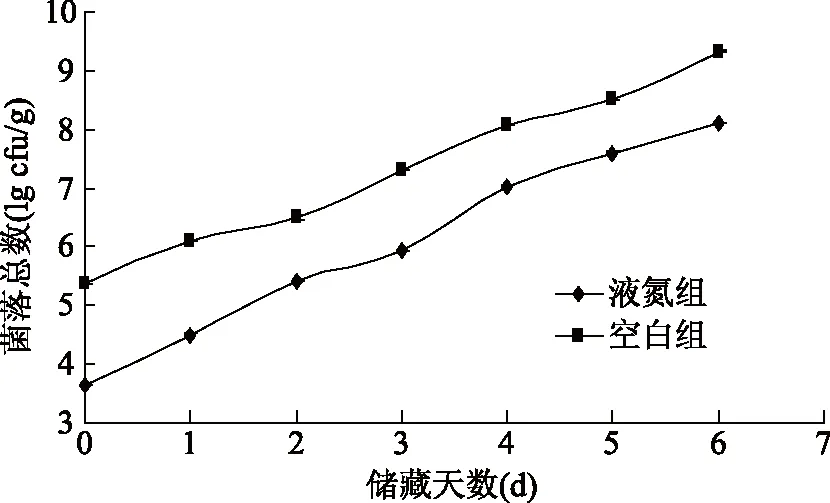
图5 养殖大黄鱼贮藏过程中菌落总数的变化Fig.5 Changes of the total number of colonies during storage of cultured large yellow croaker
2.6 微生物菌群结构分析
通过对所有样品中微生物的16S r RNA基因的测序,如图6所示,在门水平上分析空白组样品中优势菌为变形菌门(Proteobacteria)72.65%、其次为厚壁菌门(Firmicutes)23.38%和拟杆菌门(Bacteroidetes)3.96%,除了这些主要菌门外,还存在有一些丰度较低的放线菌门(Actinobacteria)、异常球菌-栖热菌门(deinococcus-Thermus)、梭杆菌门(Fusobacteria)以及其它未能分类(unclassified)菌门,有的所占百分比不足 0.01%,图中显示不明显。液氮组样品中优势菌种类和空白组大致相同,只是比例有所变化,优势菌为变形菌门(Proteobacteria)65.60%、其次为厚壁菌门(Firmicutes)23.91%和拟杆菌门(Bacteroidetes)10.11%,其它菌门细菌含量也均很低。说明了养殖大黄鱼在贮藏过程中微生物多样性丰富,丰度比较集中的特点。但液氮冷冻处理对其种类影响不大,对其丰度有较多影响。
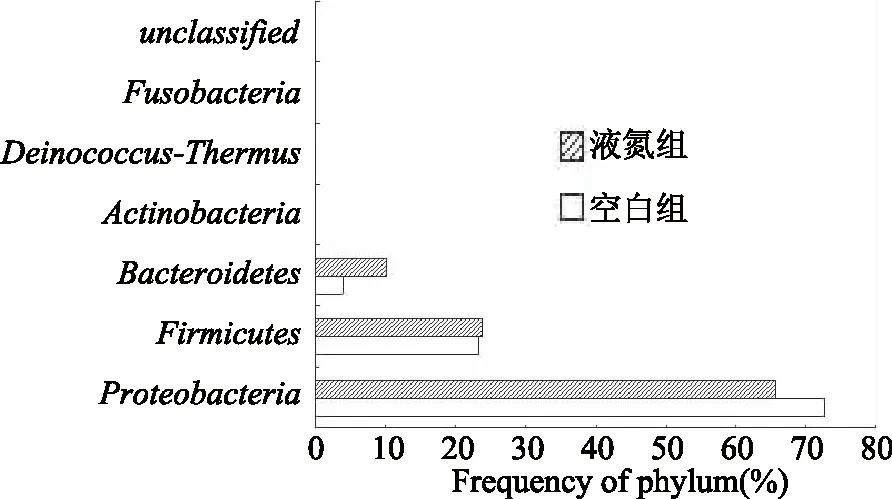
图6 养殖大黄鱼样品中细菌在门水平上的相对丰度分析Fig.6 Analysis of relative abundance of bacteria at the Phylum level in cultured large yellow croaker
在属水平上分析,如图7所示,空白组样品中优势菌为气单胞菌属(Aeromonas)37.72%、其次为漫游球菌属(Vagococcus)21.99%、变形杆菌属(Proteus)17.35%、不动杆菌属(Acinetobacter)5.70%和类香味菌(Myroides)3.67%,其它菌属细菌含量均较低,图中仅列出丰度为前15的细菌种类。液氮组样品中优势菌为气单胞菌属(Aeromonas)44.87%、其次为漫游球菌属(Vagococcus)18.83%、不动杆菌属(Acinetobacter)13.28%和类香味菌(Myroides)10.17%,其它菌属细菌含量均较低。从结果上来看,液氮冷冻处理对养殖大黄鱼储存期的菌落结构是有一定影响的。空白组和液氮组细菌中气单胞菌属含量都是最大的,但液氮组气单胞菌属所占总细菌的比值略高于空白组,鱼类中主要腐败菌包括气单胞菌属,这与研究结果是相符合的[26-27]。变形杆菌属(Proteus)在空白组细菌总量中占有较多比例,但其在液氮组中几乎没有。说明液氮冷冻处理对部分微生物具有杀菌效果。

图7 养殖大黄鱼样品中细菌在属水平上的相对丰度分析Fig.7 Analysis of relative abundance of bacteria at the genus level in cultured large yellow croaker
由图8中可以比较空白组和液氮组在某分支上的丰度差异,在门水平上,在物种丰度上进行比较,两组样品除拟杆菌门(Bacteroidetes)液氮组高于空白组,其它细菌种类丰度差别不大。在纲水平上,除β-变形菌纲(Betaproteobacteria)和梭菌纲(Clostridia)空白组高于液氮组,但β-变形菌纲和梭菌纲丰度并不高,其它细菌种类丰度和门水平上的结果基本一致。两组在目水平上,细菌种类丰度逐渐出现较大差距。综上所述,液氮冷冻处理对养殖大黄鱼贮藏期菌群结构有一定影响,但主要表现在目、科、属水平上。而菌落结构的改变是否对养殖大黄鱼储藏期品质变化有所影响,还需进一步实验进行验证。
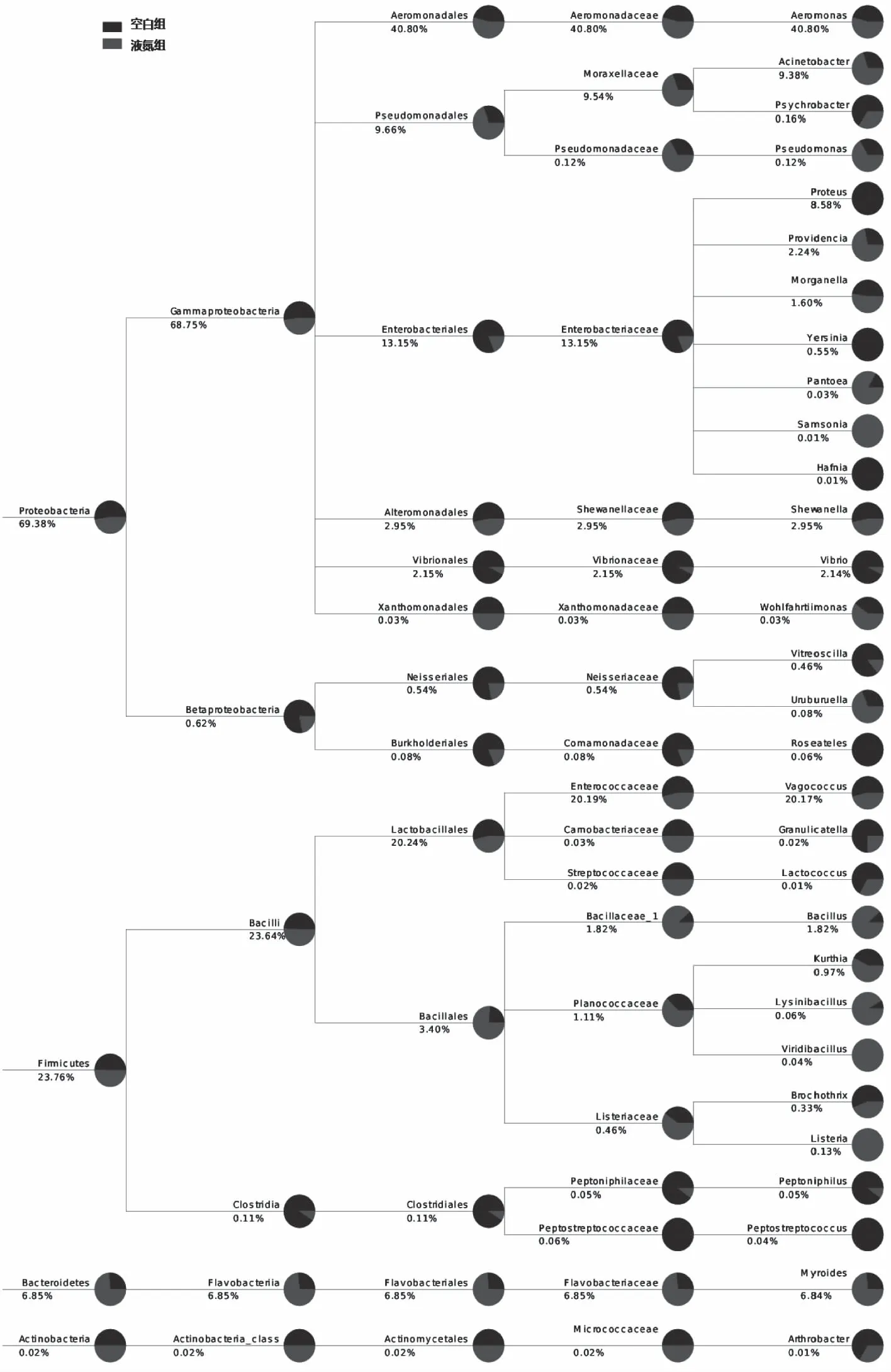
图8 属水平上所有样品丰度前30的物种分类系统组成树状图Fig.8 The level of all genus on the abundance of the top 30 species classification system composed of tree
3 结论
液氮冷冻处理养殖大黄鱼能够降低储藏期TBA的增长速度,抑制鱼肉脂肪的氧化,更好的保持大黄鱼的品质,延长货架期;能够降低TMA的增长速度,减少不良气味的生成,降低鱼肉鲜度下降的速度;能够降低TVB-N的增长速度,减少内源性酶蛋白和非蛋白氮化合物的降解,更好的保证鱼肉的品质,延迟腐败的进程;液氮处理能够降低K值的增长速度,减少营养成分的分解和鲜度的下降,延长保质期;液氮冷冻处理能够降低其菌落总数,并改变其菌群结构,具有良好的抑菌及杀菌效果。综上所述,液氮冷冻处理能够延迟养殖大黄鱼腐败变质的进程,让大黄鱼能够保存更长的时间。
本文初步探究了液氮冷冻处理对大黄鱼菌群结构的影响,结果表明液氮冷冻处理养殖大黄鱼对其菌群结构有一定影响,对部分微生物具有杀菌效果,而菌群结构的改变对养殖大黄鱼储藏期品质变化的具体影响及相互联系还需进一步研究。此外,鱼肉中还含有大量的内源酶,包括蛋白酶、脂肪酶等,液氮冷冻处理在影响鱼肉保鲜品质的同时,也会对鱼肉蛋白质结构和功能特性产生影响,探究液氮冷冻处理对养殖大黄鱼蛋白质的功能特性及理化指标的影响,对控制鱼肉品质,探究影响机理具有重要意义。

