浅析溶液中离子浓度大小的比较
◎付洵
溶液中离子浓度大小的比较既是高中化学的重点又是难点,是多数教师难教,大部分学生难学的内容之一,在中国高考制度下,只要有高考存在,高考的评价方式不变,溶液中离子浓度大小的比较是必考的,也是考得比较灵活的。
广州市铁路一中周伟锋校长4月份到毕节市实验高级中学进行帮扶培训,他说:“没有高考升学率的学校是没有品位学校”,众人都说:“分分分,学生的命根;考考考,老师的法宝。”只要考试制度不变,评价学生的方式不变,分数就成为衡量学生唯一的标准。高考理科综合中,化学是学生感觉比较困难的学科,试题比较灵活,内容较多,其得分率最低,化学就成为很多学生的一块短板,所以得化学者得理科。化学试题中有些题目学生无从下手,更不要说得分了,针对这一难题。本人通过归纳和总结此类习题的审题和解题方法,让学生更容易突破获这个点。高考化学,溶液中离子浓度大小比较主要考查电荷守恒、物料守恒和质子守恒。其中电荷守恒和物料守恒容易理解和掌握,而质子守恒是学生难于理解和掌握的,为了让学生轻而易举地理解和掌握质子守恒并获得高分,本人将溶液中离子浓度大小比较进行分类突破和总结。下面先分析Na2CO3在溶液中的质子守恒。第一种方法:根据水溶液中水电离出H+浓度等于水电离出OH-浓度,即H+和OH-的去向,得);第二种方法:根据水溶液中得失质子守恒:

(说明:H2O得H+后变为H3O+写成H+)

根据水溶液中得失质子守恒,得C(OH-)=C(H+)+C(HA-)+2C(H2A)。NaHA在溶液中的质子守恒,第一种方法:根据水溶液中水电离出 H+浓度等于水电离出 OH-浓度,即 H+和 OH-的去向,得 C(OH-)+C(A2-)=C(H+)+C(H2A)。第二种方法:根据水溶液中得失质子守恒:
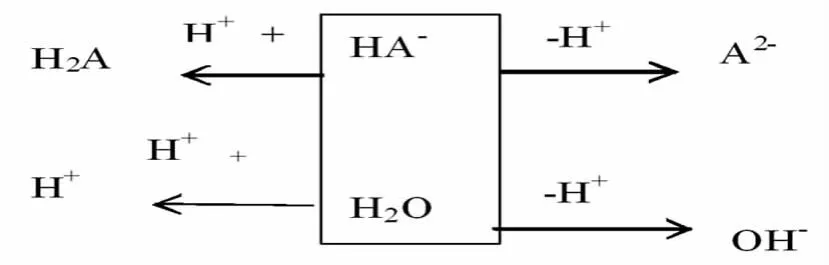
得C(OH-)+C(A2-)=C(H+)+C(H2A)。
以上是针对强碱弱酸盐,对于强酸弱碱盐来说,可以用同样的方法来处理。
铵盐在水溶液中的质子守恒,把铵根失质子后的NH3的写成NH3·H2O就可以了。例如,氯化铵溶液中的质子守恒是可以用电荷守恒和物料守恒来推导,但没有直接用框图法书写来得简单明了,学生也特别容易理解和掌握,本有用以下方法来处理:第一种方法:根据水溶液中水电离出H+浓度等于水电离出OH-浓度,即H+和OH-的去向,得C(H+)=C(OH-)+C(NH3.H2O);第二种方法:根据水溶液中得失质子守恒得:

(说明:NH3在水溶液中写成NH3.H2O)
另外,还有一种有机物的强碱弱酸盐,例如,醋酸钠溶液中的质子守恒,第一种方法:根据水溶液中水电离出H+浓度等于水电离出OH-浓度,即H+和OH-的去向,得 C(OH-)=C(H+)+C(CH3COOH);第二种方法:

得C(OH-)=C(H+)+C(CH3COOH)。以上是单一的强酸弱碱盐或强碱弱酸盐溶液中质子守恒的书写方法。那么对于复杂的两种或两种以上混合溶液中质子守恒又怎样处理呢?同样也可以用这种方法处理,例如,将等浓度醋酸钠和醋酸溶液等体积混合,直接用第二种方法写出其质子守恒为:
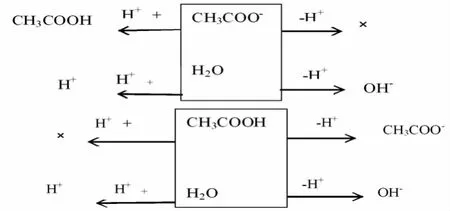
将两个框图得失质子的同一方向的相加:C(CH3COOH)+2C(H+)=C(CH3COO-)+2C(OH-)
最后大家可以通过以下两道例题来比较一下用物料守恒和电荷守恒来推导质子守恒与直接用框图法来写质子守恒的难易。
例1:同浓度同体积的CH3COONa与CH3COOH混合液
物料守恒:c(CH3COO-)+c(CH3COOH)=2c(Na+)……①
电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)……②
质子守恒 =2×②-①
2×②得:2c(Na+)+2c(H+)=2c(CH3COO-)+2c(OH-)
质子守恒:2c(H+) +c(CH3COOH) =c(CH3COO-) +2c(OH-)
同浓度同体积的NH4Cl与NH3·H2O混合液,其质子守恒为:

例2:同浓度同体积的NH4Cl与NH3·H2O混合液
总之,用物料守恒和电荷守恒来推导质子守恒是比较麻烦的,直接用框图法写质子守恒是比较容易的,在高考中,如果遇到这种题目,考生用框图法来解决,既节约时间,又提高做题的准确度。

