IL10RA基因突变致极早发型炎症性肠病患儿肠道菌群特征横断面调查
薛爱娟 苗士建 孙 桦 仇晓霞 王胜楠 黄 瑛
炎症性肠病(IBD)是一组慢性复发性肠道炎性疾病,发病年龄<6岁的IBD称为极早发型IBD(VEO-IBD)。VEO-IBD是儿童IBD的一种特殊亚型,占儿童IBD的4%~10%,常可检测到基因缺陷[1]。可致IBD样表型的单基因突变中,以IL10及IL10R的功能缺失性突变最为常见[2]。IL10R由2个亚单位构成,分别由IL10RA及IL10RA编码。我国VEO-IBD的基因缺陷以IL10RA突变最为常见[3, 4]。IL10RA基因功能缺陷的VEO-IBD患儿多有结肠累及,且结肠病变重;而消化道中又以结肠部位细菌数量居多,提示肠道菌群在IL10RA基因功能缺陷患儿的肠道炎症发生发展中可能发挥作用[3, 4]。然而,目前尚无基于16S rRNA基因测序方法对IL10RA基因功能缺陷患儿肠道菌群组成的描述。
1 方法
1.1 研究设计 以复旦大学附属儿科医院(我院)消化科病房和门诊为横断面调查现场,纳入IL10RA基因功能缺陷致VEO-IBD患儿(IL10RA组)、未检测到基因功能缺陷的类似症状患儿(症状组)及年龄匹配的健康儿童(健康组),采用16SrRNA基因测序方法检测并分析3组人群粪便样本的菌群组成及多样性。
1.2 伦理 本研究方案获得我院伦理委员会批准。
1.3IL10RA基因突变的诊断方法和标准 外周血提取的基因组DNA经过全外显子检测(WES)和Sanger测序验证,存在可以解释临床表型的致病性突变,且为已报道过的致基因功能缺失的突变位点。
1.4IL10RA组和症状组纳入标准 ①我院消化科就诊的0~5岁儿童;②性别不限;③有IBD临床表现,如慢性腹泻、腹痛或便血,粪便钙卫蛋白≥200 μg·g-1[5, 6],临床疑诊VEO-IBD,需要行WES检测加以确诊;④父母/监护人了解本研究目的,签署书面知情同意书。符合本文IL10RA基因功能缺失性突变者为IL10RA组,未检测到突变者为症状组。
1.5 健康组纳入标准 ①在我院职工家属中招募健康儿童;②2周内未服用益生菌及抗生素;③IL10RA组和症状组<1岁患儿按月龄行健康儿童匹配、>1岁患儿则按年龄进行匹配。
1.6 粪便标本采集IL10RA组和症状组于入院后第1次粪钙卫蛋白检测时留取2份粪便标本,1份用于检测肠道菌群组成及多样性。留取过程使用无菌容器及取样器,由专人取未接触容器壁且位于中深部的粪便标本约250 mg,在12 h内抽提DNA或转移至-80℃保存直至DNA抽提。健康组用课题组统一发放的含保存液的采集管在家留取粪便标本,于5 d内抽提DNA或转移至-20℃保存直至DNA抽提。
1.7 肠道菌群检测
1.7.1 细菌总DNA提取及质检 采用粪便DNA提取试剂盒 FastDNA®SPIN Kit for Soil(MP公司,美国),按产品说明书操作。使用超微量分光光度计 NanoDrop 2000(Thermo Fisher Scientific公司,美国)检测DNA浓度及纯度,1%琼脂糖胶电泳检测DNA完整性。
1.7.2 PCR扩增 扩增区域为细菌16SrRNA基因 V3-V4区(上海生工生物工程股份有限公司,中国),引物序列为338F (5’-ACTCCTACGGGAGGCAGCAG-3’)和806R (5’-GGACTACHVGGGTWTCTAAT-3’) 。PCR扩增体系为20 μL,扩增程序为:95℃ 预变性3 min,30个循环(95℃ 变性30 s,55℃ 退火30 s, 72℃ 延伸30 s),最后72℃延伸10 min (PCR仪:美国ABI公司GeneAmp®9700型)。
1.7.3 PCR产物定量与均一化 将同一个样本及其2个复孔的PCR产物混合后行2%琼脂糖凝胶电泳,采用PCR产物回收试剂盒(上海美吉生物技术有限公司)回收PCR产物。按照每个样本的测序量要求,将提纯的PCR扩增产物按相应比例混合,将不同样本混在1个文库中,使后续文库的测序量达到上机要求(测序量与PCR总量之间具有一定的相关性)。每个样本使用的引物都带有1个barcode来区分样本。
1.7.4 Miseq文库构建及Illumina测序 取1.7.3中的混合物所构建的基因文库,用MISEQ 测序仪(Illumina公司,美国)测序。
1.8 临床资料采集 ①从病史中收集IL10RA组和症状组患儿入院时的年龄、性别、身高、体重、出生方式,胎龄(<37周为早产)及取样前1个月内抗生素使用天数;②鉴于健康组来源于我院职工家属中招募的健康儿童,身高、体重以2005年中国九市7岁以下儿童体格发育调查相应年龄的P75身高、体重值为标准[7];③健康组询问家长年龄、胎龄(<37周为早产)和取样前1个月内抗生素使用情况。
1.9 统计学分析 计量资料,如服从正态分布,以均数±标准差表示;不服从正态分布,以中位数(四分位间距)表示。服从正态分布且方差齐性的两组计量资料比较采用t检验,3组计量资料比较采用单因素方差分析,等级资料的比较采用卡方检验。对于非正态分布的计量资料及计数资料的两组比较采用Mann-WhitneyU检验,3组之间比较采用Kruskal-Wallis非参数检验,并采用Bonferroni进行两两比较校正。P<0.05为差异有统计学意义。
肠道菌群测序结果分析:①使用生物信息学分析软件FLASH和Trimmomatic实现数据去杂;②按照97%相似性对非重复序列(不含单序列)进行OTU聚类,采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析;③采用mothur软件(v.1.30.1) 计算多样性指数;④多级物种Sunburst图、偏最小二乘法判别分析(PLS-DA)和随机森林树分析均采用R语言工具统计和作图;⑤线性判别分析采用LEfSe多级物种差异判别软件。
2 结果
2.1 一般情况 2016年10月1日至2017年11月1日在我院符合本文IL10RA组和症状组纳入标准的连续样本分别为17例和15例,健康组22人。表1显示3组的基线特征比较。身高及取样前1个月内抗生素平均使用天数在3组间差异有统计学意义。IL10RA组和症状组的年龄、性别、身高、体重、剖宫产率、早产率及取样前1个月内的抗生素平均使用天数差异均无统计学意义。本研究未询问健康组剖宫产信息。
2.2 菌群多样性分析 图1显示,IL10RA组、症状组和健康组的平均Shannon多样性指数值分别为1.11±0.87、1.43±0.55和1.86±0.53,IL10RA组及症状组均低于健康组,IL10RA组更为显著;IL10RA组的标准差最大,提示IL10RA组患儿的组内菌群变异度高;3组Simpson多样性指数分别为0.48±0.31、0.32±0.20和0.19±0.11,与Shannon指数结果一致。
2.3 群落分类学结构分析 表2显示肠道细菌主要门分类学水平下的物种构成,分析发现,菌属在各组中的分布比例不同,如厚壁菌门是该年龄段婴幼儿的优势菌门。健康组厚壁菌门分类学水平下的菌属比例均衡,症状组和IL10RA组中链球菌属和肠球菌属的平均丰度之和分别占厚壁菌门的61.8%和63.8%。健康组的放线菌门中双歧杆菌属比例为97.8%;症状组放线菌门中的双歧杆菌属比例为53.8%,罗氏菌属比例为31.7%;IL10RA组放线菌门则以罗氏菌属为主,占64.3%。3组变形菌门主要由肠杆菌属、埃希氏菌属-志贺菌属及克雷伯菌属构成,物种构成比例较相似。3组拟杆菌门均以拟杆菌属比例最高。其中,IL10RA组中另有普氏菌属占33.3%。
2.4 属分类学水平相对丰度比较 图2显示,有17种菌属在IL10RA组和健康组间差异有统计学意义(P<0.05)。其中双歧杆菌属、普拉梭菌属、毛螺杆菌科_NC2004_group、Fusicatenibacter、肠球菌属、[Eubacterium]_rectale_group、[Eubacterium]_ventriosum_group和毛螺杆菌科_UCG-004共8种菌在IL10RA组与健康组、症状组与健康组的两两比较中差异有统计学意义。除了肠球菌属外,其余7种在IL10RA组及症状组中的丰度均降低。双歧杆菌属、普拉梭菌属、unclassified_f_Peptostreptococcaceae和Fusicatenibacter4种菌属的相对丰度经Bonferroni校正后的差异仍有统计学意义(P<0.017)。仅在IL10RA组与健康组的比较中差异有统计学意义的9种菌属也都以在IL10RA组中丰度降低为主。在症状组与健康组的比较中丰度差异有统计学意义的10个菌属,除了链球菌属及颗粒链菌属外,其他8种菌属的相对丰度在症状组中也均降低。
注 1)Kruskal-Wallis检验;2)Mann-Whitney U检验;3)卡方检验;4)单因素方差分析;5)t检验 ;P1为3组比较P值,P2为IL10RA组和症状组比较P值
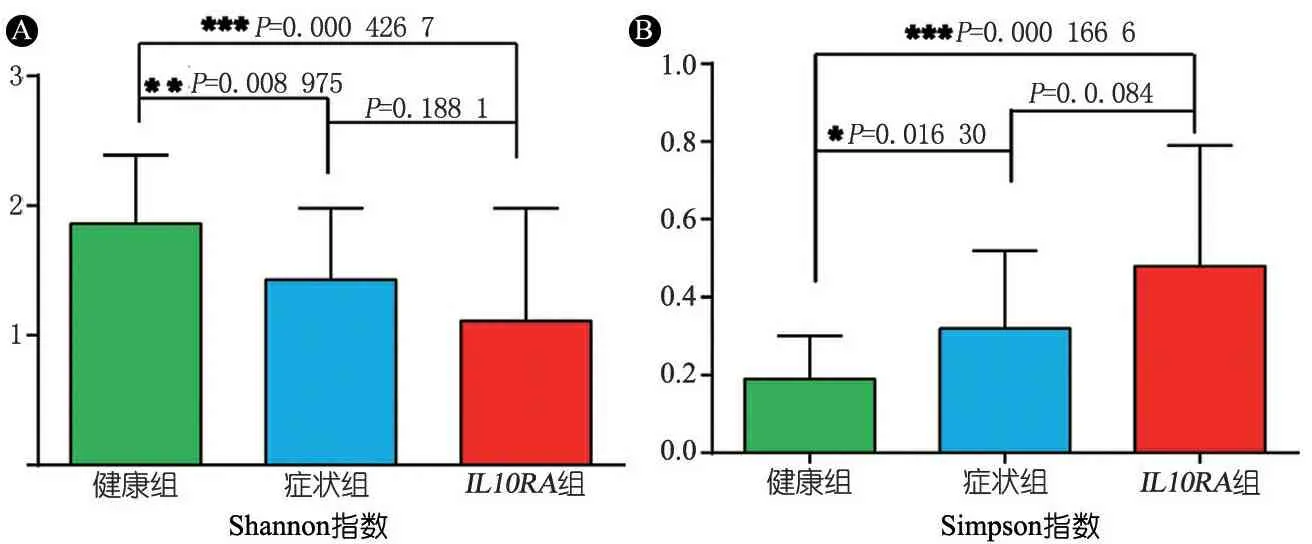
图1 3组肠道菌群多样性指数比较
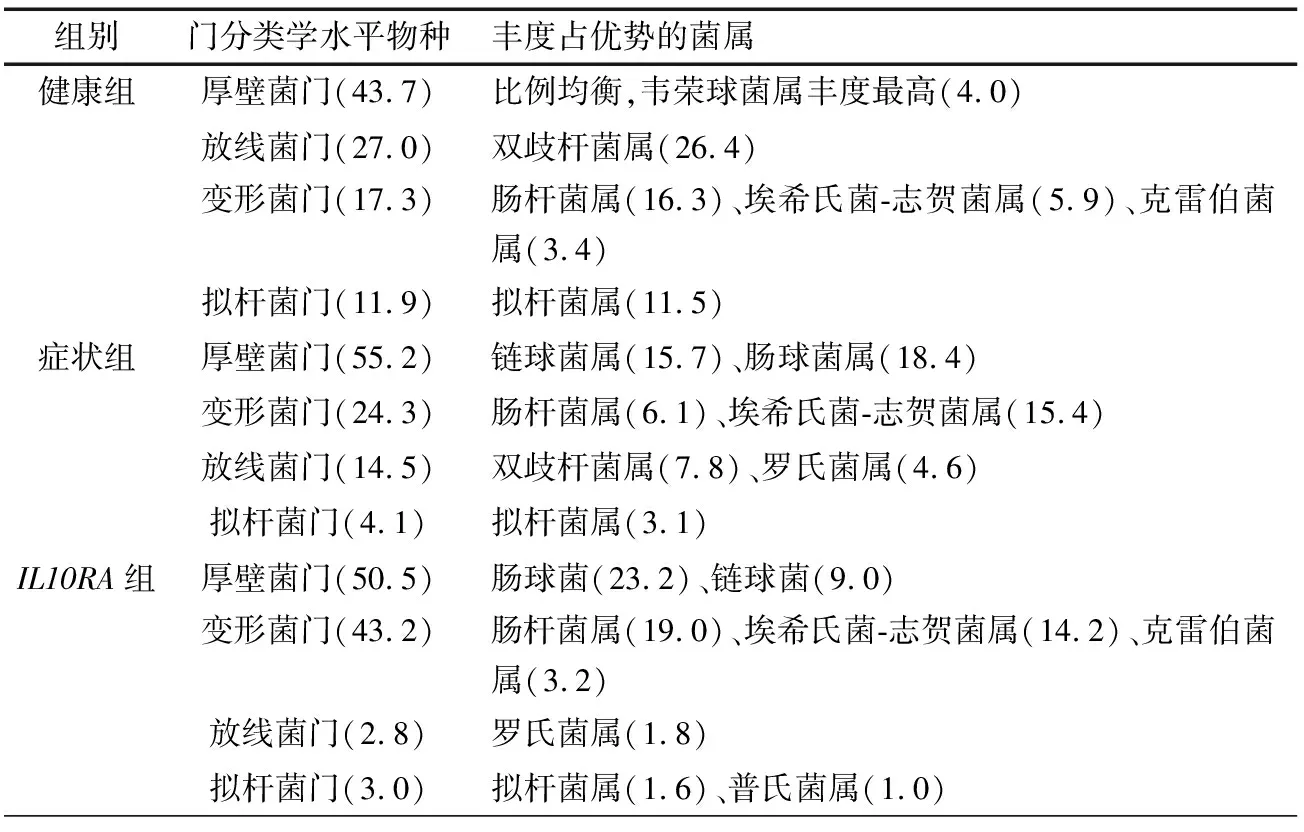
表2 3组门分类学水平下丰度占优势的菌属(%)
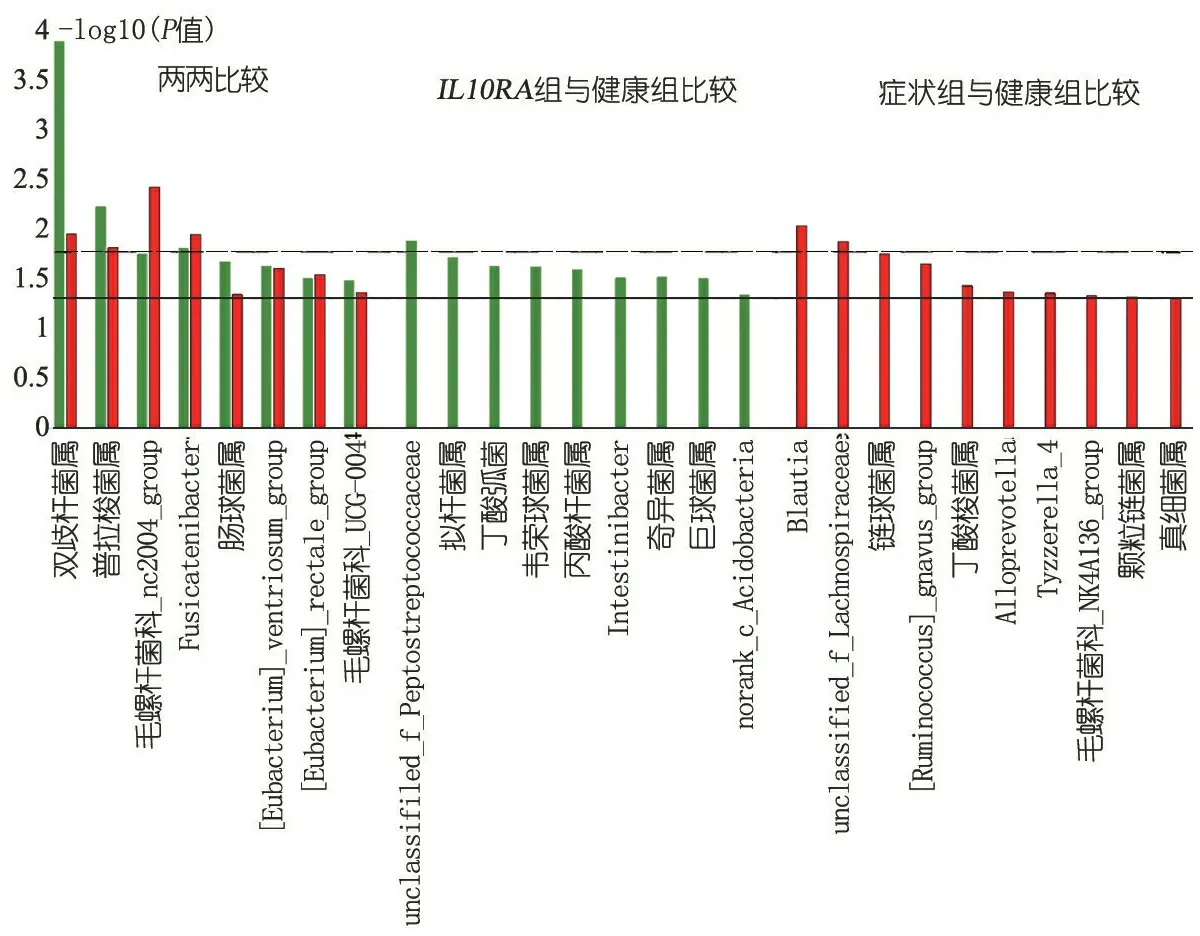
图2 组间比较中相对丰度差异有统计学意义的菌属
注 图中绿柱代表在IL10RA组和健康组比较中相对丰度差异有统计学意义的菌属对应的P值取-log10数值;红柱表示在症状组及健康组比较中相对丰度差异有统计学意义的菌属对应的P值取-log10数值。图中实线代表P<0.05时-log(0.0.5)=1.30; 虚线代表经过Bonferroni校正后的差异仍有统计学意义P<0.017时-log(0.0167)=1.78
3 讨论
本文基于16S rRNA基因测序方法采用横断面调查对IL10RA基因功能缺陷患儿肠道菌群组成进行分析。我院消化科在1年期间纳入了IL10RA基因功能缺陷致VEO-IBD患儿17例和未检测到基因功能缺陷的类似症状患儿15例的连续样本,对于罕见病的横断面调查,一是样本量较大,二是纳入病例避免了选择性偏倚。
随着基因诊断技术的进展,临床科研工作中对IL10RA基因突变导致的VEO-IBD的诊断、临床特点及治疗的认知已有所提高[1, 3, 4]。本研究分析了IL10RA基因功能缺陷患儿肠道菌群的分布及其水平。IL10RA组患儿的肠道菌群多样性较健康组降低,且IL10RA组患儿的组内菌群多样性变异度更高。菌群变异度高可能与患儿的肠道菌群恢复力下降有关[8]。健康的肠道菌群受到外界环境干扰时,有一定的恢复力,能够在一定范围内维持相对稳定[8]。疾病状态下,肠道菌群可能因抗生素暴露等外界原因导致恢复力受损。而内源性因素的干扰,例如IL10RA基因功能缺陷,则有可能使肠道菌群恢复力受损程度加剧,甚至失去恢复力,导致组内变异度大[9]。
本研究中肠道菌群结构分析表明,IL10RA组放线菌门、厚壁菌门及拟杆菌门分类学水平下的丰度比例最高的菌属发生了改变。在IL10RA组中相对丰度比例高的菌属包括罗氏菌属、肠球菌属、链球菌属及普氏菌属。其中,肠球菌是院内感染的重要病原菌。普氏菌属是引起感染的常见致病性厌氧菌。链球菌属多数不致病,有些菌种如化脓性链球菌可引起化脓性炎症。罗氏菌属的胺胨罗斯氏菌属于口腔及呼吸道的正常菌群,但在免疫缺陷患儿中仍被认为是机会性致病菌[10]。从这些菌属的生物学特性可推测IL10RA组患儿的肠道菌群可能有潜在致病性。
Takaishi等[11]通过定量PCR技术检测发现,IBD患者粪便菌群中的拟杆菌属、双歧杆菌属及韦荣球菌属丰度降低,乳杆菌属及肠球菌属相对丰度增加。Shaw等[12]观察到新发IBD患者中的粪球菌属、Adlercreutzia属及柔嫩梭菌属的丰度降低; 而Akkermansia属、梭杆菌属及韦荣球菌属丰度增高。Gevers等[13]联合16SrRNA基因检测和宏基因组技术发现,克罗恩病患者的大肠杆菌、具核梭杆菌、小韦荣球菌及麻疹孪生球菌增加,而其他菌属减少。本研究中IL10RA组中除肠球菌的丰度明显增加,肠道菌群失衡表现为肠道共生菌的丰度减少。梭杆菌属及孪生菌属的相对丰度低或未检测到。研究表明,具核梭杆菌在结肠癌患者的结肠组织中丰度高,并且该菌与化疗耐药有关。这些菌属多在更年长人群的肠道中出现,可能因为肠道菌群存在时间上的演替变化[14, 15]。
本文局限性:①IL10RA组和症状组的患儿均经过了不同程度的抗生素干预,本文所反映的肠道菌群不论是门还是属水平,都不能代表IL10RA组和症状组患儿起病状态的水平,尽管以症状组作为抗生素使用对照,但IL10RA组和症状组应用的抗生素种类、剂量和时间是有差别的;②本研究采用的是16SrRNA测序技术,对物种分类学水平仅注释到属水平。将来可采用宏基因组鸟枪法等更高分辨率的技术鉴定出更多物种,且可注释到相应的菌株水平的物种,对于菌群特征的描述将更为全面。

