3.0T磁共振全身扩散加权成像对急性白血病骨髓浸润监测价值的研究*
中山大学附属东华医院放射科(广东 东莞 523110)
李志娟 邹玉林 刘 晓漆 强 吴东升
急性白血病(acute leukemia,AL)是造血干细胞的恶性克隆性疾病,肿瘤细胞在骨髓内弥漫性生长,骨髓穿刺细胞学分析是诊断和疗效监测的金标准[1],治疗随访过程中反复多次的骨髓穿刺活检,给患者身心带来较大的痛苦。WB-DWI可以在自由呼吸状态下完成全身大范围扫描,经三维后处理得到高信噪比图像,可立体、直观的显示骨髓病变的部位、范围,并能定量测定病灶区域表观扩散系数(ADC)值[2],但目前国内将WB-DWI应用于AL临床疗效监测的报道仍非常少见。本研究收集30例初诊AL患者的临床及影像资料,旨在探讨WB-DWI在AL患者治疗随访过程中疗效监测的价值,以减少患者治疗过程中骨髓穿刺的次数,减轻患者痛苦。
1 材料与方法
1.1 一般资料收集2016年7月至2017年10月在中山大学附属东华医院初次诊断和治疗的30例AL患者的临床及影像资料,男11例,女19例,年龄20~60岁,平均38.8岁,所有患者均根据临床表现与骨髓穿刺细胞学检查确诊;其中急性髓细胞白血病20例,急性淋巴细胞白血病10例。所有病例均无任何MRI检查禁忌症,无幽闭恐惧症。30例患者均在治疗前行WB-DWI检查,每位患者均在化疗过程中复查一次WB-DWI,化疗结束再复查一次WBDWI,复查当日进行骨髓穿刺活检一次。分别根据WB-DWI检查和骨髓穿刺细胞学分析评估患者的疗效。
1.2 研究方法
1.2.1 检查设备与方法:采用西门子MAGNETOM Verio 3.0T磁共振扫描仪,信号采集采用4个相控阵表面线圈(头-颈联合线圈和2个腹部表面线圈),相邻线圈之间重叠5~10cm。扫描参数:TR 8100ms,TE 83ms,FOV 40cm×40cm,层厚5.0mm,无间距扫描,矩阵192×192,采集次数5次;采用STIR-EPI、b值=800s/mm2。全身共分5段完成,每段40层,范围为240mm,扫描范围从头顶至膝关节下缘水平,每段扫描时间为4min30s,全身扫描共计22min30s。扫描结束后采用图像后处理工作站对各段的原始图像进行自动拼接,对拼接后的WBDWI图像进行三维最大信号投影(MIP)重建,并且利用黑白反转技术,形成“类PET”图像。
1.2.2 图像分析:对经过后处理得到的WB-DWI图像进行对比分析,同一病例、不同时期采集的WB-DWI图像采用统一的窗宽、窗位显示。分析同一病例治疗前、治疗过程中、治疗结束后全身骨髓灰度改变,并分别与同期骨髓穿刺细胞学改变进行对照。
1.2.3 图像测量:因颈椎椎体体积较小、骶尾椎形态较不规则,且颈部伪影较多,影像测量的准确性,故仅对胸、腰椎体及双侧髂骨进行ADC值的定量测量。每次测量分别由两位主治以上医师独立进行,取二者平均值,测量范围为胸1~12椎体及腰1~5椎体、双侧髂前上棘,共计19个感兴趣区(ROI),统一采用圆形ROI,直径0.5~1.5cm,ROI不超出椎体及髂骨骨髓范围。19个ROI所测得的ADC值平均值作为最终测量值。
1.2.4 疗效评估:治疗后疗效评估采用AL的疗效标准,分为完全缓解(CR)、部分缓解(PR)、未缓解(NR)。
1.3 统计学分析采用SPSS 19.0统计分析软件。计数资料的比较采用χ2检验,计量资料的比较采用t检验,P<0.05为差异有显著性意义。
2 结 果
2.1 30 例AL患者经过多个疗程诱导治疗后,CR者19例(AML 13例,ALL 6例),PR者6例(AML 4例,ALL 2例),NR者5例(AML 3例,ALL 2例)。治疗后疗效为CR者(19例)WB-DWI图像显示治疗后骨髓信号明显高于治疗前,PR者(6例)大部分区域骨髓治疗后信号高于治疗前,而NR者(5例)治疗前、中、后骨髓信号变化不明显,见图1-6。
2.2 30 例AL患者共对570个ROI进行ADC值测量(表1、表2)。治疗前CR、PR、NR患者间ADC值差异无统计学意义(P>0.05);CR、PR患者治疗前、治疗中、治疗后三组间ADC值两两对比差异均具有统计学意义(P<0.05);NR患者治疗前、治疗中、治疗后三组间ADC值两两对比差异无统计学意义(P>0.05);CR与PR患者治疗中、治疗后ADC值差异的比较均无统计学意义。
3 讨 论
DWI可以检测人体内水分子的运动,从而反映组织的结构特点及生物学行为,在常规MRI检查出现异常表现之前,为疾病的诊断和治疗提供及时、有效的信息。不同组织结构中,水分子的运动能力和运动方向不同,而ADC值可以定量反映水分子的运动能力,为疾病的治疗随访、疗效监测及预后评估提供了定量信息。已有较多研究表明DWI在实体肿瘤的治疗后效果与预后的评估中具有重要意义[3]。随着磁共振软、硬件技术的发展,大大缩短了DWI扫描时间,磁共振全身扩散加权成像(WB-DWI)已逐步成熟、稳定,其高信噪比、三维立体的图像特点已可以与PET相媲美,在恶性肿瘤全身转移见检出与疗效监测中发挥重大作用[4]。由于血液病全身骨髓浸润的特点,而常规MRI序列缺乏特异性和定量分析能力,WBDWI因其较高的敏感性,逐渐被应用于血液病的疗效监测[5]。
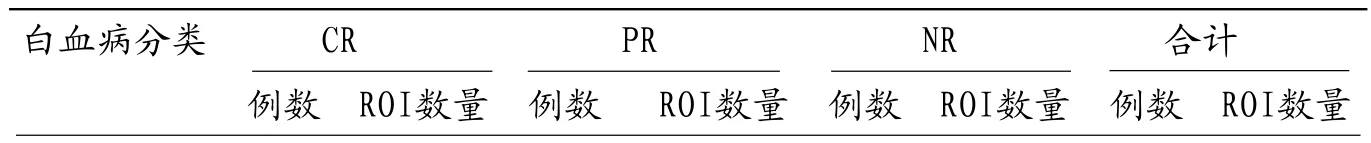
表1 30例急性白血病患者不同疗效例数及ROI数量分布
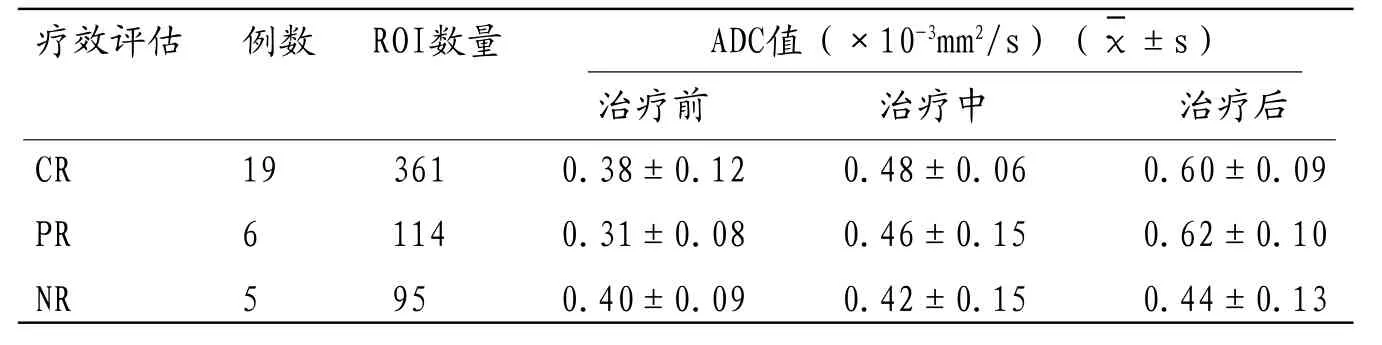
表2 不同疗效的急性白血病患者治疗前、中、后ADC值变化情况
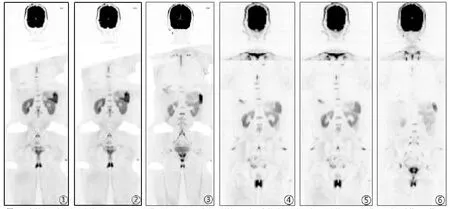
图1-6 急性白血病患者治疗前、治疗后WB-DWI图像对比。图1-3:患者,男性,33岁,急性髓细胞白血病,治疗前WB-DWI图像显示患者胸椎、腰椎、骶椎、骨盆及双侧股骨信号弥漫性减低。图4-6:同一患者经治疗后,骨髓穿刺细胞学提示完全缓解(CR),WB-DWI图像显示患者部分胸椎、腰椎、骶椎、骨盆及双侧股骨信号明显增高。
AL患者的正常骨髓被异常增殖的肿瘤细胞所取代,骨髓中细胞密度增大,水分子的运动受限、扩散能力减低,ADC值变小[6]。尽管如此,因急性白血病为全身骨髓弥漫性病变,WB-DWI表现为全身骨髓的弥漫性信号异常,无法与同一患者正常骨髓信号相对照,故难以明确诊断。虽然已有学者采用WB-DWI研究健康成人骨髓ADC值[7],但不同年龄、性别的成人骨髓ADC值差异较大[8],故缺乏参照价值。因而WBDWI在急性白血病的诊断中应用价值仍旧非常有限。
AL患者治疗过程中使用的化疗药物具有细胞毒性作用,故化疗过程中骨髓正常细胞和白血病细胞数量均会减少,骨髓细胞密度减低,骨髓充血水肿使细胞外间隙增宽、水分增加,以上因素均导致水分子运动能力增加,ADC值升高[9]。本组数据显示,CR患者治疗过程中、治疗后ADC值逐渐增加,但PR患者治疗过程中ADC值出现同样的表现,CR与PR患者治疗前、治疗中、治疗后的ADC值变化的比较均无显著差异,笔者认为骨髓水肿、细胞密度减低共同作用导致ADC值的增加,故ADC值的增加不能单独预测白血病细胞的减少。NR患者治疗过程中及多个疗程化疗后ADC值的升高不明显,可能的原因是白血病细胞对化疗药物不敏感,细胞数量减少不明显[10]。
AL患者治疗过程中,骨髓水肿、骨髓正常细胞和白血病细胞的减少均为导致ADC值增高的重要因素,但疗效监测过程中,主要需要明确减少白血病细胞的减少程度,而骨髓水肿的影响削弱了ADC值对细胞密度减低的预测能力[11]。本组数据也表明依靠WBDWI图像及ADC值定量测定均无法区别CR患者与PR患者。因此,如何尽量减少骨髓水肿对ADC值测量的影响,增加细胞密度对ADC值的影响权重是下一步研究方向。
综述所述,WB-DWI成像及ADC值定量测定在AL患者治疗随访过程中,可以区分CR、PR与NR患者,在AL患者的疗效监测中具有一定的价值,可以一定程度的减少骨髓穿刺的次数,从而减少患者痛苦。

