2型糖尿病大鼠肾组织NF-κB水平的变化
江思瑜 孙 霓 李金航 吴晓光
(承德医学院基础医学院,河北 承德 067000)
糖尿病(DM)肾病(DN)具有起病隐袭、进展缓慢、高致残致死率的特点,是发达国家慢性肾衰的首位病因〔1〕。目前已发现高血压、血液改变、氧化应激、炎症机制等参与了DN的形成,但对于DN发病的确切机制尚不完全清楚〔2〕。核因子(NF)-κB作为主要的转录因子之一,具有多向性,参与机体多种生理调节,如:细胞的增殖与凋亡、炎症、免疫等〔3〕。本研究旨在探究NF-κB在DN形成中所扮演的作用。
1 材料与方法
1.1材料 100只健康SD大鼠(北京维通利华实验动物技术有限公司),高脂高糖饲料(北京博泰宏达生物技术有限公司),链脲佐菌素(STZ)(美国Sigma公司),兔抗鼠p50单克隆抗体(Santa Cruz公司),二氨基联苯胺(DAB)试剂盒与SABC试剂盒(武汉博士德生物工程有限公司)。
1.2动物建模及分组 运用随机数字表法将100只SD大鼠分为正常组(NC组)与DM组,各50只,适应性喂养1 w。NC组饲喂正常饮食,DM组饲喂高脂高糖饮食4 w后,禁食禁水24 h,按30 mg/kg腹腔注射经缓冲液稀释的STZ,48~72 h后,大鼠尾静脉采血,连续3次所测空腹血糖(FBG)≥16.7 mmol/L,同时尿糖>()为模型建立成功准则,NC组则注射等量溶媒。
1.3实验方法 分别于建模成功后的2、4、8 w,称量大鼠体重(BW)后处死。处死大鼠前24 h开始收集代谢笼中大鼠尿液,甲苯防腐,混匀充分,300 r/min离心,取上清液检测24 h尿蛋白(UP)、尿糖。3.5%戊巴比妥麻醉下,于大鼠股静脉收集血液标本,300 r/min离心,取上清液分装,全自动生化仪检测血尿素氮(BUN)、血肌酐(SCr)、血清白蛋白(ALB)水平。120 mmHg高压下,4℃生理盐水多次漂洗肾脏至苍白,4%多聚甲醛溶液灌注,摘取肾脏,酒精梯度脱水,石蜡包埋,制作成厚度5 μm石蜡切片。石蜡切片依次二甲苯脱蜡、酒精脱水、苏木精染色、盐酸乙醇漂洗、酒精脱水、伊红乙醇复染、酒精脱水、二甲苯透明进行常规HE染色,光镜下观察肾脏病理变化。石蜡切片依次脱蜡、水化、微波抗原修复、滴加兔抗鼠p50单克隆抗体为一抗(1∶50稀释)过夜、滴加二抗、链霉亲和素-生物素复合物(SABC)孵育、DAB显色、复染、脱水、透明。高倍镜下,随机选取每张切片阳性细胞表达区的5个视野,统计阳性细胞表达数,取平均值。
1.4统计学方法 应用SPSS19.0系统进行t检验、线性相关性分析。
2 结 果
2.1各组生长指标检测结果 DM组2、4、8 w 24 h UP、FBG、BUN、SCr均较NC组显著增高(P<0.05),BW、血清ALB均较NC组显著降低(P<0.05)。见表1。
2.2各组肾脏结构变化比较 HE染色下,NC组各个时期肾脏结构无明显异常改变;DM组则均出现肾小球增大、基膜加厚、系膜扩增等病理变化,且随病程延长,病理变化愈加明显,在第8周,肾脏可见炎细胞浸润。见图1。
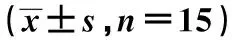
表1 各组生化指标检测结果
与NC组相比:1)P<0.05
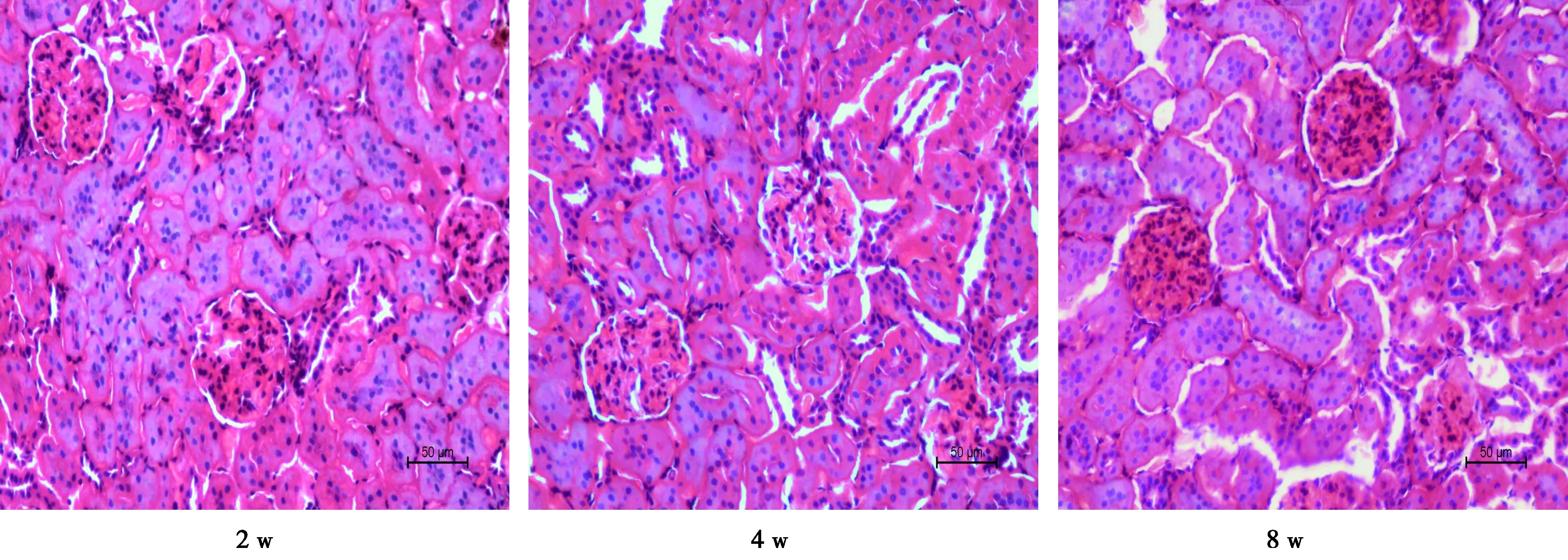
图1 DM组肾脏改变(×400)
2.3SABC免疫组化法检测NF-κB表达 NF-κBp50在NC组各时期大鼠肾脏中表达较少,2、4、8 w肾脏细胞有NF-κBp50表达的细胞个数分别为(1.26±0.74)、(1.58±1.23)、(1.47±1.03)个,且在胞质表达多于胞核表达;NF-κBp50在DM组各时期肾脏内均有阳性表达,并呈上升态势,2、4、8 w肾脏细胞有NF-κBp50表达的细胞个数分别为(10.57±4.77)、(23.99±7.76)、(32.36±5.87)个,较NC组显著增多(P<0.05)。
2.4相关性分析 NF-κBp50在肾脏中的表达与24 h尿蛋白定量呈正相关(r=0.852,P<0.05),与BUN呈正相关(r=0.715,P<0.05),与血清ALB呈负相关(r=-0.689,P<0.05)。
3 讨 论
几乎所有的细胞内都含有NF-κB〔4〕。NF-κB是一种调控基因表达的蛋白家族,由五个亚型组成,共同拥有Rel同源区,根据反式激活结构域(TD)的有无分为两类〔5〕,一类有TD类:Rel(cRel)、RelB、p65(RelA,NF-κB3);另一类无TD类:p50(NF-κB1)、p52(NF-κB2)。二元对称是NF-κB序列的结构特点,此特点决定了各个亚型必须发生二聚化,形成二聚体才可以发挥生物作用,最常见的二聚体是p50、p65二聚体〔6〕。当无刺激产生时,细胞处于静止,NF-κB的二聚体与NF-κB抑制因子(IκB)在细胞质内结合,处于无活性状态〔7〕;当受到外界刺激时,主要通过两种方式活化NF-κB,(1)经典途径〔6,8〕:IkBs经IkBs激酶(IKK)磷酸化自身两个特殊丝氨酸残基,随后结合SCF-E3泛素化连接酶,泛素化的IkBs与NF-κB二聚体解离,对NF-κB的抑制作用丧失,NF-κB活化,进入细胞核,与特定DNA序列结合,诱导基因转录;(2)非经典途径〔6,9〕:p105、p100分别是p50、p52的前体物质,除拥有p50、p52序列以外,还拥有IkB样锚蛋白区,此区参与对相应NF-κB的抑制,前体物质转变为p50、p52的机制尚不完全清楚,但这一过程中IKK-a和NF-κB诱导激酶所发挥的作用不可忽视。
UP、BUN、血清ALB等均可作为反映肾功能强弱的指标,推测NF-κBp50会对肾脏产生损害,并参与DN的致病。本文免疫组化结果与周谊霞等〔10〕结果相同。在李衍辉〔11〕的体外细胞培养研究中,同样发现高糖肾系膜细胞对NF-κB表达的影响呈现浓度及时间的依赖性。高糖环境所致的代谢异常可以诱导多种信号通路转导,刺激NF-κB激活因子生成,活化NF-κB表达〔12〕。以Toll样受体(TLR)4信号通路为例,高糖激活TLR4,刺激髓样细胞分化因子(MyD)88发生二聚化〔13〕,活化的TLR4结合MyD88的TIR结构域,同时MyD88的死亡结构域活化IRAK家族,IRAK1经IRAK4磷酸化后从MyD88上游离,转向肿瘤坏死因子受体因子(TRAF)-6进行结合,TRAF-6通过磷酸化IKK,激活NB-κB〔14,15〕。本研究结果提示NF-κB与DN病程关系紧密,这可能与持续的高糖环境刺激促使NF-κB活化因子生成增加,导致NF-κB表达增多有关。但也有学者〔11〕认为是高糖环境通过对去泛素化酶CYLDN表达的抑制激活了NF-κB,NF-κB激活后刺激下游细胞黏附分子、炎性因子、趋化因子等细胞因子表达,这些因子通过不同途径促进肾脏内皮细胞凋亡、加重炎细胞聚集、调控凝溶之间的平衡等,最终造成微血管病变,形成DN。

