补肾健脾活血方含药血清对UMR106细胞成骨分化和骨形成相关蛋白的影响
柴生颋 谢平金 万雷 林勇
1. 广州中医药大学第三附属医院骨科,广东 广州 510240 2. 广州中医药大学岭南医学研究中心中医骨伤科学实验室,广东 广州 510405 3. 广州中医药大学,广东 广州 510405
骨质疏松症(osteoporosis,OP)是临床常见的骨疾病之一,它是以一种由于骨强度降低而使骨折风险升高的全身性骨骼疾病,目前已在世界常见病多发病中居第七位,成为世界性前沿研究难题。且随着老龄化社会的到来,OP的发病率目前正以惊人的速度增长,防治骨质疏松症已成为当今国际上的研究热点。本实验,补肾健脾活血方含药血清对UMR106细胞成骨分化和骨形成相关蛋白的影响,以期从细胞分子学角度探讨补肾健脾活血方(骨康方)防治OP的作用机理。
1 材料和方法
1.1 实验动物及细胞
购置UMR106细胞(上海中科院);4月龄 SD 雌性大鼠40只, 用于制备含药血清。
1.2 实验药物
补肾健脾活血方(淫阳藿10 g、熟地黄10 g、肉苁蓉10 g、大枣10 g、当归10 g、 丹参10 g、菟丝子10 g、补骨脂10 g、黄芪10 g、白芍10 g),并在本院制剂室常规水煎制,浓缩,生药含量为1.43 g/mL。阳性对照药:戊酸雌二醇片(补佳乐,J20130009)。
1.3 实验试剂仪器及器械
UMR106细胞完全培养基配制:DMEM-高糖培养基(Hyclone,Cat. No.SH 30022.01B)+10%胎牛血清(Gibco,Cat. No.10099-141)+1%双抗(100 U/mL青霉素、100 U/mL链霉素),4 ℃放置,37 ℃水浴温浴后使用;CCK8检测工作液配制:10 μL CCK8检测原液+100 μL细胞完全培养基,混匀,现配现用;青链霉素,PBS缓冲液,胰酶(GENVIEW,Cat.No.9002-07-7),ALP测试盒南京建成(A059-1)Cell Counting Kit-8(Dojindo,Cat.No.CK04);超净工作台(苏州净化设备公司);低速离心机(Anke/飞鸽TDL-80-2B);倒置显微镜(MOTI);CO2细胞培养箱(Memmer,INC108);酶联免疫监测仪(Thermo Fisher Scientific,multiscan MK3);ALP 测定试剂盒(南京建成生物工程研究所生产,A059-1)。上海安亭科学仪器厂产品水平离心机 (上海安亭科学仪器厂产品,TDL-80-2B);普通培养箱(日本SANYO公司产品,DHP-02.420); HH-1数显恒温水浴锅 (金坛市晨阳电子仪器厂,XMTD203);Thermo酶标仪(MULTISKAN MK3);pH计(上海仪电科学仪器股份有限公司,02220128);台式高速离心机(上海安亭科学仪器厂,TDL-80-2B);恒压恒流电泳仪(北京市六一仪器厂,DYY-6C);冷冻高速离心机(珠海黑马医学仪器有限公司,Hema TGL-16R);气一电流仪(JUNY1,JY300);容声柜式冰箱(青岛海尔特种电器有限公司,BD/C310);立式超低温冰箱(青岛海尔特种电器有限公司,DW-86L486);扫描仪(MICROTEK,Bio-5000);AX-Ⅱ X射线摄影暗匣(广东粤华医疗器械, 127 mm×178 mm);SDS-PAGE垂直电泳槽(北京凯元伯乐生物科技有限公司,MP-8001);漩涡振荡器(上海精科实业有限公司,XW-80 A);超声破碎仪(宁波新芝生物科技股份有限公司,JY 92-IIN);多用脱色摇床(江苏新康医疗器械有限公司,XK-8);磁力搅拌器(常州国华电器有限公司,78);Tris-base、Glycine、 SDS(十二烷基硫酸钠)(上海生工,TB0194-2.5KG/GB0235-2.5KG/SB0485-500G);PVDF膜(Millipore,IPVH00010);医用X-光片(广西巨星医疗器械有限公司,SUPER RX-N-C 5×7);Acrylamide(丙烯酰胺)、BIS-Acrylamide(双丙烯酰胺)(Genview,GA006-500G/GN199-25G);Ammonium persulphate(过硫酸铵)(GENVIEW,GA019-50G);蛋白定量试剂盒(Thermo,23227);裂解液(碧云天,P0013);DTT(二硫代苏糖醇)碧云天(ST040);PMSF(苯甲基磺酰氟)、溴汾蓝(Genebase,329-98-6/ 115-39-9)。
1.4 含药血清的制备
将4月龄 SD 雌性大鼠40只,随机分成 5 组、每组 8只。低剂量组按2.4 g生药 /kg 大鼠体重灌胃,中剂量组按4.8 g生药 /kg 大鼠体重灌胃,高剂量组按9.6 g生药 /kg;阳性对照组每只大鼠灌胃大约戊酸雌二醇片0.1 g/ kg(用生理盐水溶至1 mL);空白血清组每只大鼠灌胃生理盐水大约20 mL/ kg。每天2次, 间隔5 h,,连续6天。第7天进行腹主动脉取血,并分离血清,过滤后分装,置于-80 ℃冰箱保存备用。
1.5 UMR106细胞的培养
①UMR106 细胞体外培养于完全培养基(4 ℃放置,37 ℃水浴温浴后使用),取出长至80%的UMR106细胞,吸掉旧培养液;用PBS洗涤细胞一至二次;加入胰酶溶液,轻洗细胞皿底部,吸掉胰酶溶液,放入37 ℃培养箱2~3 min,于倒置显微镜下观察,当细胞将要分离而呈现圆粒状时,加入新鲜完全培养基,使用移液器将细胞吹匀,制备单细胞悬液;②计数,并将细胞密度调整为1×105/mL;取出96孔板,接种100 μL密度为1×105/mL的细胞悬液,37 ℃、5%CO2培养过夜,次日,按:正常大鼠血清组;低剂量含药血清组;中剂量含药血清组;高剂量含药血清组;阳性对照组;分组进行加药,分别培养72 h。③细胞处理结束的前4 h,吸去培养液,按每100 μL完全培养基加入10 μL CCK-8将二者混合均匀后,每孔加入100 μL的CCK-8混合液,避免产生气泡,将培养板放到培养箱内孵育4 h,4h后,将96孔板中的培养基移至酶标板中,酶标仪检测450 nm处的OD殖。
1.6 ALP 活性的测定
ALP 活性测定试剂盒(南京建成生物工程研究所生产A059-1)检测各组细胞培养72 h后的ALP 活性,酶标仪上测定各孔A520 nm殖。并计算血清中ALP活力。
计算公式:
血清中AKP活力(金氏单位/100ml)=
1.7 OPN、RUNX2、BMP-2蛋白检测
各组经血清分别培养72 h后,按比例加入裂解液,充分裂解后,120 000 g离心2~5 min,取上清液。提取总蛋白,测定蛋白浓度。加入5×SDS蛋白上样缓冲液(5∶1),100 ℃煮沸5 min。-20 ℃保存备用。分别至于浓缩胶和分离胶中电泳,350mA转膜70 min。37封闭液中封闭1 h;将PVDF膜分别放入装有3 mL稀释后的OPN(稀释比例1∶8000,转膜条件:300 mA恒流转膜35 min,厂家:Abcam,货号:ab91655)抗体、RUNX2(稀释比例1∶1000,转膜条件:300 mA恒流转膜60 min,厂家:Abcam,货号:ab23981)抗体、BMP-2(稀释比例1∶4000,转膜条件:300 mA恒流转膜40 min,厂家:Abcam,货号:ab183729)抗体,25 mL TBST洗涤PVDF膜3次,每次5 min;将PVDF膜放入含有3 mL辣根过氧化物酶标记的稀释二抗溶液的小槽内,置于摇床上室温平缓摇动40 min(二抗:HRP Goat anti-Rabbit IgG(厂家:BOSTER,货号:BA1054,稀释比例:1∶20000,孵育条件:室温孵育40 min)25 mL TBST洗涤PVDF膜3次,每次7 min;用化学发光显色后进行图像分析,经软件分析,以OPN/GAPDH、RUNX2/GAPDHBMP-2/GAPDH比值表示OPN、RUNX2、BMP-2蛋白表达水平
1.8 统计学处理

2 结果
2.1 各组血清对UMR106细胞ALP活性的影响
如表1所示,与空白血清组比较,中剂量血清组、高剂量血清组和阳性对照组加药干预72 h后,细胞吸光度值均较低,差异有统计学意义(P<0.05);与空白血清组比较,低、中、高剂量血清组和阳性对照组加药干预72 h后,细胞ALP活性均较高,差异有统计学意义(P<0.05),且随着中药血清水平升高,ALP活性越高。

表1 各组血清对UMR106细胞增殖和ALP活性的影响Table 1 Effect of the serum on the cell proliferation and ALP activity in UMR106 cells of each group
注: 与空白血清组比较,*P<0. 05
2.2 各组UMR106细胞中的OPN、RUNX2、BMP-2蛋白水平
3 讨论
骨质疏松症(osteoporosis,OP)是临床常见的骨疾病之一,它是以一种由于骨强度降低而使骨折风险升高的全身性骨骼疾病。由于骨质疏松时骨强度下降,在生活中轻微外力作用下即可造成骨折,骨折作为OP最严重的并发症和早期死亡的危险因素之一[1],给患者及社会带来沉重负担。
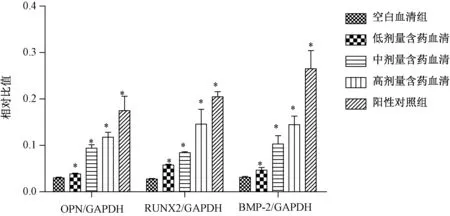
图1 各组UMR106细胞中的OPN、RUNX2、BMP-2蛋白水平注: 与空白血清组比较,*P<0. 05Fig.1 The protein concentrations of OPN, RUNX2, and BMP-2 in UMR106 cells of each group

图2 各组UMR106细胞中OPN、RUNX2、BMP-2表达凝胶电泳图Fig.2 The expression of OPN, RUNX2, and BMP-2 in UMR106 cells in each group
中医认为OP属于“骨痿”范畴,其病位在肾,发病关键是“肾虚”。随着年龄增长,肾中精气由充盛转而逐渐衰败,性腺功能亦随之渐渐衰退。根据传统中医理论,结合临床体会,我们认为肾虚是OP的主要病因,并由此筛选补骨脂、淫羊藿、肉苁蓉、熟地黄、菟丝子、黄芪等中药组成了治疗骨质疏松症的补肾健脾活血方(骨康方)。成骨细胞作为参与骨生成、生长、吸收及代谢的关键细胞,具有活跃的分泌功能,能合成和分泌骨基质中的多种有机成分,对骨生长有重要作用;此外,细胞表面存在多种骨吸收刺激因子的受体,细胞并能分泌一些细胞因子,调节骨组织形成和吸收。因此,鉴定新的重要的成骨细胞生长调节因子,深入研究骨发育和骨重塑的分子机制,就显得非常必要。我们在前期研究发现,补肾健脾活血方(骨康方)可以增加PMOP患者骨密度[2],且其含药血清对成骨细胞和破骨细胞均有影响,可改变细胞生存环境中OPG/ RANKL的比例,间接影响着破骨细胞的功能活性[3]。
本实验采用的大鼠类成骨细胞UMR106,保留了成骨细胞形态和性质上独有的特征,具有稳定、均一、纯度高、易于培养等优点,现已广泛用于代替成骨细胞的细胞系,并用于研究各种调控骨质疏松的激素、生长因子在细胞水平上治疗骨质疏松的作用机制[4-6]。故本实验选取UMR106作为代替成骨细胞,以研究补肾健脾活血方(骨康方),在促进成骨分化中的作用。碱性磷酸酶作为成骨细胞分化早期分泌和高表达的标志酶,具有一定的特异性标志[7]。本研究发现,与空白血清组比较,低、中、高剂量血清组和阳性对照组加药干预72 h后,细胞吸光度值均较低(P<0.05), 而随着含药血清水平的增加,对UMR 106细胞增殖的促进作用相对减弱;与空白血清组比较,低、中、高剂量血清组和阳性对照组加药干预72 h后,细胞ALP活性均较高(P<0.05),且随着中药血清水平升高,ALP活性越高。这充分说明骨康含药血清对能明显提高UMR 106的成骨分化,且剂量水平越高,ALP活性越高。
OPN是一种分泌型的糖基化磷酸化蛋白,分子结构较特殊,富含精氨酸、谷氨酸和天冬氨酸,包含大量高度保守功能序列,作为成骨细胞成熟和分化过程的标志性因子在细胞黏附和基质矿化中发挥着重要作用[8]。RUNX2 作为成骨细胞特异性转录因子和成骨细胞分化的关键因子,不仅能调节成骨细胞的分化,还可调节成骨细胞的成熟,在胚胎发育过程中,RUNX2 的表达是成骨细胞分化的开始,RUNX2 的缺失将导致骨发育不良或终止[9-10]。亦有研究[11]表明,BMP-2能够促进成骨细胞的增殖和分化,具有高效的诱导成骨活性。本实验结果中,经补肾健脾活血方(骨康方)含药血清培养后UMR106细胞OPN、RUNX2、BMP-2均显著上调,且呈浓度梯度性变化,各中药含药血清组以高剂量组表达最为明显,这表明补肾健脾活血方(骨康方)能够通过上调OPN、RUNX2、BMP-2从而促进UMR106细胞成骨分化。
综上所述,补肾健脾活血方(骨康方)含药血清对成骨样细胞UMR106成骨分化具有促进作用,并能上调OPN、RUNX2、BMP2等相关骨形成蛋白的表达。但OPN、RUNX2、BMP2因子表达上调后能否进一步激活成骨细胞特异性的下游靶基因、实现的具体途径如何,还有待进一步的研究。细胞的调节作用表明其具有被开发为抗骨质疏松药物的潜力,下一阶段将重点研究补肾健脾活血方(骨康方)含药血清调节成骨样细胞UMR106的分子机制,为补肾健脾活血方在防治OP方面,提供新的科学依据和实验方法。

