99mTc-亚甲基二膦酸盐骨显像评价乳腺癌骨转移的特征
邓群力,莫 逸,刘康龙
湖南省肿瘤医院核医学科,湖南 长沙 410013
乳腺癌全球每年约167万新发病例,我国每年新发病例约27.9万[1-2]。乳腺肿瘤细胞核内雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体2(HER-2)均为阴性的乳腺癌定义为三阴性乳腺癌(TNBC)。鉴于乳腺癌的恶性生物学行为特征,最终多会出现远处转移,骨是乳腺癌常见的转移部位[3-5]。乳腺癌骨转移常引发骨的相关事件,严重影响患者生活质量和身心健康,甚至导致死亡[6]。早期诊断乳腺癌骨转移对于患者的治疗有重要意义。探讨乳腺癌骨转移全身骨显像特征的研究很多[7-8],但是关于不同分子亚型乳腺癌骨转移全身骨显像特征国内暂时未见文献报道。本研究通过比较ER/PR/HER-2阴性(三阴)乳腺癌和非ER/PR/HER-2阴性乳腺癌骨转移99mTc-亚甲基二膦酸盐(MDP)全身骨显像和SPECT/CT融合显像差异,总结其显像特点,探讨99mTc-MDP全身骨显像对TNBC骨转移与非TNBC骨转移的诊断价值。
1 资料与方法
1.1 一般资料
收集我院2016年1月~2017年5月经病理组织学及免疫组化确诊的乳腺癌资料。初诊时即发现骨转移的患者46例,其中非三阴性乳腺癌骨转移33例,三阴性乳腺癌骨转移13例,全部为女性,年龄22~85岁,中位年龄51岁。乳腺癌病理类型:浸润性导管癌占81.1%,浸润性小叶癌11.2%,其他病理类型7.7%。所有患者均在治疗前行99mTc-MDP全身骨显像,疑骨转移或不明原因骨痛部位行SPECT/CT融合显像。
1.2 纳入标准与排除标准
纳入标准:(1)所有病例均为组织学确诊的乳腺癌,有完整免疫组化资料;(2)初诊时即发现骨转移瘤;(3)完整的临床资料;(4)治疗前均行99mTc-MDP全身骨显像和或SPECT/CT融合显像。
排除标准:(1)临床病例、免疫组化资料不完整;(2)合并其他组织原发肿瘤。
1.3 仪器与方法
99mTc-MDP由北京原子高科股份有限公司提供,放化纯>95%。扫描仪器为美国GE Infinia Hawkeye 4 SPECT/CT仪,采用低能高分辨平行孔准直器。患者静脉注射99mTc-MDP740MBq(20 mCi),注射后饮水500~1000 mL,3~6 h排空膀胱尿后行全身显像,取前位和后位,总计数1000~2000 K。对可疑骨转移部位行99mTc-MDP SPECT/CT显像。先行SPECT断层扫描。2个探头围绕患者各旋转180°, 共采集360°。保持体位不变再行同机4排定位CT扫描,扫描层厚5 mm,层间距4 mm,管电压140 kV,管电流2.5 mA。图像采集完毕后采用infinia图像融合工作站进行SPECT/CT图像融合。
1.4 图像分析
由2位有5年以上工作经验的核医学医师共同阅片。符合下列任一条件者,可诊断为骨转移:有3个或3个以上散在病灶且排除外伤及其它骨骼病变;单个及2个病灶者,CT见溶骨性或成骨性或混合性骨质破坏改变,即使未见显像剂摄取增高,亦诊断为骨转移。
在进行区域图像分析时,为方便分析骨转移的分布特点,将全身骨分为胸部骨(包括肩胛骨、肩关节、胸骨、锁骨及胸锁关节)、肋骨、脊柱骨(包括颈椎、胸椎、腰椎)、骨盆骨(包括髂骨、坐骨、耻骨、骶尾骨及骶髂区)、四肢骨和颅面骨[9]。
1.5 骨转移瘤的临床诊断标准
根据目前普遍采用的诊断标准,即依靠组织细胞病理学检查、多种影像学方法(CT、MR、PET/CT)相互借鉴,以及临床随访证实。
1.6 统计学分析
数据采用SPSS22.0统计软件处理,百分率的比较采用构成比卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌骨转移病灶的分布与摄取显像剂的情况
46例乳腺癌患者经组织细胞病理学检查、多种影像学方法相互借鉴,以及临床随访证实有骨转移。全身骨显像和SPECT/CT融合显像查出病变216处,其中经临床确诊骨转移204处,良性病灶12处。平均每个患者4.43处骨转移灶。乳腺癌骨转移灶好发部位依次为脊柱(30.39%,62/204)、肋骨(27.94%,57/204)、胸部骨(15.20%,31/204)、骨盆骨(13.73%,28/204)、颅面骨(7.35%,15/204)、四肢骨(5.39%,11/204)(表1)。TNBC与非TNBC骨转移在脊柱、肋骨、胸部骨、骨盆骨、颅面骨及四肢骨的病灶分布比例差异无统计学意义(χ2=0.591,P=0.988)。单发病灶病例占17.39%(8/46),2个以上病灶考虑为多发病灶,占82.61%(38/46)。
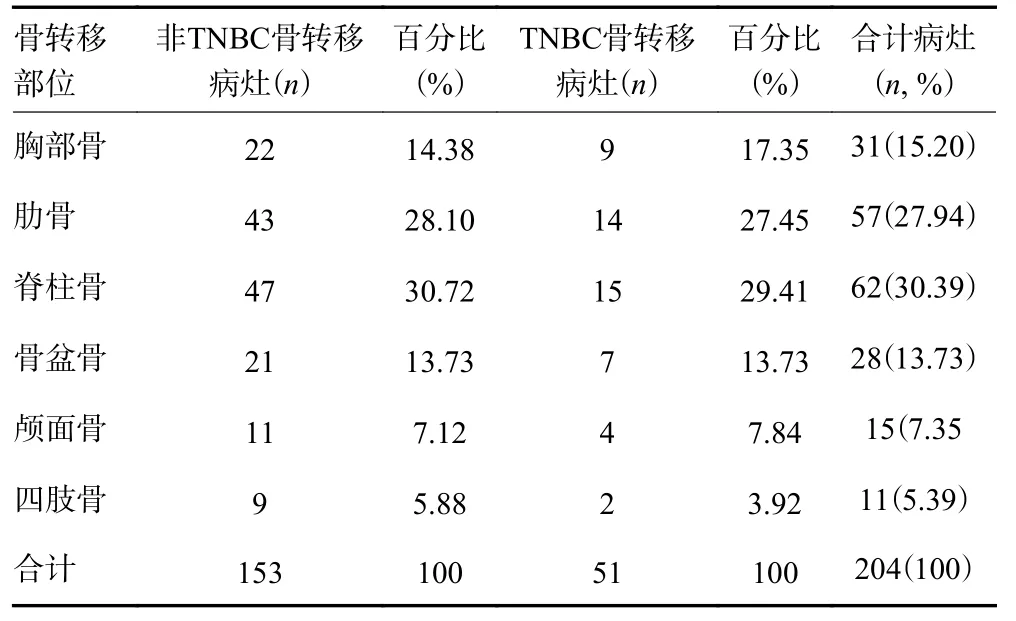
表1 乳腺癌骨转移病灶分布及转移率分布
204处病灶中85.29%(174/204)表现为放射性浓聚,11.76%(24/204)表现为放射性浓聚伴稀疏、缺损,6个病灶纯放射性稀疏(2.94%),分布在胸骨(3个)、肋骨(2个)和胸椎(1个)。
2.2 TNBC骨转移病灶情况
TNBC骨转移13例,占整个乳腺癌骨转移的28.26%(13/46)。TNBC骨转移中单发2例,占15.38%(2/11),均在胸骨。13例TNBC骨转移共51处病灶,放射性浓聚占90.20%(46/51), 混合型病灶占7.84%(4/51),放射性稀疏病变1.96%(1/51),且主要为多发骨转移病变, 占84.62%(11/13)(图1~2)。
2.3 非TNBC骨转移病灶情况
非TNBC骨转移33例,占整个乳腺癌骨转移的71.74%(33/46),其中单发6例,占非TNBC骨转移中的18.18%(6/33),其中肋骨3例,胸骨1例,胸椎1例。33例非TNBC骨转移共153处病灶,放射性浓聚占83.66%(128/153), 混合型病灶占13.72%(20/153),放射性稀疏病变3.27%(5/153)(图3)。
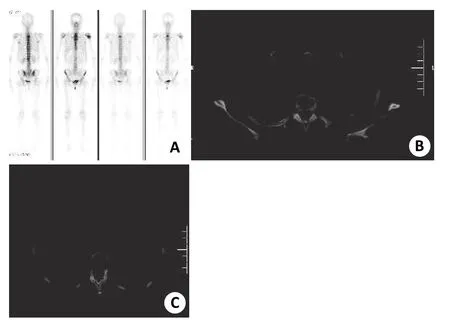
图1 TNBC骨转移病例一
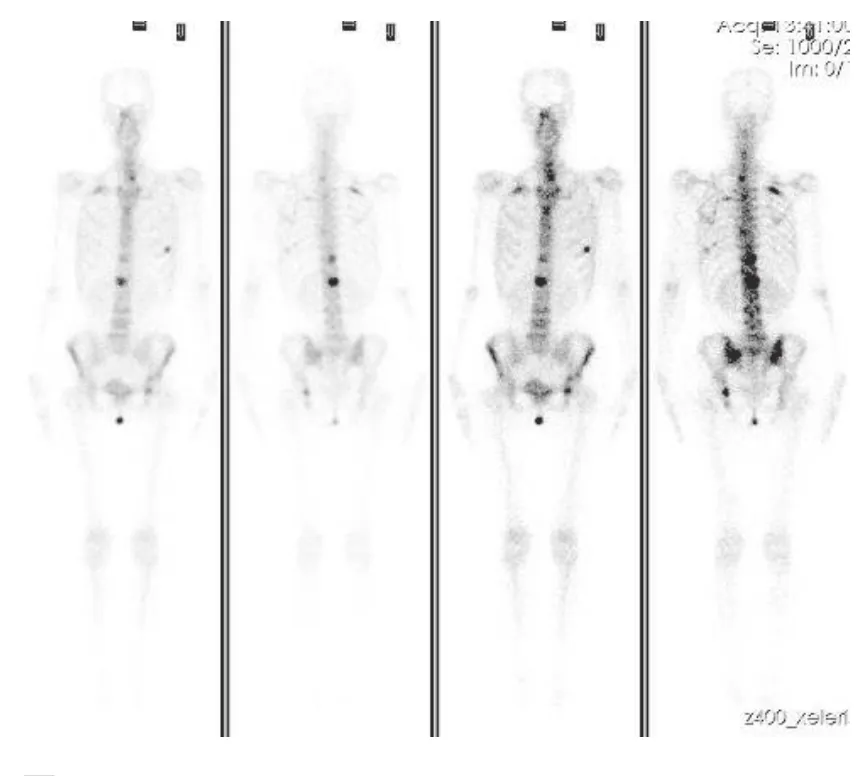
图2 TNBC骨转移病例二
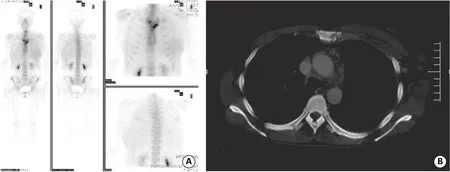
图3 非TNBC骨转移
3 讨论
有研究对13 207名乳腺癌患者随访平均5.4年后发现乳腺癌骨转移发生率为6%[10]。崔世恩等[11]报道390例原发乳腺癌,发现骨是最常见的首次转移部位,占到远处转移的54.2%。现在研究多认为骨转移常见于三阴乳腺癌之外的其他亚型[12-13]。三阴乳腺癌由Bryan等[14]首次提出,其占乳腺癌的10%~20%[11, 15-16]。它具有独特的生物学行为,侵袭性极强、预后很差、易发生内脏转移, 如肺转移, 而不易发生骨转移[11]。吴涛等[17]研究表明骨为TNBC第2常见转移部位,206例患者中有89例出现骨转移(占40.5%),骨转移常同时合并实质性脏器转移,单纯骨转移少见。罗安琪等[18]报道300例乳腺癌骨转移中三阴乳腺癌骨转移占11.3%。本研究发现TNBC骨转移占28.26%,骨转移率与其他文献报道不同,考虑与研究人群不一致有关,本研究所选范围为初诊即发现骨转移的乳腺癌,罗安琪等的研究为治疗前和治疗后所有发生骨转移的乳腺癌。
本研究84.62%的TNBC骨转移为多发病变,90.20%的病灶为放射性浓聚病变,SPECT/CT显示成骨性病变为主。TNBC骨转移以成骨转移多见考虑可能的原因是:Runx2是成骨细胞的转录因子,是乳腺癌骨转移的主要激活因子,其在乳腺癌中的表达与雌激素受体呈负相关[19],在激素受体均为阴性的乳腺癌患者中常高表达。
本研究结果显示,乳腺癌骨转移好发于脊柱骨、肋骨,与文献报道[20]一致。Piggott等[21]对238例乳腺癌术后的患者平均随访57.6月后发现乳腺癌亚型没有影响骨转移的发展。本研究显示TNBC与非TNBC在好发部位上的差异无统计学意义。本组共有8例为单发病灶,胸骨和肋骨各3例,考虑乳腺癌骨转移有好发部位与一定的顺序。乳腺癌患者胸骨容易发生早期骨转移,考虑与乳腺癌细胞可经胸骨旁淋巴结直接向胸骨侵犯有关。
文献报道乳腺癌骨转移以溶骨性骨转移为主[22]。溶骨性骨转移在SPECT上显示为放射性稀疏病灶,但本研究乳腺癌骨转移灶以放射性浓聚为主,考虑可能的原因有:病灶发生溶骨性骨质破坏的同时常伴有新骨的形成,骨质破坏与修复同时并存;99mTc-MDP能与骨质破坏组织中未成熟的胶原纤维相结合而显示放射性浓聚;溶骨性病灶放射性分布稀疏易被骨质修复放射性浓聚灶掩盖。99mTc-MDP骨显像虽然并不能灵敏反映乳腺癌骨转移的溶骨现象,但因以上原因反而更利于发现病灶。
99mTc-MDP全身骨显像是临床最常用的乳腺癌骨转移初筛方法[23],灵敏度较高,一次成像可显示全身骨骼,能早期发现骨代谢异常灶。但99mTc-MDP全身骨显像特异性较低,不能提示病灶为溶骨性或成骨性病变,不能显示骨破坏的程度,对以溶骨性转移为主的稀疏病灶或放射性异常征象不明显的浓聚灶诊断困难。配有CT的SPECT/CT显像实现了核医学功能显像与CT解剖成像的同机融合,在全身显像的基础上有的放矢地对放射性异常分布病灶进行融合显像,以便发现更多的病灶和有效提高诊断骨骼病变的准确性。SPECT/CT融合显影有效弥补了全身显像特异性较低的缺点,使乳腺癌骨转移的临床诊断率大幅提高。董科等[24]用SPECT/CT诊断经临床确诊的55个乳腺癌骨转移病灶敏感度达96.4%,特异性为76.9%,准确性92.6%。SPECT/CT中CT扫描有助于诊断全身骨显像中代谢活跃的良性股病变,包括骨赘、退行性变和血管瘤或囊肿[25]。本研究发现良性病灶12处,主要分布灶胸腰椎体,为骨质增生、骨赘、骨桥、退行性变。
综上所述,99mTc-MDP全身骨显像及SPECT/CT融合显像对不同分子亚型乳腺癌骨转移的早期诊断有重要价值。TNBC骨转移好发与脊柱、肋骨、胸骨,以多发性、放射性浓聚病变为主。本文不足之处在于病例数过少,非TNBC没有细分为Luminal A型、Luminal B型和Her-2过表达型。