枯草芽胞杆菌YB-05对小麦抗病性相关 防御酶系的诱导作用
孙润红, 徐俊蕾, 杨丽荣, 张 洁, 夏明聪, 武 超, 薛保国*, 吴 坤
(1. 河南省农业科学院植物保护研究所, 河南省农作物病虫害防治重点实验室, 农业部华北南部农作物有害生物综合治理重点实验室, 河南省作物保护国际联合实验室, 郑州 450002; 2. 河南农业大学生命学院, 郑州 450002)
小麦为禾本科植物,是世界上分布最广泛的粮食作物,我国主要产于华北及东北地区。病害问题一直是影响小麦产量和质量的重要因素,小麦病害的防治是小麦生产的重中之重,也是提高小麦产量的重要途径。化学药剂长期使用或使用不当易导致病原菌抗药性、环境污染及农药残留等问题。近年来,生物防治由于其安全、低毒等特点已成为国内外研究的热点。拮抗细菌在植物病害防治中起到了非常重要的作用,无论是在自然发生的生物拮抗现象还是在生物防治中,细菌的生防效果都非常明显[1]。在众多的生防细菌中,枯草芽胞杆菌Bacillussubtilis凭借其易培养、环境适应能力强、对人畜无毒等优点而受到青睐[2-3]。植物对病害及其他逆境的抗性与多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等多种酶的活性变化有关[4-6]。大量研究表明,生防菌可以诱导这些植物抗病相关防御酶产生变化,增强抗病能力[7]。易龙等研究发现,芽胞杆菌Bn-130菌液可诱导辣椒体内POD、PPO和PAL活性增高[8]。周林等采用灌根法接种枯草芽胞杆菌TR21发酵液、菌体及发酵上清液后,香蕉根系内POD、PPO和PAL活性均高于空白对照[9]。林陈强等发现,枯草芽胞杆菌CS16发酵液及上清液处理香蕉苗均能诱导香蕉叶片中SOD、PPO、PAL和POD等防御酶活性变化[10]。目前,国内生防菌对小麦抗病防御反应酶影响的研究尚未见报道,为此本研究选择PAL、POD、SOD、PPO、CAT作为抗病性反应指标,研究了生防菌YB-05对小麦植株抗病相关酶的影响,以明确YB-05对抗病防御酶的诱导机制,为小麦生产中合理利用YB-05防治小麦真菌病害和深入研究YB-05的生防机制奠定理论基础。
1 材料与方法
1.1 试验材料
生防菌枯草芽胞杆菌BacillussubtilisYB-05为本实验室分离得到,现保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC02NO.6498。
小麦全蚀病菌Gaeumannomycesgraminisvar.triticiGGT007为本实验室从小麦根部分离得到,并在本实验室保存。
小麦品种:供试小麦品种为‘郑麦366’。
试验所用培养基为PDA和PDB培养基。
1.2 试验方法
1.2.1 菌株的制备及接种
将YB-05菌株在PDA平板中划线活化,27℃下恒温培养24 h,得到活化的YB-05菌株单菌落,然后挑取单菌落接种于PDB培养基中,27℃,125 r/min条件下振荡培养48 h即得YB-05种子液,调节菌液浓度至106cfu/mL的菌悬液,备用。
1.2.2 小麦的催芽与诱导处理
挑选大小一致的小麦种子,首先用75%乙醇处理5 s,灭菌水冲洗3次,0.1%升汞消毒9 min,再用无菌水冲洗5次,然后将经消毒处理的小麦种子平铺于直径12 cm无菌平皿中,加入5 mL无菌水, 放置于室温。1 d后将露白的小麦种子转移至另一个铺有无菌滤纸的平皿中(直径12 cm),每皿放置约50粒种子,加入10 mL无菌水,放置于室温。2 d后,将根长2~3 cm的发芽小麦转移至灭菌组培瓶,处理组分别为每瓶接种5株小麦和5 mL 106cfu/mL YB-05菌悬液、5株小麦和5 mL GGT007菌悬液(0.5 g GGT007菌丝溶于5 mL PDB培养基中)、5株小麦和5 mL YB-05和 GGT007混合悬液(0.5 g GGT007菌丝溶于5 mL YB-05菌悬液中),对照组为5株小麦和5 mL PDB培养基。
分别于处理后24、48、72、96、120 h取小麦幼叶和小麦根提取粗酶液,检测不同时间小麦体内相关防御酶的活性变化。
1.2.3 诱导抗性测定
分别取0.1 g 叶片和根部用于提取粗酶,PAL、POD、SOD、PPO、CAT等酶活均按照酶活性试剂盒(苏州科铭生物技术有限公司)步骤,利用可见光分光光度计检测与诱导植物抗病性密切相关的防御酶活性(PAL、PPO、SOD、POD、CAT)变化。
2 结果与分析
2.1 YB-05发酵液对小麦叶片和根部苯丙氨酸解氨酶(PAL)活性的影响
由图1可知,经YB-05发酵液诱导后,各浓度处理组的小麦叶片和根部PAL活性均高于对照处理组。空白对照组小麦叶片和根部的PAL活性最低,在试验期间无明显变化。Y+G处理组小麦叶片中PAL活性明显高于其他3组处理,并在处理后的96 h达到峰值,为46.705 U/g,为对照组的1.74倍,与对照组差异显著。Y处理组小麦叶片的PAL活性在72 h时达到峰值,为35.195 U/g,为对照组的1.65倍,与对照组差异显著。G处理组小麦叶片的PAL活性在试验期间也有显著变化,在48 h酶活性达到峰值,为39.325 U/g,为对照组的1.41倍,与对照组差异显著。Y+G处理组小麦根部中PAL活性明显高于其他3组处理,并在处理后72 h达到峰值131.536 U/g,为对照组的1.65倍,与对照组差异显著。Y和G处理组小麦根部的PAL活性均在96 h时达到峰值,为112.324 U/g和102.576 U/g,分别为对照组的1.33、1.21倍,与对照组差异显著。因此,YB-05发酵液和全蚀病菌均能诱导小麦叶片和根部中PAL的活性增强,且YB-05发酵液和全蚀病菌共同处理的活性高于单独处理,可见YB-05发酵液和全蚀病菌共同诱导对PAL具有协同增效作用。

图1 生防芽胞杆菌YB-05及全蚀病菌GGT007对小麦PAL活性的影响Fig.1 Effects of Bacillus subtilis YB-05 and wheat take-all GGT007 on PAL activity in wheat
2.2 YB-05发酵液对小麦叶片和根部过氧化氢酶(CAT)活性的影响
生防菌及病原菌共同处理后小麦叶片和根部CAT活性如图2所示。Y+G处理组小麦叶片CAT活性在试验期间均高于其他3组处理,且在72 h达到峰值,为1 259.565 U/g,为对照组的2.42倍。G处理组中小麦叶片的CAT活性在96 h达到峰值,为784.102 U/g,为对照组的1.33倍。Y处理组小麦叶片CAT活性变化规律与Y+G处理组一样,在72 h达到峰值,为974.094和1 259.565 U/g,为对照组的1.87和2.42倍。3组处理CAT活性均高于空白对照,且Y+G同时处理的小麦叶片CAT活性比单独Y或G处理的小麦叶片CAT活性高。没有进行任何处理的对照组小麦叶片CAT活性在120 h内变化不大。Y+G处理组、Y处理组以及G处理组小麦根部CAT活性在96 h分别达到206.241、184.518、173.46 U/g峰值,与对照组相比CAT活性显著增高,峰值分别是对照组的1.74、1.56、1.46倍,与对照组差异显著。对照组小麦根部CAT活性变化范围不大。比较4个处理组CAT活性变化,结果显示,Y+G处理组小麦叶片和根部的酶活性均显著高于其他3个处理组,诱导效果最佳。
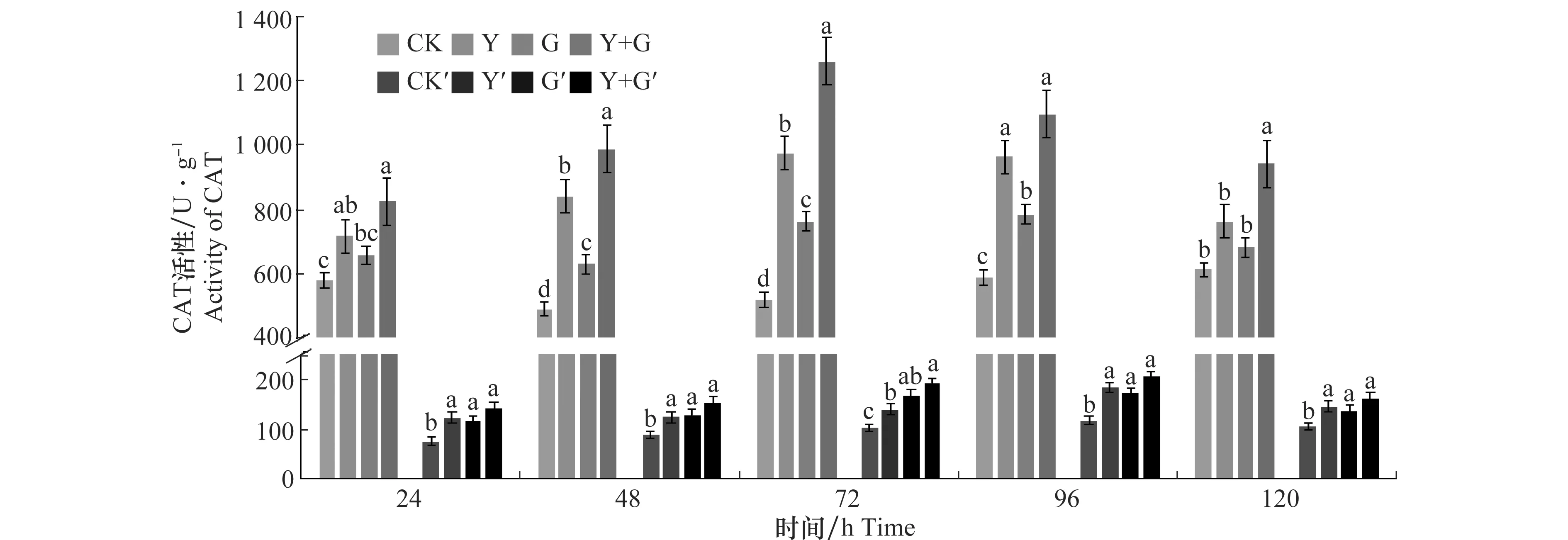
图2 生防芽胞杆菌YB-05及全蚀病菌GGT007对小麦CAT活性的影响Fig.2 Effects of Bacillus subtilis YB-05 and wheat take-all GGT007 on CAT activity in wheat
2.3 YB-05发酵液对小麦叶片和根部过氧化物酶(POD)活性的影响
枯草芽胞杆菌YB-05和小麦全蚀病菌诱导小麦叶片POD活性变化见图3,由图可知,Y+G处理组、Y处理组以及G处理组小麦叶片POD活性在第48 h分别达到16 829.274、13 785.902 5、11 653.265 U/g峰值,与对照组相比POD活性显著增高,峰值是对照组的2倍左右。Y+G处理组、G处理组的小麦根部POD活性在72 h时分别达到峰值56 424.79、52 715.86 U/g,Y处理组在24 h达到峰值48 555.945 U/g是对照组的1.52、1.42、1.7倍,差异显著。试验期间对照组小麦叶片和根部POD差异不大。同时接种生防菌YB-05和病原菌GGT007的小麦叶片和根部的POD活性比单独接种生防菌YB-05或病原菌GGT007的POD活性高。说明同时添加YB-05发酵液和小麦全蚀病菌GGT007对小麦叶片和根部POD活性显著高于其他3个处理组,诱导效果最佳。
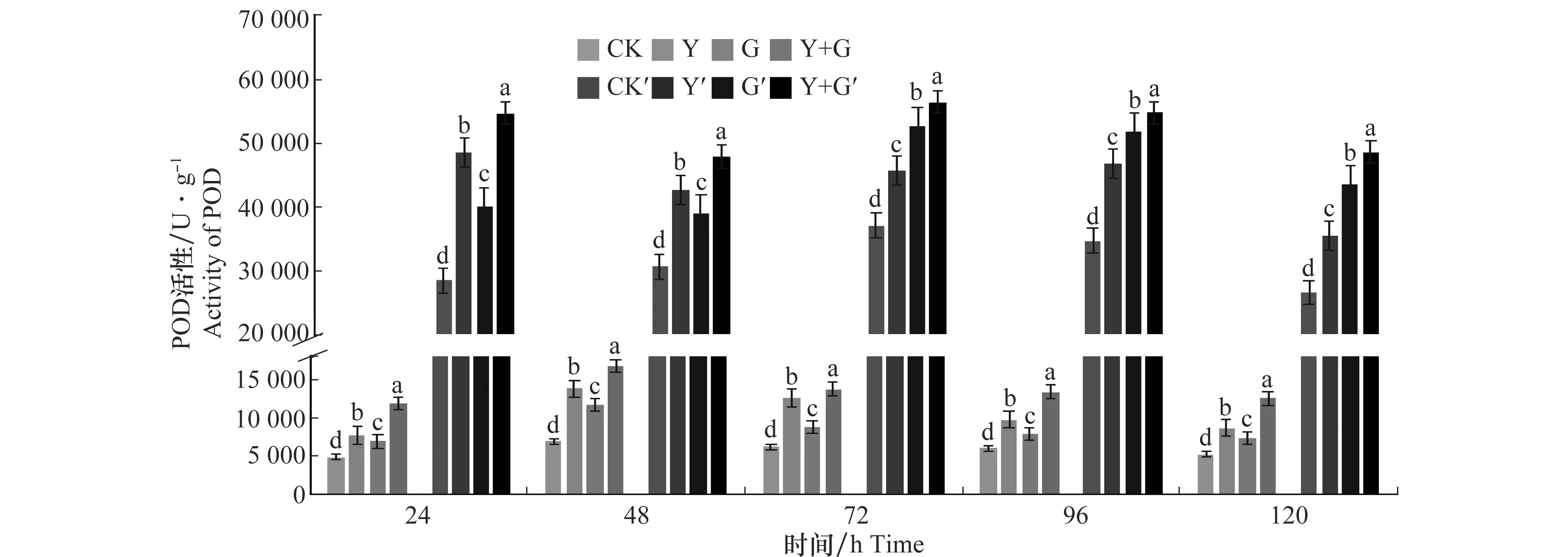
图3 生防芽胞杆菌YB-05及全蚀病菌GGT007对小麦POD活性的影响Fig.3 Effects of Bacillus subtilis YB-05 and wheat take-all GGT007 on POD activity in wheat
2.4 YB-05发酵液对小麦叶片内超氧化物歧化酶(SOD)活性的影响
SOD活性检测结果(图4)所示,Y+G处理组小麦叶片SOD活性呈下降趋势,且在诱导后24 h达到峰值104.687 U/g,为对照组的2.27倍。Y处理组、G处理组小麦叶片SOD活性均在96 h达到峰值,分别为对照组的1.63倍和1.91倍,达到73.52、86.32 U/g,与对照组差异显著; Y+G处理组小麦根部SOD活性在试验期间均高于其他3组处理,且在72 h达到高峰,峰值为1 977.04 U/g。Y处理组小麦根部SOD活性变化规律与Y+G处理组一致,在72 h达到峰值,为1 493.43 U/g。G处理组中小麦根部的SOD活性在96 h达到峰值,为1 246.89 U/g。3个处理组Y、G和 Y+G处理小麦根部SOD活性均高于对照,且Y+G同时处理SOD活性比单独Y或G处理的SOD活性高。没有进行任何处理的对照组无论根或叶的SOD活性在120 h内变化不大。
2.5 YB-05发酵液对小麦叶片内多酚氧化酶(PPO)活性的影响
枯草芽胞杆菌YB-05和小麦全蚀病菌对小麦叶片和根部PPO活性的影响结果见图5。Y+G处理组的小麦叶片PPO活性在96 h时达到峰值97.44 U/g,是对照组的2.4倍,差异极显著。Y处理组、G处理组小麦叶片的PPO活性均为先增高后降低的趋势,均在72 h达到峰值84.2、72.58 U/g,分别为对照的1.96倍、1.69倍,与对照组差异显著。Y+G处理组小麦根部PPO活性明显高于其他3组处理,并在处理后的72 h达到峰值22.564 U/g,为对照组的2.07倍,差异显著。Y处理组和G处理组的PPO活性与Y+G处理组变化趋势一致,均在72 h时达到峰值17.786 U/g和14.265 U/g,分别为对照组的1.63、1.31倍,与对照组差异显著。结果显示YB-05发酵液和全蚀病菌GGT007均能诱导小麦叶片和根部PPO活性增强,且两者共同处理的活性高于单独处理,可见枯草芽胞杆菌YB-05发酵液和全蚀病菌共同诱导对PPO具有协同增效作用。
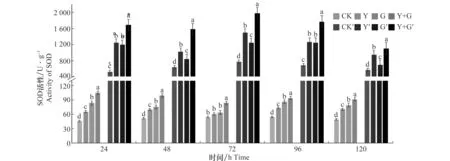
图4 生防芽胞杆菌YB-05及全蚀病菌GGT007对小麦SOD活性的影响Fig.4 Effects of Bacillus subtilis YB-05 and wheat take-all GGT007 on SOD activity in wheat

图5 生防芽胞杆菌YB-05及全蚀病菌GGT007对小麦PPO活性的影响Fig.5 Effects of Bacillus subtilis YB-05 and wheat take-all GGT007 on PPO activity in wheat
3 结论与讨论
当植物受病原菌侵染或诱导处理后,与抗病反应相关的保护性酶活性升高是诱导抗性产生的重要机制之一,其中CAT、SOD、POD、PAL和PPO是植物体内与抵制病原微生物侵染有关的重要酶,其活性的变化通常作为衡量植物体内防卫反应的重要指标[11]。
在本试验中,施用生防菌YB-05和接种小麦全蚀病菌后,利用可见光分光光度计检测与诱导植物抗病性密切相关的防御酶活性(PAL、PPO、SOD、POD、CAT)变化。结果显示,小麦经生防菌与病原菌混合处理、病原菌处理、生防菌处理后,叶片和根部与植物防御抗病相关的PPO、POD、SOD、PAL、CAT防御酶活性均比对照组高,说明无论接种生防菌或小麦全蚀病菌,都能刺激小麦体内防御酶活性的增加,从而达到抵御病害侵染的效应,增强其抗病性。其中生防菌与病原菌混合处理后抗性相关酶活最高,叶片中PAL、POD、SOD、PPO、CAT酶活峰值分别在96、48、24、96和72 h达到46.705、16 829.274、104.687、97.44和1 259.565 U/g,为对照组的1.74、2.44、2.27、2.40和2.42倍。根部PAL、POD、SOD、PPO、CAT酶活峰值分别在72、72、72、72和96 h分别达到131.536、56 424.79、1 977.04、22.564和206.241 U/g,为对照组的1.65、1.52、2.57、2.07、1.74倍。表明枯草芽胞杆菌YB-05和小麦全蚀病菌均能诱导小麦叶片和根部的防御酶活性增强,两者共同处理后小麦叶片和根部5种防御酶活性均高于单独处理,说明枯草芽胞杆菌YB-05和小麦全蚀病菌GGT007共同诱导具有协同增效作用。
目前防治小麦全蚀病菌主要以化学防治为主,但长期大量使用化学药剂使得抗药性不断增强,农药残留易造成食品安全问题,同时会加剧环境污染。生物农药以其对人畜及生态环境无害的特点越来越受到人们的关注,而天然生防微生物以其独特的作用机理一跃成为生物农药发展热点。枯草芽胞杆菌YB-05是河南省农业科学院植物保护研究所通过对其16S rDNA基因序列的分析发现的一种对小麦全蚀病菌具有显著抑制作用的菌株,本试验发现诱导抗性可能是枯草芽胞杆菌YB-05防治小麦真菌病害的重要机制之一。但对其发酵液在田间的防病效果还有待评价。因此,后续的研究有必要通过大田试验以明确其抗病潜能,验证其抗性诱导机理,为实现该菌株的开发应用提供技术支持。

