OSAHS患者缺氧诱导因子1α与血清肺表面活性蛋白水平的变化及意义*
赵 丹,赵远琴,邵松军,刘维佳,张 程,张湘燕△
(1.贵州省人民医院呼吸与危重症医学科/贵州大学医学院,贵阳 550000;2.贵州医科大学在读研究生,贵阳 550000)
阻塞性睡眠呼吸暂停综合征 (OSAHS) 是常见的睡眠相关呼吸障碍疾病,男性患病率22%,女性17%[1]。其特点是睡眠过程中反复发生的间歇性低氧[2],由于氧化应激反应激活炎症通路,可导致心、脑血管等多系统损害[3-4]。缺氧条件下缺氧诱导因子-1α(HIF-1α)激活可导致肝纤维化、心脏炎症细胞凋亡和纤维化[5-6]。此外,OSAHS患者亦存在亚临床肺损伤[7]。在本课题组既往的研究中发现,OSAHS患者肺泡表面蛋白高于正常对照人群,但具体机制仍不甚清楚。本研究拟阐明OSAHS患者HIF-1α信号传导通路上调,启动炎性反应,导致下游的炎症因子释放,引起肺泡上皮细胞损伤,以期揭示OSAHS患者亚临床肺损伤的机制,现报道如下。
1 资料与方法
1.1一般资料 选择2016年8月至2017年2月贵州省人民医院门诊及住院就诊的睡眠监测患者83例,其中男38例、女25例,年龄22~76岁,平均(47.52±14.43)岁;依据OSAHS诊治指南(2011年修订版)[8]的诊断标准,分为对照组20例、轻度OSAHS组20例、中度OSAHS组23例、重度OSAHS组20例。均排除慢性阻塞性肺疾病、哮喘、肺间质纤维化、恶性肿瘤、结缔组织病、结核病、严重心力衰竭、代谢性疾病及肝、肾功能不全。该研究获贵州省人民医院医学伦理委员会批准,所有受试者均签署知情同意书。
1.2方法
1.2.1日间爱波沃斯嗜睡评分(ESS)评分 正式进行多导睡眠监测(PSG)前,在安静环境中,运用ESS评估患者白天嗜睡程度。
1.2.2PSG 采用美国飞利浦Alice 5 PSG系统,监测内容包括:脑电图、眼电图、下颌肌电图、心电图、口鼻气流、胸腹部呼吸运动、血氧饱和度(SPO2)、体位、鼾声、胫前肌电图等。监测时间自21:00至次日06:00共9 h。
1.2.3RNA提取及逆转录 PSG后的次日06:00,空腹抽取外周静脉血4 mL,注入肝素抗凝管,Ficoll密度梯度法分离单个核细胞,Trizol一步法提取RNA。测定RNA浓度,按dNTP Mix.2.5 nmol/L Each 4 μL,Primer Mix 2 μL,RNA Template 2 μL,5×RT Buffer 4 μL,DTT 2 μL,HiFScript,200 U/μL 1 μL,RNase-Free Water up to 20 μL,总反应体系20 μL逆转录为cDNA。
1.2.4荧光定量PCR检测 检索GenBank,上海生工设计合成引物:NF-κB上游5′-GCG AGA GGA GCA CAG ATA CC-3′,下游5′-CTG ATA GCC TGC TCC AGG TC-3′。HIF-1α上游5′-GAA AGC GCA AGT CCT CAA AG-3′,下游5′-TGG GTA GGA GAT GGA GAT GC-3′。内参GAPDH上游5′-CAG GAG GCA TTG CTG ATG AT-3′,下游5′-GAA GGC TGG GGC TCA TTT-3′。PCR反应体系:cDNA模板2 μL,25 μL 2×UltraSYBR Mixture(High Rox)上游、下游引物各1 μL,ddH2O 21 μL,总反应体系50 μL。在PCR基因扩增仪上进行热循环。用1.5%琼脂糖凝胶电泳,以DL-2000为标准分子量对照鉴定PCR产物。
1.2.5Western blot法检测 PSG后的次日06:00时,空腹抽取外周静脉血4 mL,注入肝素抗凝管,Ficoll密度梯度法分离单个核细胞,裂解液30 μL裂解样品,超声波裂解3~5次,4 ℃,12 000 r/min离心20 min,取上清液加入Buffer:DTT,煮沸10 min。5 μL上样,聚丙烯酰胺凝胶(SDS-PAGE)电泳后转膜,将蛋白转移至聚偏二氟乙烯(PVDF)膜上,经牛奶封闭后,用一抗(PBS 1∶1 000稀释),在4℃孵育过夜,TBST洗膜后用HRP标记的羊抗鼠/兔IgG二抗(PBS 1∶5 000稀释)室温下孵育1 h。Milliore公司的显影液显影并拍照分析。
1.2.6酶联免疫吸附试验(ELISA)检测 行PSG后的次日06:00时,空腹抽取外周静脉血4 mL,注入非抗凝管中,室温静置30 min后,4 ℃、3 000 r/min离心10 min,留取血清。按ELISA试剂盒说明书,从室温平衡20 min后的铝箔袋中取出所需板条,设置标准品和标本孔,标准品孔各加不同浓度的标准品50μL,标本孔中加入待测标本50 μL,空白对照孔不加。除空白孔外,标准品孔和标本孔中每孔加入辣根过氧化物酶(HRP)标记的检测抗体[肿瘤坏死因子-α(TNF-α),白细胞介素-6(IL-6),Ⅱ型肺泡细胞表面抗原(KL-6),肺泡表面活性蛋白-A(SP-A),肺泡表面活性蛋白-D(SP-D)]100 μL,用封板膜封住反应孔,37 ℃恒温箱温育60 min。弃去液体,吸水纸上拍干,每孔加350 μL洗涤液,静置1 min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次。每孔加入底物A、B各50 μL,37 ℃避光孵育15 min,每孔加入50 μL终止液,在酶标仪上测定450 nm处的吸光度值A450。

2 结 果
2.1基线比较 各组性别、年龄、颈围、胸围、腰围、BMI、ESS指标比较,随着OSAHS严重程度的增加,轻、中、重度OSAHS组颈围逐渐增大,高于对照组;重度OSAHS组胸围、腰围、BMI高于对照组(P<0.05)。年龄、性别、ESS评分差异无统计学意义(P>0.05),见表1。
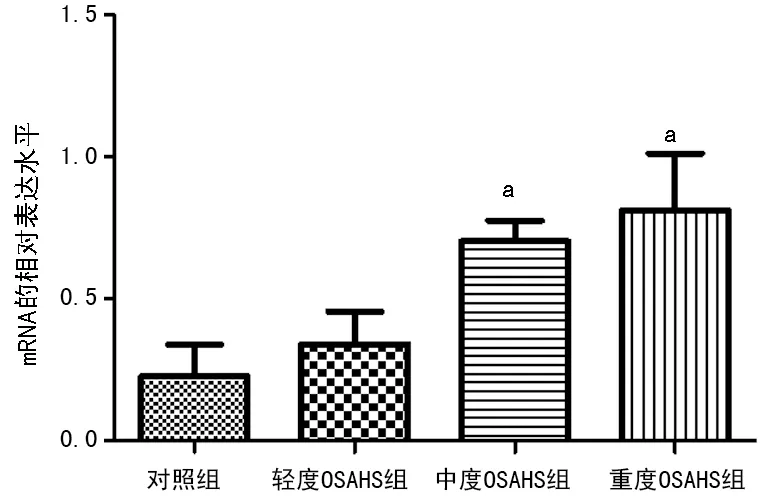
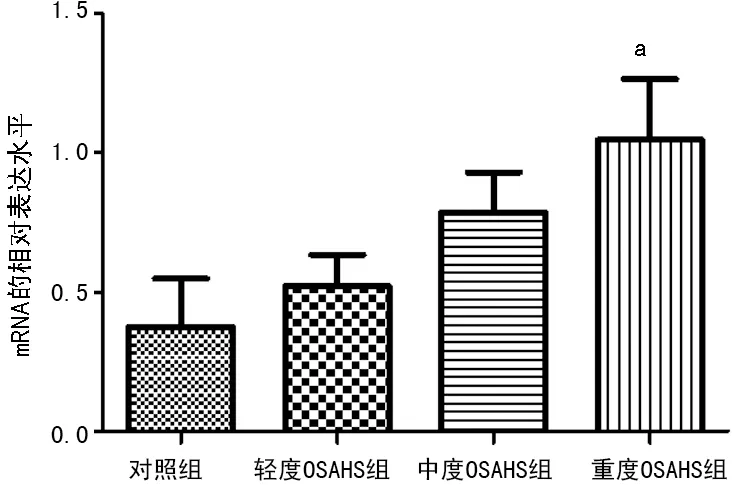
2.2各组NF-κB、HIF-1αmRNA表达水平 采用荧光定量PCR检测,中、重度OSAHS组NF-κB表达水平明显高于对照组,重度OSAHS组HIF-1α mRNA表达水平明显高于对照组(P<0.05),见图1、2。
a:P<0.05,与对照组比较;b:P<0.05,与轻度OSAHS组比较;c:P<0.05,与中度OSAHS组比较

表2 各组TNF-α、IL-6、SP-A、SP-D水平比较
a:P<0.05,与对照组比较;b:P<0.05,与轻度OSAHS组比较;c:P<0.05,与中度OSAHS组比较
a:P<0.05,与对照组比较
图1各组血清中NF-κB mRNA表达水平
a:P<0.05,与对照组比较
图2各组血清中HIF-1α mRNA表达水平
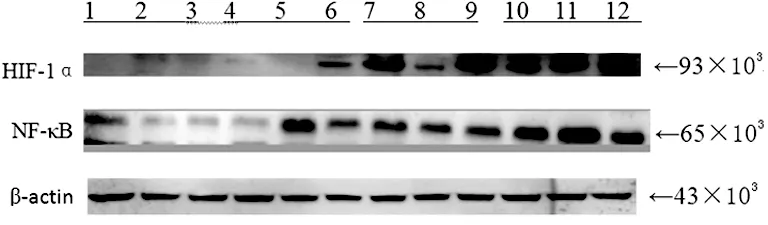
1~3泳道:对照组;4~6泳道:轻度OSAHS组;7~9泳道:中度OSAHS组;10~12泳道:重度OSAHS组
图3 Western blot检测NF-κB、HIF-1α蛋白表达水平
2.3NF-κB、HIF-1α蛋白表达水平 采用Western blot法检测,与对照组比较,重度OSAHS组NF-κB、HIF-1α蛋白表达水平明显升高(P<0.05),见图3。
2.4TNF-α、IL-6、SP-A、SP-D水平比较 采用ELISA检测,与对照组比较,中、重度OSAHS组TNF-α升高,重度OSAHS组IL-6升高(P<0.05)。与对照组比较,轻、中、重度OSAHS组SP-A升高,中、重度OSAHS组SP-D升高(P<0.05)。与轻度OSAHS组比较,中、重度OSAHS组SP-A、SP-D升高(P<0.05)。与中度OSAHS组比较,重度OSAHS组SP-D升高(P<0.05),见表2。
2.5相关性分析 血清SP-A水平与HIF-1α mRNA相对表达水平呈正相关(r=0.197,P<0.05)。其余TNF-α、IL-6、SP-D水平与HIF-1α mRNA及NF-κB mRNA相对表达水平的相关性分析差异无统计学意义(P>0.05),见图4。
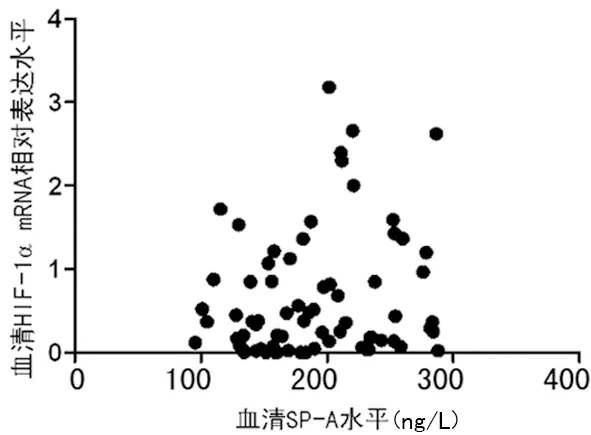
图4 血清SP-A水平与HIF-1α mRNA表达水平相关性
3 讨 论
OSAHS被认为是一个复杂的、多因素和基因疾病,主要的病理生理机制是睡眠时反复发生的上呼吸道塌陷阻塞,导致慢性间断性低氧。重复性缺氧和再氧化引起线粒体和内质网功能障碍,过度活化的NADPH氧化酶、黄嘌呤氧化酶和解偶联一氧化氮合酶,诱导前氧化物与抗氧化剂之间的不平衡,引起氧化应激和炎性反应增强,导致局部和全身炎症[9-10]。本研究发现,重度OSAHS患者血清HIF-1α mRNA、NF-κB mRNA水平及蛋白质水平均高于对照组,血清TNF-α、IL-6水平也随之增加。考虑与OSAHS患者体内间断低氧,激活HIF-1α及NF-κB等相关的炎症通路,导致下游炎症介质和细胞因子表达增加有关[11-13]。
血清肺表面活性蛋白SP-A、SP-D的水平可作为多种疾病潜在生物标志物,包括间质性肺纤维化(IPF)、慢性阻塞性肺疾病、肺气肿和睡眠呼吸暂停,能有效反映肺损伤程度[14-18]。本研究发现,重度OSAHS患者血清中SP-A、SP-D水平均升高。其机制可能与OSAHS患者夜间间断缺氧及再氧合损伤肺泡屏障、致肺泡部位内皮细胞、Ⅱ型肺泡上皮细胞损伤,局部血管内皮通透性升高,从而使肺组织SP-A、SP-D渗出到血液中,引起血清中SP-A、SP-D水平增加。同时血清SP-A、SP-D水平与OSAHS严重程度相关。此外,本研究发现血清SP-A水平与HIF-1α mRNA相对表达水平呈正相关。考虑血清中SP-A的表达水平升高,可能与HIF-1α通路激活后,大量炎症因子释放,导致肺泡内皮细胞、Ⅱ型肺泡上皮细胞等损伤有关。
综上所述,OSAHS患者在间歇性低氧下,可能通过激活HIF-1α信号通路,释放NF-κB、TNF-α、IL-6等炎症因子,导致OSAHS患者血清肺表面活性蛋白水平升高,可能参与亚临床肺损伤的发生。

