羊草LcMADS12基因的克隆及原核表达分析
贾俊婷,赵品苍,刘祝江,袁光孝,杨伟光,3,刘书,陈双燕,李晓霞*,刘公社*
(1.中国科学院植物研究所北方资源植物重点实验室,北京100093;2.中国科学院大学,北京 100049;3.黑龙江省畜牧研究所,黑龙江 齐齐哈尔 161005)
生殖过程是高等植物生活史中一个重要阶段。开花植物生殖的承载者花器官的发育一直是植物学家研究的重点之一。20世纪90年代,通过对双子叶模式植物拟南芥(Arabidopsisthaliana)、金鱼草(Antirrhinummajus)和矮牵牛(Petunia)遗传突变体的研究,建立了花器官发育的ABCDE模型[1-5],ABCDE模型中大部分基因属于MADS-box基因。研究发现在高等植物中,MADS-box基因家族在序列及功能上比较保守,在花器官形成,种子和果实发育,以及开花时间的控制等方面都起着重要的作用[6-8]。而E类(SEP-like)基因作为其中一类花同源异型基因,其功能不仅体现在花器官决定,参与四轮花器官的形成,而且还参与花分生组织的决定性[9]。在禾本科植物水稻(Oryzasativa)基因组中发现5个SEP-like基因:OsMADS1、OsMADS5、OsMADS7、OsMADS8和OsMADS34[10]。
其中OsMADS7和OsMADS8在水稻浆片,雄蕊和雌蕊中表达,在内外桴中不表达;在内三轮花器官的发育和花的决定性上起了重要作用[11]。OsMADS34基因突变后植株材料表现出花序变小,分枝结构紊乱,种子败育等表型[12]。近年来关于MADS-box基因的研究在禾本科其他植物中陆续报道。如小麦(Triticumaestivum)中已经克隆到42个MADS-box基因,并对其进行了系统的表达模式分析,发现小麦E类基因TaSEP在内稃、浆片、雄蕊和雌蕊中都有表达[13-15]。其中一个SEP-like基因TaMADS1过表达的拟南芥植株出现提前开花和花器官发育异常等现象[16]。二穗短柄草(Brachypodiumdistachyon)基因组中发现6个SEP-like基因:BdMADS1,BdMADS7,BdMADS11,BdMADS26,BdMADS28 和BdMADS32,其中BdMADS7在二穗短柄草外稃、内稃、雄蕊及雌蕊中表达,同时对GL6和FUL1的可变拼接和表达模式也进行了分析[17-19]。张妙青等[20]对垂穗披碱草(Elymusnutans)中的WM8基因也进行了克隆及分析。
羊草(Leymuschinensis),隶属禾本科小麦族赖草属,是多年生根茎型植物,是欧亚大陆草原区东部草甸草原及干旱草原的重要建种群[21-23]。其营养价值高,抗逆性强,适口性好,在发展人工草地、改良退化草原方面占重要地位。在自然生境下,羊草有性生殖能力较弱,抽穗率较低,严重制约了其实际生产和应用[24]。近年来,对羊草的有性生殖研究主要集中在解剖学、细胞学、遗传多样性等特点及气候营养和草场利用对有性生殖的影响等方面[25-26]。目前,关于羊草的有性生殖基因研究较少,MADS-box基因研究尚未见报道[27]。羊草花的发育和种子的发育密切相关,解析羊草花发育相关基因的生物学功能,对于揭示花发育的分子机制具有理论意义和潜在的应用价值。本研究从羊草中克隆了一个MADS-box基因LcMADS12,对其转录激活活性和原核表达进行分析,为进一步研究该基因的功能奠定基础。此外,羊草作为禾本科作物小麦的野生近缘种,研究羊草中MADS-box基因,能为理解小麦、大麦(Hordeumvulgare)等作物及牧草的开花生物学理论提供重要的参考价值。
1 材料与方法
1.1 实验材料
羊草实验材料种植于中国科学院植物研究所(北京)试验地,在自然条件下生长。于2015年5月将成熟花序液氮速冻后,-80 ℃保存,供克隆羊草MADS-box基因使用。同时收集根、茎、叶、外稃、内稃、颖片、雄蕊及雌蕊,用于组织特异性表达分析。
Trizol (Invitrogen, Carlsbad, CA, USA), DNaseI (Takara, Japan),RNA提取试剂盒(百泰克),PrimeScriptTMRT reagent Kit试剂(TaKaRa),SYBR®PremixExTaqTM(TaKaRa),大肠杆菌Escherichiacoli菌株Trans5α和BL21感受态细胞购置于Trangen公司;基因克隆载体pMD-19 T simple购于Takara公司,原核表达载体PET30a为本实验室保存。
1.2 实验方法
1.2.1总RNA的提取与cDNA的合成 采用RNA提取试剂盒(百泰克)分别提取成熟花序羊草根、茎、叶、外稃、内稃、颖片、雄蕊及雌蕊中的总RNA,并利用DNaseI(Takara, Japan)消化基因组DNA。1%的琼脂糖凝胶电泳检测检验RNA完整性,并使用Biodropsis BD-2000进行RNA浓度和纯度测定。利用TaKaRa公司PrimeScriptTMRT reagent Kit (Perfect Real Time 编号:RR037Q)进行cDNA合成,反应体系为10 μL: 5×PrimeScript®Buffer (2 μL),PrimeScript®RT Enzyme Mix I (0.5 μL),OligodT Primer (50 μmol·L-1)(0.5 μL),Random 6 mers (100 μmol·L-1) (0.5 μL),Total RNA (500 ng),RNase Free dd H2O (up to 10 μL)。反转录反应条件为:37 ℃,15 min,85 ℃,5 s,合成后的cDNA存贮于-20 ℃备用。
1.2.2羊草LcMADS12基因的克隆 通过检索本实验室羊草成熟柱头转录组数据库[27],获得一个全长CDS的contig28995序列。通过将该序列在NCBI上比对发现该序列为E类MADS-box家族基因,命名为LcMADS12,根据其保守序列,用Primer 5.0设计引物(表1),扩增LcMADS12基因的开放阅读框(ORF)片段,并测序。具体反应以羊草花序的cDNA为模板进行PCR扩增: 94 ℃预变性5 min; 94 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸1 min, 30个循环后; 72 ℃再延伸5 min。取5 μL扩增产物用1%琼脂糖凝胶电泳鉴定。

表1 实验中所用到的引物序列Table 1 Primers used in this study
1.2.3生物信息学分析 使用TMHMM 2.0 (http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜结构预测;使用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测;保守结构域预测使用NCBI数据库Blast工具(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi);利用ProtParam(http://web.expasy.org/compute_pi)在线软件进行蛋白质一级结构分析;采用DNAMAN 6.0软件进行氨基酸多序列比对及系统进化树构建。
1.2.4基因表达分析 根据LcMADS12基因序列设计荧光定量引物,根据羊草Actin基因序列设计内参引物(表1),通过定量PCR(qRT-PCR)分析羊草LcMADS12在花期不同组织(根、茎、叶、外稃、内稃、颖片、雄蕊及雌蕊)中的表达。定量PCR体系和条件按照TaKaRa公司SYBR®Premix Ex TaqTMII(Tli RNaseH Plus)试剂盒说明书进行操作。反应程序为:95 ℃,30 s; 45个循环(95 ℃,5 s;68 ℃,30 s)。技术重复3次。定量PCR完成后,采用2-ΔΔCt方法,对所得数据进行相对定量分析[28]。
1.2.5转录激活功能分析 按照基因序列,在上游和下游引物分别加入EcoRI和SalI酶切位点(表 1),将LcMADS12连入pBridge载体的BD下游,热激转化入大肠杆菌菌株DH5α中,阳性单克隆经双酶切及测序正确后,热激转化法转入酵母感受态AH109 (Saccharomyces cerevisiae)中。以空pBridge载体为阴性对照,转入pBridge-LcWRKY5为阳性对照,并在缺少色氨酸和组氨酸的双缺陷培养基上筛选,同时进行Whatman滤纸显色来检测报告基因的表达情况。
1.2.6LcMADS12原核表达载体的构建及原核表达 根据LcMADS12基因测序结果,设计基因编码区两端的特异引物,引入酶切位点EcoRI和SalI。将LcMADS12连入原核表达载体PET30a,酶切鉴定及测序鉴定连接成功后,将含PET30a-LcMADS12的重组质粒利用热激法转化大肠杆菌BL21(DE3)pLyS菌株。过夜,约12~16 h。将过夜培养的阳性新鲜菌液按LB液体培养基(Kan两份),37 ℃振荡培养2~3 h,至OD600=0.4~0.6,取1 mL菌液作为未诱导的阴性对照组。其余菌液分别进行温度(16、25、37 ℃),诱导剂IPTG(异丙基硫代半乳糖苷,Isopropyl β-D-Thiogalactoside)浓度(0.1、0.5、1.0 mmol·L-1)和诱导时间(0~6 h)处理,每隔1 h取一次样,每次取1 mL菌液为“诱导后”的实验组。12000 r·min-1室温离心5 min,弃上清。加入1×SDS-PAGE上样缓冲液,煮沸10 min裂解细胞。12000 r·min-1离心2 min,取10 μL上清进行SDS-PAGE电泳分析,再用考马斯亮蓝R-250染色,脱色液脱色后拍照、分析。SDS-PAGE电泳胶的配比为12%的分离胶,5%的浓缩胶。
2 结果与分析

图1 羊草LcMADS12基因克隆电泳图Fig.1 The PCR amplification analysis of LcMADS12
2.1 羊草LcMADS12基因的克隆与生物信息学分析
以羊草小穗总RNA反转录所得的cDNA产物为模板,转录组测序数据为依据,设计引物进行羊草LcMADS12基因核心片段的PCR扩增,获得了与预期大小相符的条带(图1),经测序确认,片段长度774 bp,ORF长度为741 bp,编码246个氨基酸,分子量为28.5 kDa,等电点为8.74。在N端含有典型的MADS-box结构域。对LcMADS12基因编码蛋白序列进行NCBI比对分析,结果表明其编码的蛋白与其他植物的MADS-box基因蛋白序列有很高的相似度,与小麦TaAGL16蛋白同源性为99%,与多年生黑麦草的LpMADS5蛋白序列同源性为97%,与二穗短柄草的BdMADS7-like蛋白同源性为94%,与水稻OsMADS7蛋白同源性为86%。进一步进行多重序列比对分析表明,羊草LcMADS12蛋白与其他植物来源的MADS-box蛋白具有较高的相似性(图2)。以多年生黑麦草,水稻(粳稻),玉米(Zeamays),小麦,大麦,拟南芥(A.thaliana),羊草等物种的MADS-box基因的氨基酸序列进行系统进化树分析,结果表明,在进化上LcMADS12与单子叶植物小麦TaAGL16亲缘关系最近,与双子叶植物拟南芥亲缘关系相对较远(图3)。利用TMHMM 2.0 Server对该蛋白跨膜区域进行分析,结果表明该蛋白无跨膜区域;使用SignalP 4.1软件对其进行信号肽预测表明该蛋白无信号肽(图4)。
2.2 羊草LcMADS12基因在不同组织的定量表达分析
采用Real-time PCR技术,对盛花期羊草根、茎、叶及花器官结构的外稃、内稃、颖片、雄蕊及雌蕊中LcMADS12基因的相对表达情况进行分析,结果如图5所示,LcMADS12在花器官中的相对表达量最高,而在根、茎、叶中检测不到表达,说明LcMADS12是羊草花器官特异基因。在生殖器官部位,除颖片外,在外稃、内稃、雄蕊及雌蕊中均能检测到LcMADS12的表达,且在雄蕊和雌蕊中的表达量较高,分别为外稃中表达量的37.7和33.4倍多,差异极显著(P<0.01);在内稃中的表达量中等,为外稃中表达量的9倍;在外稃的表达量较低(图5)。

图2 LcMADS12蛋白和其他物种相似蛋白的氨基酸序列间的同源性比对Fig.2 Multiple alignment analysis of LcMADS12 conserved domain with its homologous in other plants

图3 LcMADS12蛋白和其他物种相似蛋白的系统进化树Fig.3 The phylogenetic tree of LcMADS12 proteins and other MADS-box proteins Lp: 多年生黑麦草L. perenne; Os: 水稻(粳稻) O. sativa (japonica group); Zm: 玉米Z. mays; Ta: 小麦T. aestivum; Hv: 大麦H. vulgare; At: 拟南芥Arabidopsis thaliana; Bd: 二穗短柄草B. distachyon.

图4 LcMADS12生物信息学分析Fig.4 Bioinformatics analysis of LcMADS12 A: LcMADS12保守结构域预测; B: LcMADS12基因信号肽预测; C: LcMADS12跨膜结构域预测。A: Conservative protein domain prediction of LcMADS12; B: Signal peptide prediction of LcMADS12 gene; C: Transmembrane region prediction of LcMADS12.
2.3 羊草LcMADS12蛋白的转录激活特性分析
将重组载体pBridge-LcMADS12转入到酵母菌株AH109中,同时将酵母表达载体pBridge转入酵母AH109作为空载体阴性对照,将LcWRKY5基因转入酵母AH109作为阳性对照。将3种含有融合载体的酵母菌在不含组氨酸和色氨酸的双缺陷培养基(SD/-His-Trp)上进行培养筛选后,用β-半乳糖苷酶活性滤纸进行显蓝分析。结果如图6所示,转pBridge空载体的对照酵母菌株在SD/-His-Trp培养基上不能生长,而转pBridge-LcMADS12基因的酵母菌株和转入pBridge-LcWRKY5作为阳性对照的酵母菌株能够在SD/-His-Trp培养基上生长(图6A)。β-半乳糖苷酶活性检测显示正对照(pBridge-LcWRKY5)与实验组(pBridge-LcMADS12)的酵母菌对应的滤纸呈现明显的蓝色,而负对照组(pBridge-BD)则不显示蓝色(图6B)。上述结果说明,羊草LcMADS12蛋白具有转录激活活性。
2.4 LcMADS12原核表达分析

图5 羊草LcMADS12基因的组织表达分析Fig.5 The relative expression pattern analysis of LcMADS12 in different tissues of L. chinensis 不同大写字母表示差异极显著(P<0.01)。Values with different capital letters mean extremely significant difference (P<0.01).
重组表达质粒PET30a-LcMADS12在大肠杆菌中,经过IPTG(isopropyl β-D-thiogalactoside)诱导实现了高效蛋白表达,提取总蛋白进行SDS-PAGE分析。为建立最佳的原核表达条件,重组表达质粒PET30a-LcMADS12在大肠杆菌中,采用不同的温度、IPTG浓度和诱导时间来确定目标蛋白高效表达体系。提取总蛋白进行SDS-PAGE分析,电泳结果表明,在16 ℃,0.5 mmol·L-1IPTG诱导3 h后,目标蛋白表达量明显增加。图7中黑色箭头标出PET30a-LcMADS12融合表达的特异条带,该条带大小约为36 KDa,与LcMADS12蛋白分子量28.5 KDa加上载体上His标签的理论值相符。此外,在37 ℃和25 ℃条件下诱导,上清中该处没有出现条带,这说明PET30a-LcMADS12融合蛋白在此诱导条件下是以包涵体形式存在或者没有表达。
3 讨论
花器官的发育作为被子植物生殖生长的重要过程,一直以来都是研究的热点。小穗是禾本科花序特有的结构单元,以水稻小花为例,一枚小花由六个雄蕊、心皮、外稃、内稃和两个浆片构成,小花的外部包裹着一对护颖和一对退化的颖片,共同组成水稻花序的基本单元——小穗。而羊草的花构造更接近于小麦,每一朵花都是由内稃、外稃、两个浆片、3个雄蕊和一枚雌蕊构成,一小穗由4~9朵小花构成,小穗基部有两个颖片。研究发现E(SEP-like)类基因不仅决定各轮次花器官的发育,在成花决定性上也起着重要作用,且在双子叶植物拟南芥和单子叶植物水稻中,SEP-like基因这两方面的功能是保守的[29-30]。本研究中的羊草LcMADS12具有典型的MADS-box蛋白超家族的MADS-MEF2-like 结构域和K-box结构域,且氨基酸序列比对分析表明,该基因属于SEP-like亚家族。前期研究表明,SEP亚家族发生过多次基因重复事件,产生了一系列 SEP-like进化系[31]。本研究对LcMADS12基因蛋白序列系统进化树分析表明,LcMADS12与小麦的TaAGL16/TaAGL30,大麦的HvMADS9相似性较高,而与拟南芥的AtSEP相似性较低,前三者(羊草、小麦、大麦)均属于小麦族植物,亲缘关系较近,与APGⅢ分类系统一致。
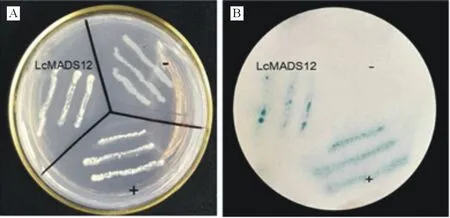
图6 酵母单杂交系统验证LcMADS12的转录激活功能Fig.6 Transcriptional activation activity of LcMADS12+:正对照 Positive control; -:负对照 Negative control.

图7 PET30a-LcMADS12重组蛋白的SDS-PAGE电泳图Fig.7 SDS-PAGE electrophoresis analysis of the recombinant PET30a-LcMADS12 M:标准蛋白质分子量;1:未诱导的阴性对照; 2-7:16 ℃,0.5 mmol·L-1 IPTG分别诱导1、2、3、4、5、6 h条件下含重组质粒PET30a-LcMADS12的大肠杆菌BL21总蛋白。M: Protein molecular weight marker; 1: Negative control before induced by IPTG; 2-7: Total proteins of E. coli BL21 containing the recombinant plasmid PET30a-LcMADS12 induced by 0.5 mmol·L-1 IPTG for 1, 2, 3, 4, 5 and 6 h, respectively.
研究发现,禾谷类植物,如大麦、高粱(Sorghumbicolour)、水稻的SEP-like类基因在花序中大量表达,在根、茎和叶中表达水平很低或不表达[32]。小麦TaSEP1/TaSEP2基因在内、外稃片中表达量较高,在雄蕊和雌蕊中表达量次之,在浆片和颖片中表达较弱[14],说明这两个基因可能具有控制花器官发育的功能。小麦TaAGL16/TaAGL30在营养器官中不表达,在小穗中高表达,同LcMADS12基因表达相似;同时TaAGL16/TaAGL30在小麦发育种子中有表达[13]。玉米相关研究发现,ZMM8和ZMM14两基因在顶花的分生组织中都有表达,当ZMM14 的旁系同源基因IFA1突变后,突变体表现为小穗中出现额外的小穗和小花,且雌蕊器官数目增多[33-34]。本研究中羊草LcMADS12蛋白序列与水稻OsMADS7、OsMADS8蛋白序列的同源性分别为86%和80%,而水稻OsMADS7和OsMADS8主要在浆片、雄蕊、雌蕊中表达,在内外稃中不表达[11]。羊草LcMADS12在根、茎、叶中不表达,在雄蕊、雌蕊、内稃中表达量较高,与OsMADS7、OsMADS8有相似之处[11-10, 32],推测LcMADS12基因在进化上与TaAGL16/TaAGL30及OsMADS7基因具有一定的保守性。
此外,本研究将羊草LcMADS12基因与原核表达载体pET-30a重组,转入大肠杆菌BL21 (DE3)中进行融合蛋白诱导表达,发现LcMADS12能够与His标签蛋白形成融合蛋白,且通过本研究确定了融合蛋白的高效表达体系。重组蛋白的获得对后续纯化目的蛋白及在体外验证LcMADS12与其他MADS-box蛋白的相互作用奠定了基础。

