微波干燥对生物解离富肽豆粉蛋白亚基及功能性的影响
王 欢 佟晓红 钟明明 齐宝坤 李 杨,2 江连洲
(1.东北农业大学食品学院,哈尔滨 150030; 2.哈尔滨市食品产业研究院,哈尔滨 150028)
0 引言
生物解离是一种新型的绿色提油工艺,在机械破碎的基础上,通过对植物油料进行酶解处理可实现油脂与蛋白的同步提取,具有广阔的应用前景[1]。生物解离同步制取大豆油脂及蛋白技术以其安全、健康、环保等优点,已充分体现其工业可行性。破乳技术使油和蛋白的提取率分别高达98%和96.5%,然而其水资源及副产物综合利用率低的问题亟待解决[2]。生物酶法同步制取油脂及蛋白工艺产生的副产物水解液中主要成分为水解蛋白。研究表明,每生产1 L油脂可产生4.4 kg豆渣和约28 L水解液[3]。生物解离大豆废料与传统大豆加工副产物废料相比,经过酶解后会有更多的高价值成分释放,典型的水解液含60%蛋白质(水解蛋白)、22%碳水化合物以及原料中几乎50%的磷脂。现有的用于发酵酒精、生产水溶性多糖等再利用方案不能很好地利用异黄酮等生理活性物质,造成一定程度的浪费[4]。因此,如何对水解液进行高值化利用是提高此项技术经济效益、环境效益和社会效益的重要因素。
微波干燥技术现已广泛应用于多种食品的生产。REDDY等[5]研究微波干燥条件(固形物含量、进口温度)对山羊奶粉性质的影响,研究发现,L*值、水分活度、堆积密度随着进口温度的升高而降低,固形物含量的升高引起堆积密度的增大,溶解性、可湿性和分散性均受到微波干燥条件的影响,平均值分别为98.49%、533.4 s和81.48%。TELANG[6]研究微波干燥条件对发酵豆粉性质的影响,研究发现,较高进口温度、较低进料速度时,粉末颗粒的残留水分较低;产品得率在较低进料速度条件下较高;升高进口温度引起产品异黄酮种类的减少及含量的降低;较低进料速度使物料更多暴露于干燥塔,蛋白质更易变性,且形成较多小颗粒粉末,从而引起豆粉溶解性下降。SHEN[7]利用微波干燥生产乳蛋白-纤维复合物的研究发现,随着进口温度升高,所得产品颗粒水分活度降低,微波干燥所得粉末颗粒就微生物腐败来说相对稳定。目前,关于微波干燥技术的利用多集中于工艺参数的优化,而微波干燥条件对产品性质的影响机理尚不明确,因此有必要针对生产过程产品特性的变化进行深入研究。
本文以模拟大豆油提炼工艺条件下的生物解离大豆水解液为研究对象,运用高效液相体积排阻色谱技术研究不同微波干燥条件对富肽豆粉中蛋白类物质亚基组分和空间构象的变化规律,并对生物解离富肽豆粉的粉体性质及功能性质进行研究,旨在探讨结构变化与理化、功能特性的内在联系,为生物解离技术工业化示范提供理论指导。
1 材料与设备
1.1 材料与试剂
大豆,哈尔滨市依兰大豆专业合作社;碱性蛋白酶Protease 2.4L,诺维信生物技术有限公司;氢氧化钠,上海市天力化学试剂有限公司;盐酸,上海市天力化学试剂有限公司;正己烷,天津渤海化工集团供销公司;乙腈,天津渤海化工集团供销公司;其他常用化学试剂均为分析纯。
1.2 仪器与设备
手提式多功能粉碎机,天津市华鑫仪器厂;剖分式双螺杆挤压机,东北农业大学工程学院自行研制;HS-25型数字酸度计,上海伟业仪器厂;DK-98-1型电热恒温水浴锅,天津常仪仪器设备有限公司;JJ-1型增力电动搅拌器,上海科升仪器有限公司;GL-21M型高速冷冻离心机,北京医用离心机厂;BL-6000Y型微波干燥机,上海比朗仪器制造有限公司;FD5-3型冷冻干燥机,美国SIM公司;AL204型分析天平,北京京国艺科技发展有限公司; Waters型高效液相色谱仪,美国Waters公司。
2 实验方法
2.1 生物解离水解液的制备
大豆生物解离水解液制备流程[8]如下:大豆清理→粉碎→挤压膨化(模孔孔径18 mm、套筒温度90℃、水分调节14%、螺杆转速100 r/min)→粉碎(过60目筛)→酶解(50℃,pH值9,3 h)→灭酶(沸水浴10 min)→离心(4 500 r/min, 20 min)→大豆生物解离水解液。
2.2 生物解离富肽豆粉的制备
采用微波干燥技术制备大豆生物解离富肽豆粉,在进行微波干燥前,对大豆生物解离水解液进行浓缩处理,随后用2 mol/L NaOH溶液调至pH值7.4,并用膜截留分子量为500 u的透析膜进行脱盐。依据前人实验,选取微波干燥条件为:进口温度140、150、160、170、180、190、200℃;固形物质量分数15%、20%、25%、30%、35%、40%、45%;进料速率3、6、9、12、15、18、21 mL/min。将旋风分离器和干燥塔中所得富肽豆粉用聚氯乙烯袋收集并密封,于干燥器中室温(20℃)保存备用[9]。
2.3 高效液相体积排阻色谱(HPLC-SEC)分析
联用AKTA快速蛋白液相(FPLC)系统与10/300 GL Superdex TM 75型凝胶色谱柱测定样品肽分子量分布。将不同微波干燥条件所得大豆生物解离高值粉溶解于磷酸缓冲液(0.05 mol/L,pH值6.8)中,得到质量浓度1 mg/mL样品,用孔径为0.45 μm的亲水性纤维素膜过滤,注入量500 μL,流动相速率0.6 mL/min,在215 nm处进行紫外检测。根据标准品(磷酸化酶97.4 ku;牛血清蛋白66.2 ku;肌动蛋白43 ku;碳酸酐酶31 ku;生长激素22.0 ku;溶菌酶14.4 ku;胰岛素5.5 ku)分子量对数值与洗脱体积的关系建立回归方程[10]。
2.4 荧光光谱分析
对不同微波干燥条件生物解离富肽豆粉进行荧光测定。将0.2 mg/mL的样品溶液置于石英比色皿中,激发波长285 nm,发散波长扫描范围300~500 nm,激发狭缝和发射狭缝均为5 nm[11]。
2.5 水溶性指数的测定
称取(1±0.01) g生物解离豆粉于烧杯,加入15 mL蒸馏水进行混匀,在室温条件下磁力搅拌1 h后以5 000 r/min离心20 min。将上清液倒入蒸发皿,于105℃下干燥至质量恒定,所得干物质占所称取豆粉的质量分数即为水溶性指数[12]。
2.6 分散性指数的测定
准确称取10.00 g生物解离富肽豆粉放入100 mL 25℃的去离子水中,记录粉体完全分散所用时间,分散性指数测定方法参照文献[13]。
2.7 统计分析
本实验数据均为3个平行样的平均值,结果采用SPSS 22.0分析软件和Origin 8.0进行处理,并对数据进行差异显著性分析(P<0.05)。
3 结果与分析
3.1 HPLC-SEC分析
已知分子量的标准蛋白质经Sephadex G-75凝胶层析分离后,各蛋白质分子量、分子量对数值和洗脱体积所得结果见表1。根据标准分子量对数值与洗脱体积关系建立线性方程(图1)。采用最小二乘法求出直线的回归方程为
y=-0.048 8x+5.304 4
式中x——洗脱体积,mL
y——分子量对数值
采用该回归方程可以根据某蛋白的洗脱体积估算出其分子量。
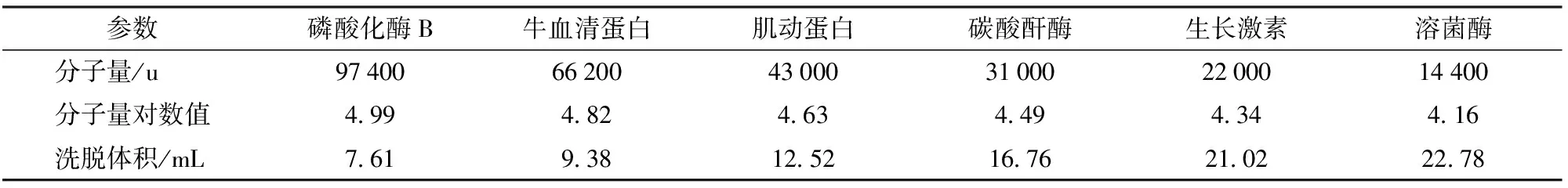
表1 蛋白质标准品的分子量与洗脱体积关系Tab.1 Relationship of protein standard sample and retention volume
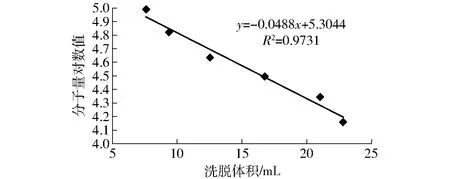
图1 分子量对数值与洗脱体积关系Fig.1 Logarithm relationship of molecular weight as a function of retention volume
采用体积排阻-凝胶色谱(HPLC-SEC)方法研究在不同微波干燥条件下生物解离富肽豆粉中蛋白(肽)类分子量大小及其分布情况。不同微波干燥进口温度条件下生物解离富肽豆粉蛋白(肽)类分子量分布见表2。
由表2可知,洗脱谱图的排阻时间位置存在1个主峰,微波干燥条件的不同对出峰时间无明显影响,但对峰的强度影响明显,即在数量上影响蛋白质水解产物。根据图1分子量对数值与洗脱体积关系的线性方程换算出各峰的分子量分布发现,先出峰的为分子量大于44 ku的蛋白质,后出现的一系列峰为分子量小于18 ku的肽,数量最多的蛋白质水解物分子量为18~44 ku,占总蛋白质类的73.47%~89.36%,其主要亚基成分为大豆球蛋白,这与VIRGINIE等[14]研究所得大豆球蛋白是大豆水解产物较高的组成成分相似。这可能是由于不同微波干燥条件下的物相转换率和分子间碰撞机会不同,蛋白纤维化聚集形成的速度不同,从而对生物解离富肽豆粉分子量产生影响。
3.2 荧光光谱分析
内源荧光光谱主要用于表征色氨酸残基附近微环境极性的变化,用于反映蛋白质三级结构的变化。色氨酸的最大荧光强度和荧光峰位受微环境变化的影响,荧光强度的变化与荧光猝灭有关;荧光峰位蓝移表示色氨酸附近微环境极性降低,红移则表示色氨酸附近微环境极性增加[15]。不同微波干燥条件生物解离富肽豆粉的荧光光谱如图2所示。
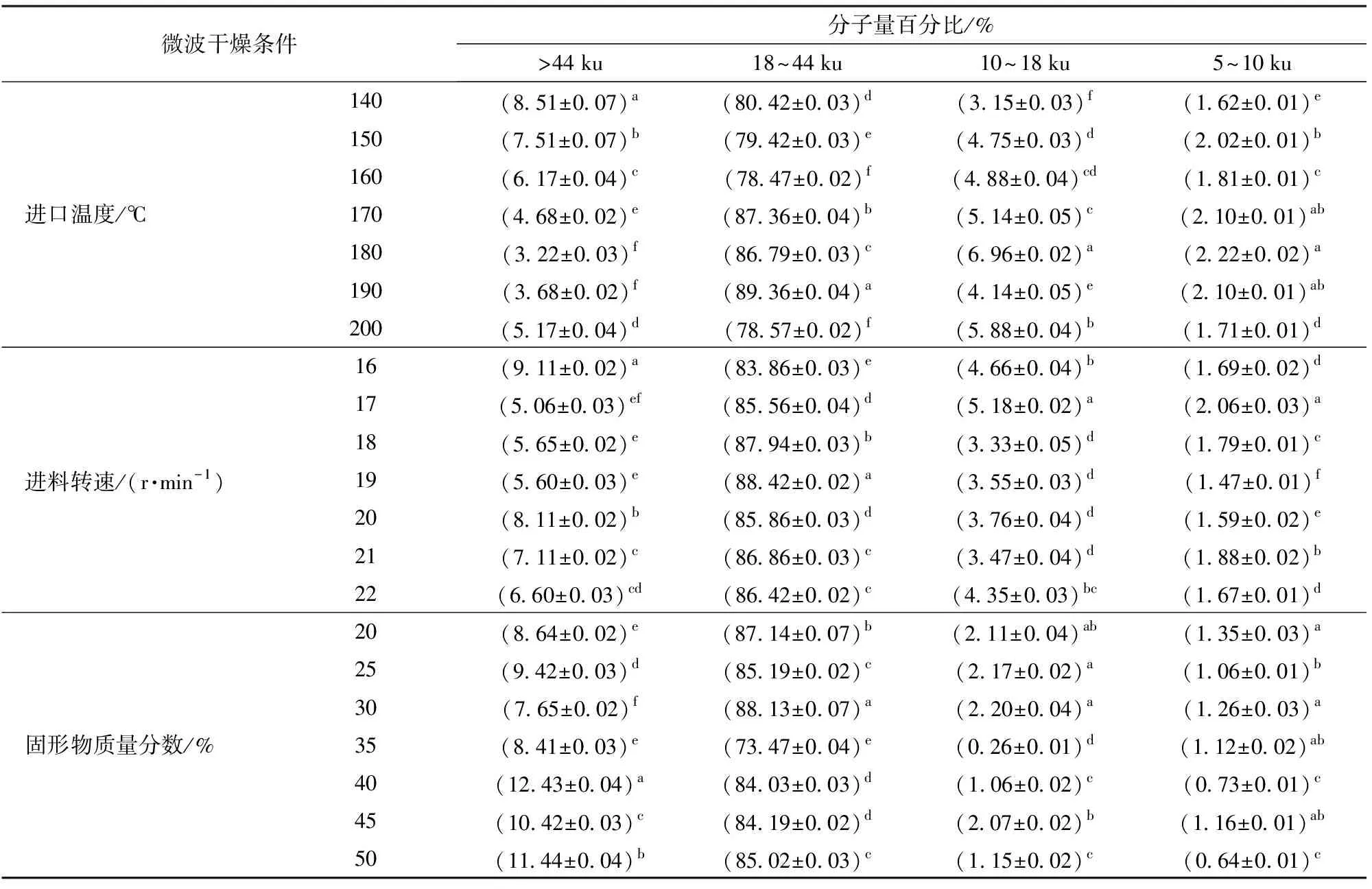
表2 不同微波干燥条件下生物解离富肽豆粉的蛋白质分子量分布Tab.2 Molecular weight distribution (MWD) of spray dried EAEP soy skim powders
注:同一参数同一列的不同字母表示差异显著(P<0.05)。
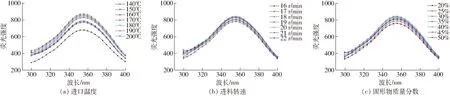
图2 不同微波干燥条件下生物解离富肽豆粉荧光光谱Fig.2 Fluorescence spectra of soy skim powder under different spray drying conditions
由图2可知,当激发波长为285 nm时,生物解离富肽豆粉在不同微波干燥进口温度、不同转速以及不同固形物含量条件下的最大吸收波长均为355 nm。这表明微波干燥条件对色氨酸周围空间结构无明显影响。由图2a可知,当微波干燥进口温度由140℃升到160℃时,生物解离富肽豆粉的荧光强度呈减小趋势,随着温度继续升高,荧光强度则呈增大趋势,在200℃时荧光最强。由图2b可知,当进料速度为19 r/min时,样品荧光最强。这表明在19 r/min时,色氨酸的屏蔽作用最弱。
图2c显示,当固形物质量分数由20%增加到35%时,生物解离富肽豆粉的最大荧光强度逐渐增大,当料液固形物质量分数继续增加至50%,最大荧光强度减小。这可能是因为一定范围内的固形物含量增加伴随着物料中蛋白含量的增加,从而引起色氨酸含量增加,因此引起荧光强度增强;随着固形物含量的继续增加,糖类与蛋白分子交联加剧,加强了其对色氨酸残基周围区域的屏蔽作用,荧光强度减弱[16]。
3.3 水溶性分析
水溶性是表征粉体复溶特性的重要指标。水溶性高分子之所以溶于水是因为在水分子与聚合物的极性侧基之间形成了氢键。不同微波干燥条件生物解离富肽豆粉的水溶性指数如图3所示。由图3可知,较高的进口温度和较大的物料固形物质量分数都能使粉体颗粒具有较好的水溶性。依据GOULA等[17]的研究成果,粉体颗粒的残留水分越低则水溶性越好,因此,当微波干燥的进口温度升高,所得粉体颗粒的残余水分少,则水溶性较好;增大物料固形物含量,可引起物料中蛋白质类含量的增加,据DE ALMEIDA等[18]报道,蛋白质的高溶解性可使所得粉体颗粒水溶性增强。MUZAFFAR[19]利用微波干燥生产酸角粉也得到相似趋势。当进料速度增加,粉体颗粒水溶性减小,因为较大的进料速率导致粉体颗粒的残余水分增多,从而一定程度上减小粉体颗粒的水溶性。
图3 不同微波干燥条件下生物解离富肽豆粉水溶性指数Fig.3 WSI of soy skim powder under different spray drying conditions
3.4 分散性分析
分散性是速溶豆粉的功能特性之一。不同微波干燥条件所得生物解离富肽豆粉的分散性指数如图4所示。由图4可知,生物解离富肽豆粉的分散性随着温度的升高而呈上升的趋势,且上升幅度较大,而随着进料速度的提高,生物解离富肽豆粉的分散性明显下降。随着固形物质量分数的增加,生物解离富肽豆粉的分散性呈增加趋势,但当固形物质量分数达到40%以后其分散性则随着固形物含量的增加而减少。较高微波干燥温度促使蛋白质分子结构伸展,也能引发不溶性蛋白质裂解为可溶性蛋白质,有助于提高生物解离富肽豆粉的分散性[20-21]。分散性先会随着固形物含量的增加而增加,这是因为大豆蛋白主要成分球蛋白的亲水性侧链基团(盐键、酯键等)绝大多数处于其分子表面,易分散于水中[22],但随着蛋白浓度的继续增加,蛋白质分子之间的相互作用和分子聚集的作用也随之加剧,蛋白质分子随机聚成簇,并进一步聚集成厚的索状结构从而形成粗糙型凝胶,则会导致分散性下降[23]。
图4 不同微波干燥条件下生物解离富肽豆粉分散性指数Fig.4 Dispersibility of soy skim powder under different spray drying conditions
4 结束语
以生物解离大豆水解液为研究对象,运用高效液相凝胶排阻色谱技术研究了不同喷雾-微波干燥条件对富肽豆粉中蛋白类物质亚基组分和空间构象变化规律,并对生物解离富肽豆粉的粉体性质及功能性质进行研究。研究结果表明,微波干燥条件对HPLC-SEC分离主峰的强度影响明显,分子量18~44 ku的蛋白质水解物约占总蛋白质类的73.47%~89.36%,主要亚基成分为大豆球蛋白。此外,生物解离富肽豆粉的水溶性和分散性在不同微波干燥条件下具有相似趋势,与粉体残余水分量、分子运动剧烈程度、分子构象变化及分子聚集与裂解有关。

