肺子宫内膜异位症4例报告并文献复习
马玉燕, 潘 珏*, 高晓东, 金文婷, 张 尧, 王萌冉, 胡必杰
1. 复旦大学附属中山医院感染病科,上海 200032 2. 复旦大学附属中山医院感染管理科,上海 200032
1 临床资料
1.1 病例1 患者,25岁,因反复咯血半年于2016年12月底就诊我院,既往孕4产2,育有1子1女,均为顺产;2012年9月及2015年曾有2次人工流产史,平素月经周期正常,无痛经。就诊前半年无诱因出现咯血,色鲜红,带有暗红色血块,量约10~20 mL/d,无发热、盗汗等,当地医院考虑肺炎予抗感染,效果不佳,此后仍反复咯血。后于当地医院反复查红细胞沉降率(ESR)、C反应蛋白(CRP)、血常规、出凝血功能均正常,胸部CT示两下肺斑片影,边缘模糊,伴局部实变,右下肺明显,予抗感染治疗咯血停止后复查胸部CT是两肺下叶磨玻璃影,病灶基本吸收,双侧胸腔少量积液。治疗后患者仍反复咯血,约每月1次,与月经呈明显周期相关性,多于月经前1 d或月经后2 d内出现咯血,月经结束后咳血停止。2016年12月再次出现咯血,量明显增多,约100 mL/d,色鲜红,伴暗红色血块,于我院门诊查T-SPOT:A/B为0/0,G试验、血隐球菌荚膜抗原阴性。因咯血量大,于我院介入科行支气管动脉造影,未见明显血管畸形及造影剂渗出,未行栓塞。既往无结核史及接触史,否认生食史,否认发霉物质接触史。入我科后咯血自行减少,复查血常规、出凝血功能正常,CA 125 42 U/mL(正常范围:<35 U/mL),余肿瘤标志物均正常范围,胸部CT示两肺下叶及左肺上叶舌段少许条索及斑片影;外院胸部CT示病灶有吸收(图1),妇科B超及性激素未见异常,因咯血基本已止未行气管镜检查,考虑肺子宫内膜异位症(PEM)。2017年1月出院后再次咯血,痰血收集后送当地病理科未检出子宫内膜基质及腺体;开始规律服用避孕药(屈螺酮炔雌醇片,优思明)治疗,随访1年余未再咯血。
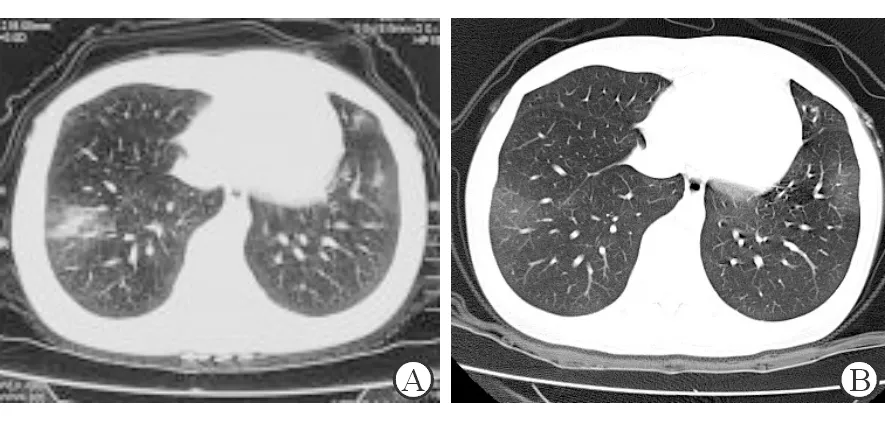
图1 病例1患者胸部CT平扫
A:月经期胸部CT平扫示双下肺片状高密度影,密度不均;B:月经结束后复查胸部CT示双下肺病灶明显吸收
1.2 病例2 患者,36岁,因周期性咯血4年、加重1个月于2017年3月就诊我院,既往孕4产2,均为剖腹产。2005年及2007年分别行药物流产及清宫术1次,平素月经周期正常,无痛经史及月经失调。就诊前4年无明显诱因下出现周期性咯血,色鲜红,稍有胸闷、气促,无发热、盗汗,多于月经前1~2 d出现咯血,鲜血块与痰中带血丝交替,月经结束1~2 d后,咯血自行停止。4年来几乎每次月经周期均伴有咯血,咯血量与经血量呈正相关,外院曾行胸部CT见两下肺环状钙化,未治疗。2个月前外院考虑PEM,予避孕药口服;1个月前患者月经前期再次出现咯血,量较前增多,色鲜红,约20 mL/d,且月经结束后咯血仍持续。外院胸部CT示,两肺下叶斑片影伴空洞,建议增强扫描(图2)。遂就诊我院查肺部小结节薄层平扫,示两肺见斑片、结节,边缘不清,两肺下叶为主,部分形成空洞,内壁光整;各支气管腔通畅,纵隔见稍大淋巴结,胸腔内无积液;考虑PEM收入院。入院后未再咯血,复查胸部CT示两肺炎症较前有吸收,血常规、出凝血功能正常,CA 125(16 U/mL)及其他肿瘤标志物均正常,性激素在正常范围,妇科B超示子宫肌瘤,宫颈囊肿;气管镜见各级支气管通畅,未见明确出血或病变部位;左下肺基底段行TBLB肺活检病理示:肺泡间隔纤维组织增厚,伴有较多淋巴细胞浸润,肺泡腔内可见较多含铁血黄素细胞沉积,铁染色(+),CD10(-),ER(-),PR(-),CA 125(-)。根据患者病史中咯血、肺部病灶变化与月经周期的关系及肺活检病理表现,考虑PEM诊断明确。随后就诊复旦大学附属妇产科医院,加用避孕药及中药后咯血好转。
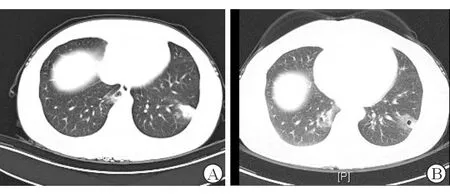
图2 病例2患者胸部CT平扫
A:月经前1 d胸部CT平扫示双下肺片状、团块状高密度影,左侧显著;B:月经结束后复查胸部CT,示病灶吸收,左下肺病灶出现空洞
1.3 病例3 患者,45岁,因反复咳嗽5年于2017年5月在我院就诊,既往孕2产1,顺产,2000年人工流产1次,平素月经周期正常,无痛经。就诊前5年起反复咳嗽,外院考虑肺部感染予抗感染后效果欠佳。2015年6月我院查肺部CT提示左肺少许慢性炎症,左上肺微小结节;2015年10月咳嗽加重行胸部CT示右肺下叶磨玻璃影,炎症可能。2016年3月复查胸部CT示右肺微小结节较前改善。考虑过敏性气管炎可能,予抗过敏治疗1个月,症状好转。此次因咳嗽加重就诊,无发热、盗汗等,查血常规、出凝血功能均正常,T-SPOT:A/B为0/0、血隐球菌荚膜抗原阴性,CT示右下肺炎性病变,予阿奇霉素抗感染1周后症状好转,复查CT提示右下肺炎性病变已基本吸收。入院血常规、出凝血功能及炎症标志物正常范围,胸部CT示右下肺病灶较前无增加(图3),CA 125正常(22.1 U/mL),其余肿瘤标志物均正常,未行气管镜及妇科B超。患者反复咳嗽,抗感染、抗过敏治疗效果不明显,多次随访CT发现右下肺病灶周期性出现、吸收,考虑PEM可能大,因患者年龄较大近围绝经期,且症状轻微无咯血,胸部CT示病灶已不明显,建议观察,未予治疗。

图3 病例3患者胸部CT平扫
A:月经期胸部CT平扫示右下肺片状高密度影;B:月经结束后复查胸部CT,示病灶吸收
1.4 病例4 患者,28岁,因反复周期性咯血4个月于2018年3月来我院就诊,既往孕2产1,为剖腹产,2017年3月因妊娠空囊行药物流产+清宫术,平素月经周期正常,既往无痛经,清宫术后每次行经时下腹部有绞痛,程度较重。2017年11月月经来潮48 h后出现咯血,色鲜红,量约20 mL/d,无发热、胸闷,当地CT示肺部炎症病灶,予抗感染治疗,咯血量逐渐减少,1周后月经结束、咯血停止,复查胸部CT示病灶吸收。2017年12月月经来潮时再次出现咯血,当地医院考虑PEM,转诊上级医院行结核T-SHOT,结果阴性,建议继续排查结核并随访观察。此后再次出现咯血2次,分别为月经前1 d及月经来潮1 d后出现,量少,约10 mL/d,色鲜红,持续约2~3 d后自行停止,考虑PEM入我院。入院后无咯血,胸部CT未见异常,故未行支气管镜、妇科超声、CA 125等检查,未予治疗;建议随访,再次咯血时及时就诊。
2 讨 论
2.1 流行病学特点 有研究发现月经性气胸约占接受手术治疗女性患者23.7%[1]。胸腔子宫内膜异位症占所有自发性气胸原因的3%~6%[2],尚未发现地区及种族在该病发病率方面有所差异。胸腔子宫内膜异位症(TE)好发年龄为30~34岁。1996年,Joseph等[3]分析了110例患者的临床资料后发现TE发病年龄为15~54岁,平均年龄为(35.0±0.6)岁;最常见的临床表现为气胸,其次为血胸、咯血和肺部结节。其中气胸、血胸及咯血多见于右胸(>90%),但肺部结节多为双侧。其危险因素包括妇科手术史、原发或继发的不育症以及盆腔内子宫内膜异位症病史[4]。TE患者中,约50%~85%合并盆腔子宫内膜异位症,约30%~50%同时有不育症[2,5-6]。本文病例中3例患者年龄较小(25~36岁),仅1例为40岁以上,与文献报道符合;4例均有剖宫产和(或)人工流产史;仅1例有经期疼痛,提示可能合并盆腔子宫内膜异位症,4例均已生育。
2.2 发病机制 TE的发病机制迄今尚未明确,但已有多种假说用以解释该病的发病机制及临床表现,主要几种学说罗列如下[7]。(1)转移种植学说,即脱落的子宫内膜组织通过经血逆流进入腹腔,并随腹腔内的体液流动至膈下,再经先天性或继发性膈肌缺损迁移至胸腔,定植于膈肌或胸膜。腹腔内液体流动方向多为顺时针,这使得脱落的子宫内膜易先到右侧膈下;此外,先天性膈肌缺损亦右侧多见,这使得TE多位于右侧。(2)淋巴静脉播散学说,妇科手术操作如刮宫或剖腹产等可致脱落的子宫内膜进入淋巴管或静脉系统,进而随淋巴及血液循环转移定植于肺部,此后随月经周期出现增殖脱落,导致相应的临床症状。该学说可以很好地用于解释PEM,尤其是当双侧肺实质受累时。膈淋巴丛主要位于右侧,这也可能是右侧胸膜或膈肌子宫内膜异位症多见的原因之一;下肺血液灌注最丰富,与双下肺PEM好发相一致。(3)体腔上皮化生学说,与子宫内膜细胞一样来源于体腔上皮的组织如胸膜、腹膜等在某些因素(如雌激素等)刺激下可使其中的前体细胞分化为子宫内膜细胞,进而导致TE。任何单一一种学说都无法解释所有TE类型的形成机制及临床症状,因此,目前认为TE可能为多种因素共同作用的结果。
2.3 临床表现 不具典型性,可多种多样,文献报道TE[8-9]常见表现为月经性气胸(72%~75%)、月经性血胸(10.6%~14%)、月经性咯血(7%~14%)、肺部结节或阴影(2%~6%);PEM主要表现为月经性咯血、肺部结节或阴影。不同患者咯血量各异,通常咯血量不大,但也可出现大量咯血,从痰中带血至大咯血均有报道,差距很大。此外,同一患者每次发作时咯血量也不完全一致,可与每次月经血量多少相关。患者多于月经前24 h至开始后48 h内出现症状[9],随月经结束症状逐渐减轻或消失,随月经周期反复。但患者并非每个月经期都会咯血,且有可能在其他时间点咯血,因此给PEM的诊断带来很大困难。本文中除第3例表现为反复咳嗽外,其余3例患者表现为反复周期性咯血,无气胸、血胸等表现,且咯血量差距较大。
2.4 实验室及影像学检查 可用于TE诊断或评估的实验室检查很少。血清CA 125目前广泛应用于子宫内膜异位症的诊断、预后及治疗检测,且血清CA 125的测定与月经周期也有关[10]。Haga等[11]在2013年的一项研究表明,CA 125升高对诊断TE具有临床意义。但CA 125特异性较差,多种肿瘤性疾病或良性疾病均可导致其升高,故仅可作为参考。本文中3例患者查了血清CA 125水平,1例轻度升高,2例正常。影像学检查如X线、CT、MRI及超声可提高其检出率。动态观察病灶见其随月经周期变化短期内快速变化是具诊断价值的特征,病灶月经来潮时增大,月经后期缩小或消失。TE的X线、CT表现缺乏特异性。X线检查可见胸腔积液、肺部渗出甚至实变、肺部结节等表现;但肺内磨玻璃影、淡片渗出影在X线上往往难以显示,易导致漏诊,因此X线逐渐被CT所取代。
CT可以较为清楚地显示病灶大小、范围、轮廓、多少并能够提供病变具体位置,为手术和诊断提供一定的帮助,快速便捷,故目前常作为首选检查。膈肌子宫内膜异位症CT上可显示膈肌种植,表现为低密度区域,增强后范围显示更加清晰。PEM的CT表现缺乏特异性,可表现为斑片、扇形渗出或实质浸润阴影,类似节段性肺炎,分布符合叶段改变,伴支气管充气征;也可表现为结节病灶,单发或周边的多发结节,密度均匀一致,边缘光滑,轮廓清楚,无分叶及毛刺,周围无卫星灶,周围可伴随新鲜或陈旧的肺实质出血表现,且随月经周期会出现形态和大小的相应改变[12];还可出现囊肿样阴影及有液平面的囊腔等改变,甚至出现空洞[13];病变靠近胸膜会出现不同程度的气胸、液气胸征象,部分可有支气管阻塞及周围肺不张,邻近胸膜可增厚。但由于CT辐射剂量较大且对比分辨力不足,因此近年来越来越重视MRI在诊断TE上的应用[12]。
MRI对比分辨力高,通过多个不同序列能够更好地分辨出血性病变,因此在诊断TE方面尤其具有独特的优势。胸膜上的异位子宫内膜通常在MRI的T1加权像上显示为小囊泡状高强度图像。虽然盆腔异位子宫内膜在T2加权像上为低信号,但膈肌上种植的子宫内膜在所有序列上均表现为高信号,因为膈肌表面的空气可造成T1和其他图像上病变信号强度的增加,使其在膈肌表面形成线性高密度影[12,14]。但MRI也有一定的假阴性率,无法发现较小的病变,且对肺内病灶显示不够理想,因此对PEM患者来说仍首选CT。本组4例患者中有3例经CT发现病灶,下肺病灶为著,其中2例为双下肺病灶、1例为右下肺病灶;CT表现为斑片、渗出或实变影,有1例出现空洞。
超声对腹部子宫内膜异位症的敏感性较高,虽无特异性,但许多TE患者同时伴盆腔子宫内膜异位症,超声方便无创无辐射,可显示腹部异位组织或器官声像图随周期性改变,对临床有积极的提示作用并可更全面地评估患者病情。本组2例患者超声检查均未发现盆腔子宫内膜异位症征象。
2.5 纤维支气管镜检查 PEM临床上容易误诊为肺结核、肺肿瘤等疾病。一方面支气管镜可用于这些疾病鉴别;另一方面可直观显示病灶形态、大小及出血的部位,镜下可见支气管管壁黏膜上有紫红色或紫蓝色结节[15],月经后病变可消失;并可以在病灶部位处刷检或活检行病理学检查寻找子宫内膜基质及腺体细胞以明确诊断。但PEM主要侵犯远端实质组织,其检出阳性率低,且为有创检查,仅作为PEM的辅助检查手段。本组仅第2例患者接受了气管镜检查,镜下未见明确病灶及出血部位,但通过TBLB肺活检病理找到含铁血黄素细胞,亦可认为是诊断PEM有力的佐证。
2.6 诊断及病理 因缺乏对TE的认识及警惕性,往往造成长时间误诊。文献报道[2]首次出现症状至确诊间隔约8个月,部分甚至为数年;但随着对该病认识的不断提高及CT、MRI等影像学的普及,这一时间在逐渐缩短。TE确诊有赖于组织病理,而临床实际工作中很少有病理诊断,因此确诊常非常困难,多是基于病史、影像等的排他性诊断。详细询问病史,仔细梳理症状、影像学随月经周期的变化情况,可为诊断提供重要证据。目前,病理发现病灶中有子宫内膜基质和腺体仍是TE诊断的金标准,仅发现子宫内膜基质为疑似诊断。镜下内膜基质富含圆形或椭圆形的基质细胞,其细胞核为圆形或椭圆形,胞质较少,周围有少量炎性细胞浸润;腺体被基质所围绕,由假复层柱状上皮组成圆形或椭圆形[14,16]。近来研究发现,超过80%的TE病变组织内的内膜基质和腺体的雌孕激素受体均为阳性,88.1%的内膜基质CD10阳性;25%内膜腺体阳性的病例标本中,约有54.1%的内膜基质SMA阳性[17]。因此,有学者认为如果内膜基质细胞激素受体和CD10阳性即使腺体缺失,亦可诊断子宫内膜异位。经咯出的血及胸水脱落细胞发现子宫内膜基质或腺体细胞是对诊断的意义较大,但往往为阴性。标本中富含含铁血黄素的巨噬细胞可作为有力的补充诊断。本组第1例患者出院再次咯血后收集痰血至当地病理科行脱落细胞检查,未见明确子宫内膜基质或腺体细胞;第2例患者肺活检组织虽未检出子宫内膜基质或腺体细胞,组化CD10、ER、PR、CA 125阴性,但标本中检出较多含铁血黄素细胞也是诊断PEM有力的佐证。
2.7 治疗及预后 近年来,越来越强调TE的治疗需根据病变的部位、症状严重程度及患者的生育要求等因素综合考虑,推荐多学科协作(MDT)制定治疗方案[18],目前主要包括手术治疗和药物治疗两大方面。电视胸腔镜(video-assisted thoracoscopic surgery, VATS)的开展及普及大大减少了手术创伤,且能清晰显示并全面探查胸腔病灶,从而提高了胸腔活检阳性率,治疗更彻底,降低了术后复发率,因此外科手术在TE尤其是月经性气胸、血胸患者的治疗应用越来越受重视。药物治疗主要指内分泌治疗,其他还有常规止血药物、中药治疗等。内分泌治疗是通过阻断雌激素而抑制异位子宫内膜细胞生长,起到止血甚至根治的目的。临床上常用的药物种类有口服避孕药、促性腺激素释放激素(GnRH)类似物、睾酮衍生物如达那唑及孕三烯酮、孕激素受体调节剂如米非司酮以及芳香化酶抑制剂等,目前多认为疗程不少于6个月[2]。但内分泌治疗不良反应较多,如体质量增加、雄性化、闭经、不育、骨密度下降、潮热、阴道干燥等,且停药后可能复发(单纯内分泌治疗月经性气胸的复发率可达50%[19]);很多患者拒绝接受药物治疗或疗程不足。对于月经性气胸、月经性血胸,目前内分泌治疗主要作为外科手术后的补充治疗。对于PEM患者,内分泌治疗的效果优于月经性气胸[20],但病灶多为双侧,手术创伤较大、效果不如单一病灶,中央型病变需切除肺叶。因此目前PEM首选方案为药物保守治疗,手术往往用于药物治疗失败、无法耐受药物不良反应或症状反复发作等患者。本组2例患者口服避孕药后1例1年未再咯血,1例咯血较前明显减少,均效果显著。TE总体预后良好,部分患者在未给予任何治疗的情况下也会自愈或缓解症状。PEM尚未见致死性咯血的报道。手术和(或)内分泌治疗均有一定的复发率。Marjański等[19]对比了月经性气胸患者手术和内分泌治疗后6个月和12个月的复发率,发现分别为5%、25%和50%、60%。术后联用内分泌治疗可降低复发率。
TE是较为罕见的疾病,发病机制尚未明确,PEM作为其少见类型,容易误诊,临床须提高对PEM的认识。PEM主要表现为月经性咯血、肺部结节或阴影,其诊断金标准即在病变组织中同时发现内膜基质及腺体。详细询问病史、仔细梳理症状、影像学随月经周期的变化情况,可为诊断提供重要证据。CT及MRI等影像学的应用有助于发现病灶。TE治疗主要包括内分泌治疗及手术治疗,预后良好。

