急性镉胁迫下草鱼肝胰脏中几个内参基因表达稳定性的比较研究
吴勇亮,杨颖康,谭淑雯,彭钟琴,苗鹏飞,于 辉
(佛山科学技术学院 生命科学与工程学院,广东 佛山 528231)
美国毒性物质与疾病管理委员会(ATSDR)对毒性物质的排序中,重金属镉(Cadmium,Cd)位列第7位,国际抗癌症联盟(IARC)于1993年将镉定为确定性的人类致癌毒物[1]。Cd是非必需、高致毒元素,具有亲脂性强、易富集和难降解的特性,可蓄积在人和动物体内,并到达较高的浓度,其中在水环境中鱼类可富集103~105倍[2]。Cd的生物学毒性主要包括早期发育阶段毒性、遗传毒性和蛋白毒性[3],主要表现在干扰细胞的多种代谢过程,特别是能量代谢、膜运输和蛋白质合成,并可能直接或间接地干扰DNA的遗传控制和修复机制等[4]。草鱼作为我国重要的水产经济动物,产量位居淡水养殖鱼类第一,因此在分子或基因层面上研究在草鱼镉污染暴露下的生物标志物,对重金属的早期预警,草鱼健康养殖具有重要的应用意义。
内参基因是指其表达水平不受研究条件的影响且可以在多种样本间恒定表达的已知参照基因,用此基因的表达水平可以准确量化初始材料的载量。但根据陈瑞等[5]研究表明,在不同生长阶段、不同试验条件、不同器官组织和不同细胞类型的样品中,内参基因的表达水平是不稳定的,可能导致以其为内参依据的目的基因表达量产生较大的误差,有时甚至引出错误或相反的结论。根据现有的报道[6-7]可知,草鱼内参基因稳定性筛选的候选内参基因一般有β-actin、18S rRNA和GAPDH。在前人试验[8-9]中,在镉胁迫下草鱼相关目标基因有以β-actin和β2m作为内参基因来进行分析。但作为镉胁迫下草鱼内参基因稳定性研究还未见报道。故本试验候选内参基因选择β-actin、18S rRNA、GAPDH和β2m进行研究。
本试验将以草鱼的肝胰脏为材料,利用荧光定量PCR检测β-actin、18S rRNA、GAPDH和β2m 4个候选内参基因的表达水平,并利用geNorm、NormFinder、BestKeeper这三种软件[10]对各候选内参基因的表达进行稳定性评价,筛选出最稳定表达的内参基因。为后续重金属镉毒性研究的遗传毒性生物标志物的探索提供了参考依据。
1 材料与方法
1.1 材料
1.1.1 样品采集 试验草鱼全部取自佛山市南海百容水产良种有限公司,平均体重(11±2)g,随机分组饲养于7个经消毒的水族箱中。试验前静养3 d后,日死亡率低于1%时开始攻毒试验。根据本人前期的急性毒性结果可知重金属镉对本批次草鱼的96 h的半致死浓度为6.30 mg/L。本次草鱼攻毒试验采取静态试验法[11],试验周期为96 h。试验用药品氯化镉(CdCl2·2.5H2O)为分析纯,配成母液后,按比例倒入充分曝气的水中,稀释成3.15 mg/L(96 h半致死浓度的50%)的试验水环境。取样时间为镉胁迫前、镉胁迫后的6、12、24、48、72、96 h,共七个时间点。每个时间点样品采集时,从7个水族箱中随机捞取3尾草鱼到酒精灯旁进行解剖,剪取大小适合的新鲜肝胰脏组织用液氮迅速冷冻后保存于-80 ℃超低温冰箱中进行下一步试验。
1.1.2 试剂 总RNA提取试剂(Trizol裂解液)购自Invitrogen公司,TaKaRa反转录试剂盒PrimeScriptTMRT reagent Kit,TaKaRa荧光定量试剂盒SYBR○RPremixExTaqTMⅡ。
1.2 方 法
1.2.1 总RNA提取和cDNA合成 将采集各处理的样品用液氮研磨后,使用Trizol裂解液(Invitrogen公司)提取总RNA,然后根据 TaKaRa PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)说明书将提取的总RNA反转录成cDNA。并于-80 ℃下保存。
1.2.2 引物设计 选择4个常见的管家基因18S rRNA,GAPDH,β-actin,β2m作为本试验的候选内参基因。从NCBI数据库中获得18S rRNA,GAPDH,β-actin,β2m的序列,采用Primer 3(http://primer3.ut.ee/)在线软件分别设计4种候选管家基因的实时荧光定量PCR引物(引物信息见表1),所有引物均由上海生工生物工程有限公司合成。

表1 4种候选内参基因实时荧光定量PCR引物Table 1 Four kinds of candidate reference genes for Quantitative Real-time PCR primers
1.2.3 实时荧光定量PCR 荧光定量试剂盒为TaKaRa SYBR○RPremixExTaqTMⅡ (Perfect Real Time),荧光定量仪器为ABI PRISM 7500 Fast ReaL-time PCR System。反应体系为20 μL,包括:SYBR○RPremixExTaqTMⅡ 10 μL,ROX Reference DyeⅡ 0.4 μL,上、下游引物(10 μM)各0.8 μL,cDNA 2 μL,双蒸水6 μL。反应程序为:①预变性:95 ℃ 30 sec;②扩增反应:95 ℃变性5 sec,56 ℃退火30 sec,72 ℃延伸34 sec,40个循环;③溶解曲线形成:90 ℃ 15 sec,60 ℃ 1 min,95 ℃ 15 sec,60 ℃ 15 sec。反应结束后导出内参基因Ct值。
1.3 数据统计与分析
本试验采用geNorm 、NormFinder和BestKeeper三种程序对4种候选内参基因在草鱼不同镉胁迫时间的肝胰脏的表达稳定性进行统计学分析。
根据公式Q=2Ctmin-Ctsample,将每个扩增样品的Ct值换算成相对表达量Q(Ctsample为每个样品的Ct 值,Ctmin为各内参基因中最低Ct值)。将相对表达量Q导入geNorm程序和NormFinder程序来进行稳定性分析[10,12]。BestKeeper程序是一个内置公式的Excel表格,输入内参基因Ct值可以通过内置公式计算得到每个内参基因的标准偏差(SD)和变异系数(CV),从而对各候选内参基因进行稳定性评价[10]。
2 结果与分析
2.1 草鱼候选内参基因引物检测
应用常规PCR对引物特异性进行检测,1%琼脂糖凝胶电泳检测结果如图1。从图中可看出引物扩增片段与预期大小相同、条带单一、无二聚体,说明可用于后续qRT-PCR分析。
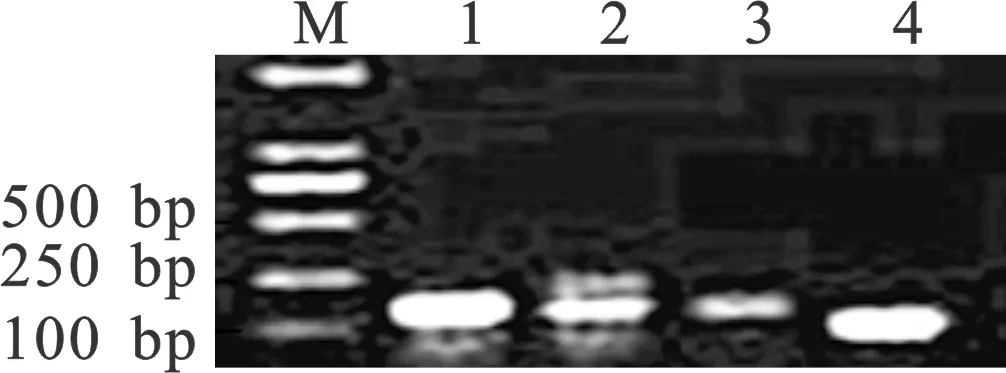
图1 四对引物的常规PCR电泳检测Fig.1 Four pairs of primers in PCR detectionM.Marker;1.GAPDH;2.β2m;3.β-actin;4.18S rRNA
2.2 镉胁迫不同时间内参基因表达水平分析
对草鱼肝胰脏样品4个候选内参基因表达水平(Ct)进行分析(图2),由图2可以看出,18S rRNA在4个候选基因中Ct值最小,转录最高。
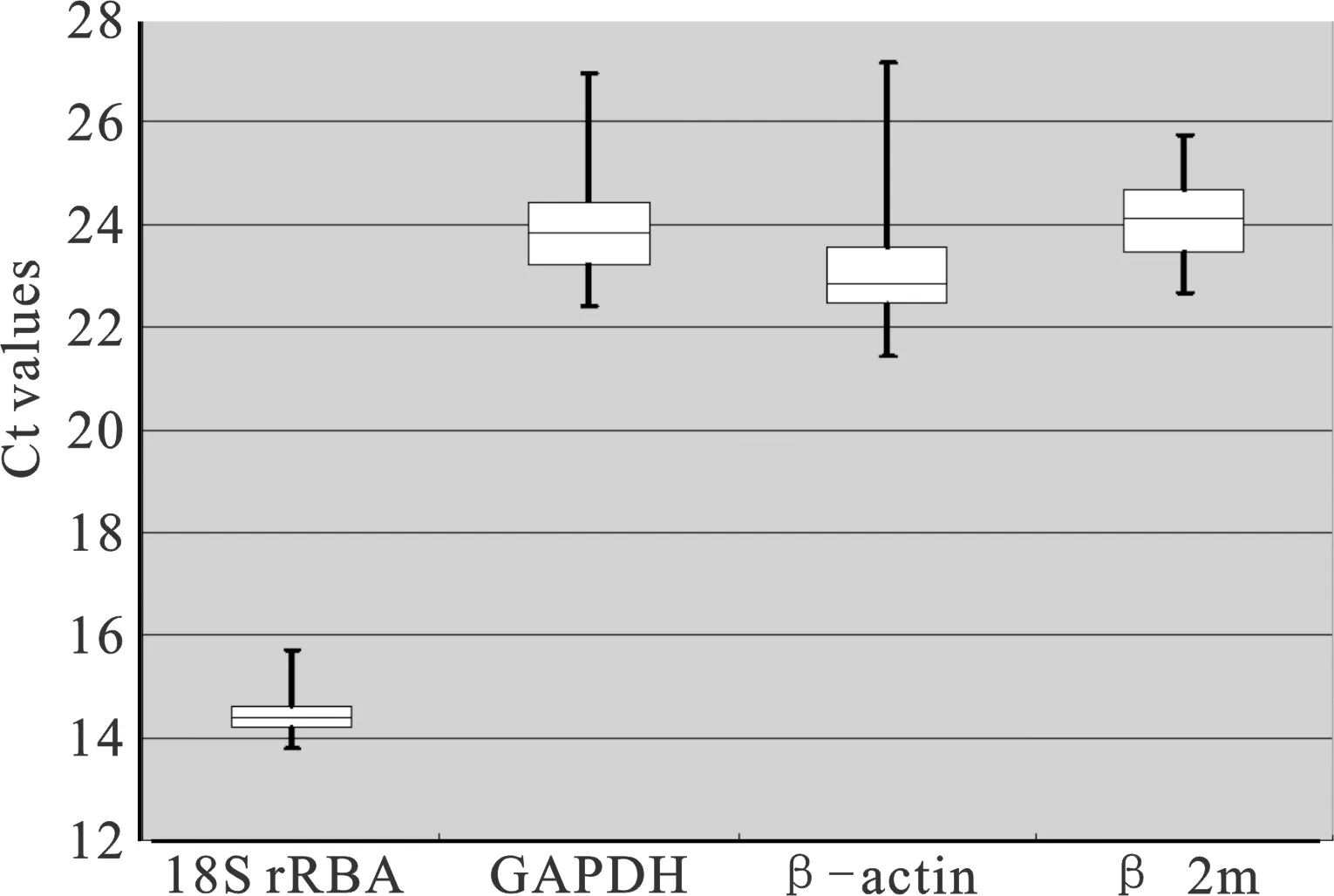
图2 4个候选内参基因的转录水平Fig.2 Transcript levels of 4 candidate reference genes
2.3 镉胁迫不同时间内参基因表达稳定性分析
geNorm分析结果是以两个稳定性最好的内参基因其表达稳定性相同为假设,根据基因之间的配对变异来计算候选内参基因的表达稳定性M值,M值越小代表稳定性越好。本研究可以得出18S rRNA和β2m的M值最小(见表2)。因此18S rRNA和β2m在geNorm分析中为镉胁迫不同时间中最合适的内参基因。
Normfinder分析的结果为各个候选内参基因的稳定值,稳定值越小代表稳定性越好。本研究表明,GAPDH和18S rRNA的稳定值分别为0.423和0.431(见表2)。本试验表明GAPDH在Normfinder分析中为镉胁迫不同时间最合适的内参基因。
BestKeeper分析主要以结果中的标准差(STDEV)和变异系数(CV%)来评定内参基因的稳定性,两者越小稳定性越好。本研究中,18S rRNA的标准差和变异系数分别为0.28和1.96(见表2),均为4个候选内参基因的最小值。本试验表明18S rRNA在BestKeeper分析中为镉胁迫不同时间最合适的内参基因。

表2 候选内参基因表达稳定性的geNorm、Normfinder和BestKeeper分析结果Table 2 Expression stabilities of candidate reference genes analyzed by geNorm, Normfinder and BestKeeper
3 讨 论
为了实现对环境的有效检测,采用生物分子标记作为“早起预警”工具已广泛应用。而qPCR由于操作简便,灵敏度高,重复性好等优点,被广泛应用于对一些潜在分子标志物mRNA表达进行检测和分析,从而为环境污染提供有效预警[13]。在qPCR试验中,挑选不同细胞类型或者不同的组织内稳定表达、在不同内外因素作用下也能稳定表达、表达水平与目标基因相似等条件的理想内参基因,能有效校正各种试验误差[14]。
研究表明,内参基因不是一成不变的,即使是同一物种不同因素作用下,符合条件的内参基因也不尽相同[15],鱼体在镉胁迫环境下也发现了相同的情况。Gao等[16]研究红鲤在镉胁迫下,发现内参基因稳定性由好至差的顺序为芳香烃受体核易位蛋白2(ARNT2)、18 S rRNA、翻译延长因子1α(EF1α)、β-actin、GAPDH。Lee等[17]研究发现皱纹盘鲍在重金属(铜、锌和镉)污染条件下,肝胰腺中β-actin稳定性较好。Lang等[18]研究了不同浓度镉胁迫下斑马鱼的内参基因稳定性筛选,在肝脏、肾脏和脾脏中β-actin较好,在鳃中GAPDH较好。Chen等[19]探讨斑马鱼肝细胞在镉环境中候选内参基因的表达稳定性,结果表明GAPDH的稳定性最好,β-actin的稳定性最差。本研究通过对4个候选内参基因在镉胁迫不同时间(0、6、12、24、48、72、96 h)中表达稳定性进行研究,筛选得到镉胁迫不同时间草鱼肝胰脏中最佳内参基因为18S rRNA。18S rRNA是真核生物的核糖体RNA的一种,由18S rDNA 转录而成。18S rDNA在生物中是最为保守的基因之一,所以18S rRNA一般任何情况下都能稳定存在,受外界影响调控较小,是一种最为常用的内参基因[20]。Su等[21]对草鱼不同组织内参基因进行筛选,稳定性结果为18S rRNA > EF1α > GAPDH >β-actin,而在不同时间点对草鱼脾脏进行呼肠弧病毒感染,内参基因稳定性筛选结果为18S rRNA >β-actin> GAPDH>EF1α。董捷[22]用呼肠孤病毒感染草鱼后,发现18S rRNA和β-actin的稳定性较高,适合作为内参基因。综合本文试验结果,18s rRNA可作为研究草鱼镉胁迫后的相关基因表达情况的内参基因。
4 结 论
本试验的4种候选管家基因在镉攻毒后草鱼肝胰脏中的表达丰度最高的是18S rRNA,并综合geNorm、NormFinder和BestKeeper三个程序的分析结果表明18S rRNA作为内参基因来研究镉攻毒后草鱼肝胰脏中目标基因的表达较为稳定。本文为后续镉胁迫下草鱼肝胰脏内参基因的选择提供了试验依据,也为后续生物标志物用于检测重金属污染奠定了基础。
第39卷 第7期家畜生态学报Vol.39 No.72018年7月Acta Ecologiae Animalis DomasticiJul. 2018

