FMR1基因在小尾寒羊卵泡期和黄体期组织中的差异表达分析
梁奔梦,狄 冉,刘秋月,王翔宇,张效生,张金龙,胡文萍*,储明星*
(1.中国农业科学院 北京畜牧兽医研究所,农业部动物遗传育种与繁殖重点实验室,北京 100193;2.天津市畜牧兽医研究所,天津 300381)
我国绝大多数绵羊均表现出季节性发情的特点,但也有一些品种如小尾寒羊和湖羊属于常年发情。发情调控受卵泡发育和激素分泌等多种因素的影响,而FMR1基因可能是影响绵羊发情调控的因素之一。Verkerk等[1]在人上研究发现,FMR1基因是一个高度保守的基因。人FMR1基因位于染色体Xq27.3,cDNA全长4 661 bp,有17个外显子和16个内含子组成,长38 kb[2]。FMR1基因在很多组织中都有表达,如大脑、小脑等脑部组织以及上皮组织[3]。FMR1基因及其翻译的蛋白FMRP在人卵泡颗粒细胞中表达[4],该细胞在卵泡的生长和发育及卵母细胞的成熟过程中具有不可替代的作用。FMR1基因突变会影响小鼠的卵泡数量,使卵泡凋亡增加,该基因还可以调节大鼠的卵泡生长[5-7]。此外,在卵泡发育过程中,FMR1基因对雌激素的分泌以及排卵前LH峰的形成有一定的作用[8-9]。因此,推测FMR1基因可能参与哺乳动物的发情调控。目前关于该基因与发情调控相关的研究主要集中在大鼠[7]、小鼠[10-11]和人[12]上,而在绵羊中相关的研究鲜有报道。
因此,本试验选取常年发情和多羔的小尾寒羊为研究对象,分别采集卵泡期和黄体期的组织,通过半定量RT-PCR对FMR1基因在卵泡期小尾寒羊18个组织中的表达情况以及采用荧光定量PCR对该基因在卵泡期和黄体期小尾寒羊5个繁殖组织间的表达差异进行分析,初步探讨FMR1基因与绵羊发情调控的关系,为研究绵羊繁殖调控机制提供参考依据。
1 材料与方法
1.1 样品采集和采样要求
选择健康状况良好的卵泡期和黄体期成年小尾寒羊母羊各3只,年龄2~3岁。小尾寒羊来自天津农科院畜牧所种羊场。采集下丘脑、垂体、大脑、小脑、甲状腺、心、肝、脾、肺、肾、肾上腺、大肠、小肠、卵巢(左、右)、输卵管、子宫体、子宫角18种组织。样品采集要在屠宰后半小时之内完成。采集的新鲜组织装入2 mL RNase-Free冻存管,立即置于液氮中储存,待所有样品采集完成后转入干冰运输,带回实验室,-80 ℃保存备用。
1.2 主要试剂
RNA提取试剂盒购于天根生化科技有限公司(北京),反转录试剂盒(PrimeScriptTMRT Reagent Kit)和荧光定量染料(SYBR○RPremix ExTaqTMⅡ)均购于TaKaRa公司(大连),TaqPCR Master Mix购于拓英坊科技有限公司(北京)。
1.3 组织总RNA的提取和检测
使用动物组织总RNA提取试剂盒加Trizol(Invitrogen, 美国)提取各组织总RNA,用Nanodrop2000检测提取RNA的浓度和OD值,用1.2%的琼脂糖凝胶电泳检测RNA完整性。
1.4 引物设计
根据GenBank提供的绵羊FMR1基因mRNA序列(登录号为:XM_015105001),利用Primer 3.0软件进行跨外显子引物设计,以β-actin(NM_001009784)作为内参基因。引物由北京天一辉远生物科技有限公司合成。引物名称和序列、退火温度以及扩增片段大小见表1。
1.5 cDNA合成
使用反转录试剂盒反转录合成cDNA,反转录体系总体积为20 μL:PrimeScript RT Enzyme MixⅠ1 μL,Oligo dT Primer 1 μL,Random 6 mers 1 μL,5×PrimeScript Buffer(for Real Time) 4 μL,1 μg总RNA,RNase-Free ddH2O补足20 μL。轻轻混匀后于PCR仪上进行反转录。反转录条件为:37 ℃ 15 min,85 ℃ 5 s,获得cDNA第一链。全程操作在冰上进行。反转录产物进行5倍稀释,用持家基因β-actin进行PCR检测,将符合标准的cDNA置于-20 ℃保存,以用于检测目的基因的表达。
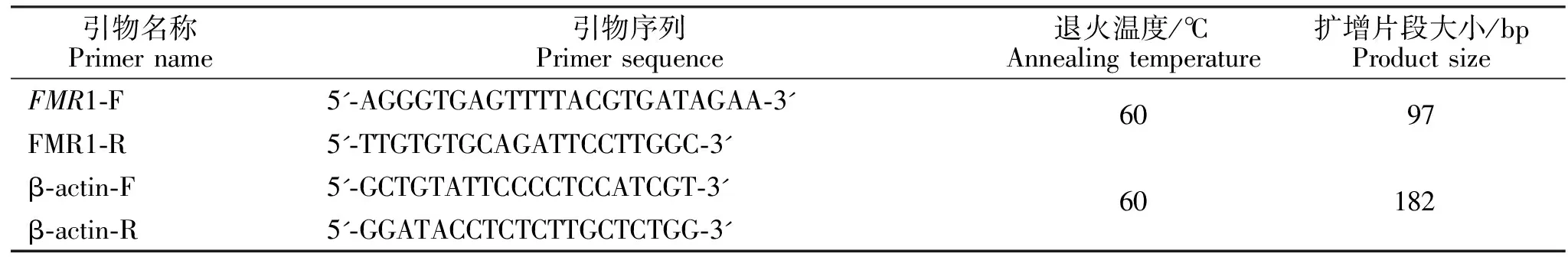
表1 绵羊FMR1基因的引物信息Table 1 Primer information of FMR1 gene in sheep
1.6 PCR反应
PCR反应总体积为20 μL:2×Taq PCR Master Mix 10 μL,ddH2O 8 μL,10 nmol/L上下游引物各0.5 μL,cDNA模板1.0 μL。
反应程序为:95 ℃预变性5 min;95 ℃变性30 s,61 ℃退火30 s,72 ℃延伸30 s,28个循环;72 ℃延伸5 min;4℃保存。1.5%琼脂糖凝胶电泳检测PCR产物大小。
1.7 实时荧光定量PCR
1.7.1 实时荧光定量PCR体系和程序 反应体系总体积为20 μL:SYBR Premix Ex TaqⅡ 10 μL,RNase-Free ddH2O 6.4μL,10 nmol/L上、下游引物各0.8μL,cDNA 2μL。PCR程序为:95 ℃预变性5 s,95 ℃变性5 s,60 ℃ 30 s,40个循环;反应结束后对熔解曲线进行分析。
1.7.2 实时荧光定量检测与数据分析 荧光定量检测利用Roche Light Cycler○R480Ⅱ型荧光定量PCR仪进行,以β-actin为内参基因,每个样品重复检测3次。采用2-△△CT法计算目的基因相对表达量,用SPSS17.0统计软件对数据进行分析,用Duncan法进行多重比较。
2 结果与分析
2.1 总RNA质量检测和Real-time PCR熔解曲线
取2 μL下丘脑组织RNA点样,利用1.2%琼脂糖凝胶电泳对RNA完整性进行检测,结果表明RNA完整性良好,28S条带亮度大于18S且二者均无明显降解(图1)。
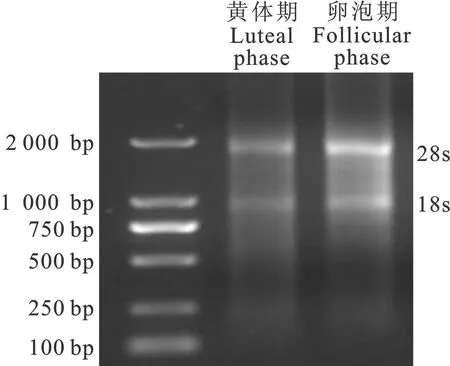
图1 小尾寒羊不同时期RNA电泳结果Fig.1 RNA electrophoretogram of different phases in Small Tail Han ewes
本研究以β-actin为内参基因,FMR1为目的基因,熔解曲线如图2所示。各样品模板在反应后期可得单峰、峰型锐利的熔解曲线,说明引物特异性良好,符合荧光定量PCR数据分析的要求。
2.2 FMR1基因在绵羊组织中表达情况
半定量RT-PCR扩增后,用1.5%琼脂糖凝胶电泳检测,FMR1基因和β-actin持家基因片段大小与预期结果一致。在小尾寒羊卵泡期18个组织的表达情况如图3所示。
半定量RT-PCR结果表明,在卵泡期小尾寒羊中,β-actin基因在18个组织中均扩增良好,具有明显的内参基因表达特征。FMR1基因在18个组织中均有表达,其中在大脑、小脑、卵巢(左、右)、输卵管、子宫体、子宫角中高表达,在其它各组织呈中等或低丰度表达。
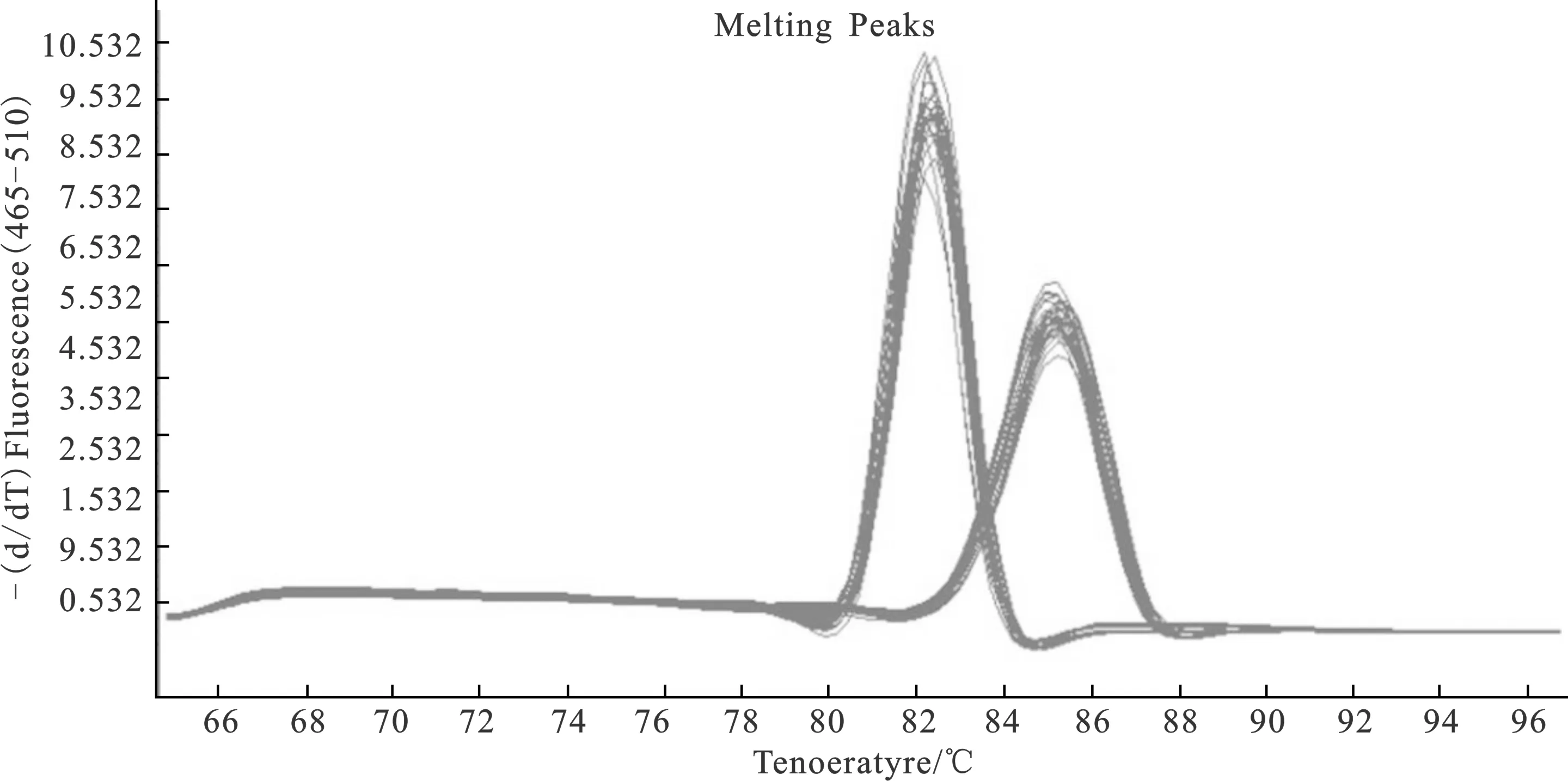
图2FMR1基因的熔解曲线
Fig.2 Melting curve ofFMR1 gene
2.3 FMR1基因在不同时期繁殖相关组织中的表达
采用荧光定量PCR技术分别对处于卵泡期和黄体期的小尾寒羊FMR1基因在下丘脑、垂体、卵巢、输卵管、子宫体5个繁殖相关组织中的表达水平进行了研究,结果如表2。
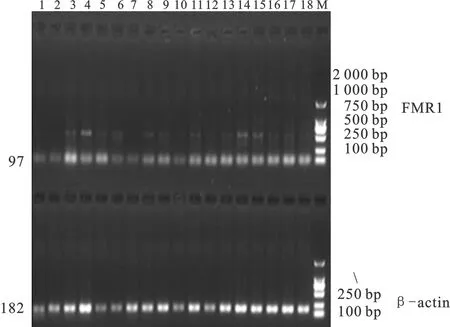
图3FMR1基因在小尾寒羊的组织表达谱
M.DL2000 DNA Marker;1-18.下丘脑、垂体、大脑、小脑、甲状腺、心、肝、脾、肺、肾、肾上腺、大肠、小肠、卵巢(左、右)、输卵管、子宫体、子宫角
Fig.3 Tissue expression profile ofFMR1 gene in Small Tail Han sheep
M.DL2000 DNA Marker;1-18.hypothalamus, pituitary, brain, cerebellum, thyroid, heart, liver, spleen, lung, kidney, adrenal gland, large intestine, small intestine, ovary(left, right), oviduct, uterine body, uterine horn

表2 FMR1基因在小尾寒羊繁殖相关组织中的表达量Table 2 Expression level of FMR1 gene in reproductive tissues in Small Tail Han sheep
注:同列肩标小写字母不同表示差异显著(P<0.05)。
Notes:Values with different lowercase superscripts in the same row show significant difference(P<0.05).
比较发现,在卵泡期小尾寒羊中,FMR1基因在垂体的表达量最高,输卵管次之,子宫体最低。在黄体期小尾寒羊中,该基因在垂体的表达量最高,卵巢次之,子宫体最低。比较卵泡期和黄体期各组织的表达量发现,FMR1基因在卵泡期小尾寒羊各组织中的表达量均高于黄体期,且不同时期该基因在垂体的表达量最高,子宫体最低。其中在下丘脑、垂体、卵巢三个组织中卵泡期的表达量高于黄体期,但差异不显著(P>0.05),而在输卵管和子宫体两个组织中卵泡期的表达量显著高于黄体期(P<0.05)。
3 讨 论
发情是指雌性动物初情期后,受下丘脑-垂体-卵巢轴系调控的卵泡发育并分泌雌激素,雌激素进而作用于大脑皮质使雌性动物在生理和行为上发生变化的一种生理现象[13]。发情调控受卵泡发育和激素分泌等因素的影响,FMR1基因影响哺乳动物雌激素的分泌以及卵泡的数量。戴丽军等[14]发现,FMR1基因敲除小鼠雌激素水平显著低于野生型小鼠。杨燕燕等[9]也发现,FMR1基因敲除可影响小鼠性激素水平。FMRP在卵巢中高度表达,FMRP对卵巢功能可能有调控作用[15-16]。FMRP可调节卵巢的储备功能,它的缺失可能影响其他调节繁殖功能的蛋白的转录和翻译,从而影响繁殖功能[7,17-18]。而卵巢又是卵子生成和多种生殖激素分泌的重要场所,说明该基因可能通过影响激素的分泌影响哺乳动物的发情调控。Alcoba等[4]研究发现,FMR1基因的表达和FSH的刺激密切相关,并且该基因表达的蛋白FMRP可能参与卵母细胞的成熟。Hoffman等[5]发现FMR1基因突变小鼠各级卵泡数量比正常小鼠少,颗粒细胞也较少。Lu等[6]也发现FMR1基因突变小鼠的卵泡数量降低,卵泡凋亡增加。Ferder等[7]发现FMR1基因对大鼠卵泡生长起到调节作用。FMR1基因敲除大鼠的卵泡数量要少于野生型大鼠,且差异显著[19]。这些研究结果提示FMR1基因与哺乳动物卵泡数量密切相关,可能会影响卵泡的正常生长和发育,从而对哺乳动物发情调控起到一定的作用。而本研究对FMR1基因在卵泡期和黄体期小尾寒羊各繁殖组织的表达差异进行了分析,发现该基因在卵泡期各繁殖组织的表达量均高于黄体期。说明该基因可能调控小尾寒羊卵泡期到黄体期发情状态的转换,与小尾寒羊的发情调控相关,本研究结果与以上研究发现相符。
繁殖相关功能的调控非常复杂。目前的研究发现,FMR1基因对发情调控的影响和神经肽Y(Neuropeptide Y,NPY)的表达密切相关[19-20]。NPY是一种肽类物质,广泛分布于哺乳动物的中枢和周围神经系统中,与下丘脑-垂体-性腺轴的调控密切相关,对排卵前的LH 峰有促进作用[8,21];同时NPY可影响卵巢的血流,调节卵泡的生长,影响卵泡的发育[22]。本研究通过比较FMR1基因在卵泡期和黄体期繁殖相关组织的表达量发现,该基因在垂体中的表达量最高,而小尾寒羊进入卵泡期时,腺垂体分泌的LH会与FSH协同作用,促进卵泡进一步生长并分泌雌激素,雌激素分泌到一定数量时,作用于腺垂体,抑制FSH的分泌,同时刺激LH释放,出现排卵前LH峰,引起卵泡的成熟破裂和排卵。排卵后,小尾寒羊由卵泡期进入黄体期。因此,推测该基因在垂体中的表达量最高,可能是因为它对排卵前LH峰的形成以及卵泡的生长发育有促进作用。这与以上NPY的相关研究结果一致,说明FMR1基因可能通过影响NPY的表达来促进排卵前LH峰的形成,进而实现小尾寒羊从卵泡期到黄体期的发情状态转换。
4 结 论
本研究初步表明,FMR1基因可能会调控卵泡期到黄体期发情状态的转换,与小尾寒羊的发情调控相关,但具体的机制还有待进一步研究。

