NAC抑制NLRP3炎性体在脂多糖诱导的大鼠急性肺损伤的作用及机制
孙 磊,陈珊珊,王 李,章福彬
(解放军105医院急诊科,合肥 230000;*通讯作者,E-mail:fubinzhang2017@163.com)
急性肺损伤(acute lung injury,ALI)、急性呼吸窘迫综合征(ARDS)和肺炎等炎症性肺病是常见的危及生命的疾病,具有高发病率和死亡率;ALI是急性呼吸衰竭的主要原因,常伴有多器官衰竭[1,2]。ALI的特征是肺泡-毛细血管屏障通透性增加,包括毛细血管内皮的广泛破坏,导致肺水肿伴富含蛋白质的液体外渗和间质性肺水肿,表现为弥漫性肺泡实质损伤和急性肺损伤。此外,当肺泡基底膜受损并且液体渗入腔隙时,可以导致肺通气-灌注失衡[3]。近年来,随着国内外研究学者对急性肺损伤的研究深入,越来越多的分子机制参与ALI的发生发展,包括细胞凋亡、坏死、自噬以及炎症反应。NLRP3炎症小体属于NOD家族中最具特征性的炎症小体,多种刺激因子包括过量的ATP,葡萄糖,活性氧(ROS)等内源性刺激以及细菌鞭毛蛋白等外源性刺激均可诱导激活NLRP3炎症体[4]。NLRP3炎症小体通过与pro-caspase-1结合激活pro-caspase-1裂解成具有酶样活性的caspase-1,并介导IL-1β和IL-18成熟和释放,从而在炎症反应和促炎性程序性细胞死亡中起重要作用[5]。ROS是重要的NLRP3激活剂,而在急性肺损伤中,ROS的过量产生可以加重肺损伤并促进肺纤维化,相关研究也表明,NLRP3在LPS诱导的ALI中表达上调,参与ALI的发生发展[6]。N-乙酰半胱氨酸(NAC)是ROS的特异性清除剂,是一种硫醇化合物与巯基和谷胱甘肽的前体,NAC被用于抑制活性氧(ROS)的产生,通过调节氧化还原反应从而调控细胞炎症反应[7]。然而,关于NAC在LPS诱导的ALI中的作用机制以及与NLRP3炎性体的作用关系目前尚不清楚,因此,本研究通过建立脂多糖(LPS)诱导的SD大鼠ALI模型,并用NAC进行预处理,探究NAC在LPS诱导大鼠ALI中的作用及潜在机制。
1 材料与方法
1.1 主要试剂与仪器
LPS粉剂(美国Sigma公司);NAC粉剂(美国Sigma公司);髓过氧化物酶(MPO)、肿瘤坏死因子-α(TNF-α)、乳酸脱氢酶(LDH)、白细胞介素18(IL-18)ELISA试剂盒(南京建成),NLRP3和IL-1β一抗(美国abcam公司)、caspase-1和ASC一抗(美国santa公司),GAPDH一抗(美国CST公司),酶标仪(美国Perkin Elmer公司),Odyssey双色红外激光成像系统(美国LI-COR公司)。
1.2 动物动物与模型建立
32只成年雄性SD大鼠(6-8周龄,220-250 g),购于湖南斯莱克景达实验动物有限公司(生产许可证号:SCXX(湘)2011-0003)。随机分为对照组、急性肺损伤模型组、NAC对照组(NAC预处理)和NAC处理组(NAC预处理+急性肺损伤模型),每组8只。模型组和NAC处理组大鼠采用腹腔注射脂多糖LPS(5 mg/kg)建立急性肺损伤模型,对照组和NAC对照组腹腔注射等量生理盐水;NAC对照组和NAC处理组于生理盐水或LPS注射前30 min腹腔注射20 mg/kg NAC。生理盐水或LPS腹腔注射后24 h,收集各组大鼠血清和肺组织标本进行指标检测。
1.3 肺湿/干重比(W/D)测定
1%戊巴比妥钠麻醉下迅速取出右肺上叶,用滤纸吸干表面水分,称取肺组织湿重(W),置于75 ℃恒温烤箱中烘烤48 h至恒重,测定肺组织干重(D),计算右肺上叶W/D。
1.4 血清MPO、LDH、TNF-α、IL-18水平测定
1%戊巴比妥钠麻醉下经右侧颈总动脉采集颈动脉血,离心收集血清,-80 ℃保存。采用酶联免疫吸附试验(ELISA)测定MPO、LDH、TNF-α、IL-18活性,操作严格按照试剂盒说明书进行。
1.5 肺泡灌洗液中MPO、TNF-α、LDH、IL-18检测
在1%戊巴比妥钠麻醉下结扎肺门,使用预冷的PBS进行左肺支气管-肺泡灌洗,回收支气管肺泡灌洗液(BALF),1 500 r/min,离心15 min,取上清分装,于-80 ℃冰箱保存。按照MPO、LDH、TNF-α、IL-18活性检测试剂盒说明检测相关活性。
1.6 肺组织中NLRP3、caspase-1、ASC和IL-1β蛋白表达检测
在1%戊巴比妥钠麻醉下取肺组织,迅速冻存于液氮中,然后转移至-80 ℃冰箱保存。Western blot检测肺组织NLRP3、caspase-1、ASC和IL-1β蛋白表达水平。取肺脏组织80 mg,加入800 μl RIPA裂解液,冰上裂解30 min,再冰浴下电动匀浆,4 ℃,12 000 g离心15 min,取上清,用BCA法测定蛋白浓度。加5×上样缓冲液混匀煮沸10 min。用SDS-PAGE分离蛋白,电转于PVDF膜上,5%脱脂奶粉室温封闭1 h,分别使用NLRP3一抗(1 ∶1 000)、caspase-1一抗(1 ∶200)、ASC一抗(1 ∶200)、IL-1β一抗(1 ∶1 000)4 ℃孵育过夜。TBST洗涤3次,每次10 min,荧光二抗(1 ∶10 000,Li-Cor)室温孵育1 h,TBST洗涤3次,每次10 min。用odyssey双色红外激光扫描显影仪(Li-Cor公司,美国)扫描荧光蛋白条带,通过目的蛋白条带灰度值与内参GAPDH条带灰度值的比值表示目的蛋白的表达水平。
1.7 统计学分析
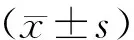
2 结果
2.1 各组大鼠肺组织干湿比比较
LPS处理后24 h,与对照组大鼠相比,LPS诱导的模型组大鼠的肺组织干湿比明显增加(P<0.01);且与模型组相比,NAC处理组大鼠肺组织干湿比显著下降(P<0.01);对照组和NAC对照组大鼠肺组织干湿比无明显差异,差异无统计学意义(见图1)。
2.2 各组大鼠血清MPO、LDH、TNF-α、IL-18水平

与对照组比较,**P<0.01;与模型组比较,##P<0.01图1 各组大鼠肺组织W/d比较Figure 1 Comparison of lung W/d among four groups
与对照组比较,ALI模型组大鼠血清中MPO、LDH水平明显升高(P<0.01),炎症细胞因子TNF-α、IL-18水平也显著增高;且与模型组比较,NAC处理组MPO、LDH水平明显降低(P<0.01),炎症细胞因子TNF-α、IL-18也明显降低。对照组和NAC对照组间大鼠血清MPO、LDH、TNF-α、IL-18水平差异无统计学意义(见图2)。
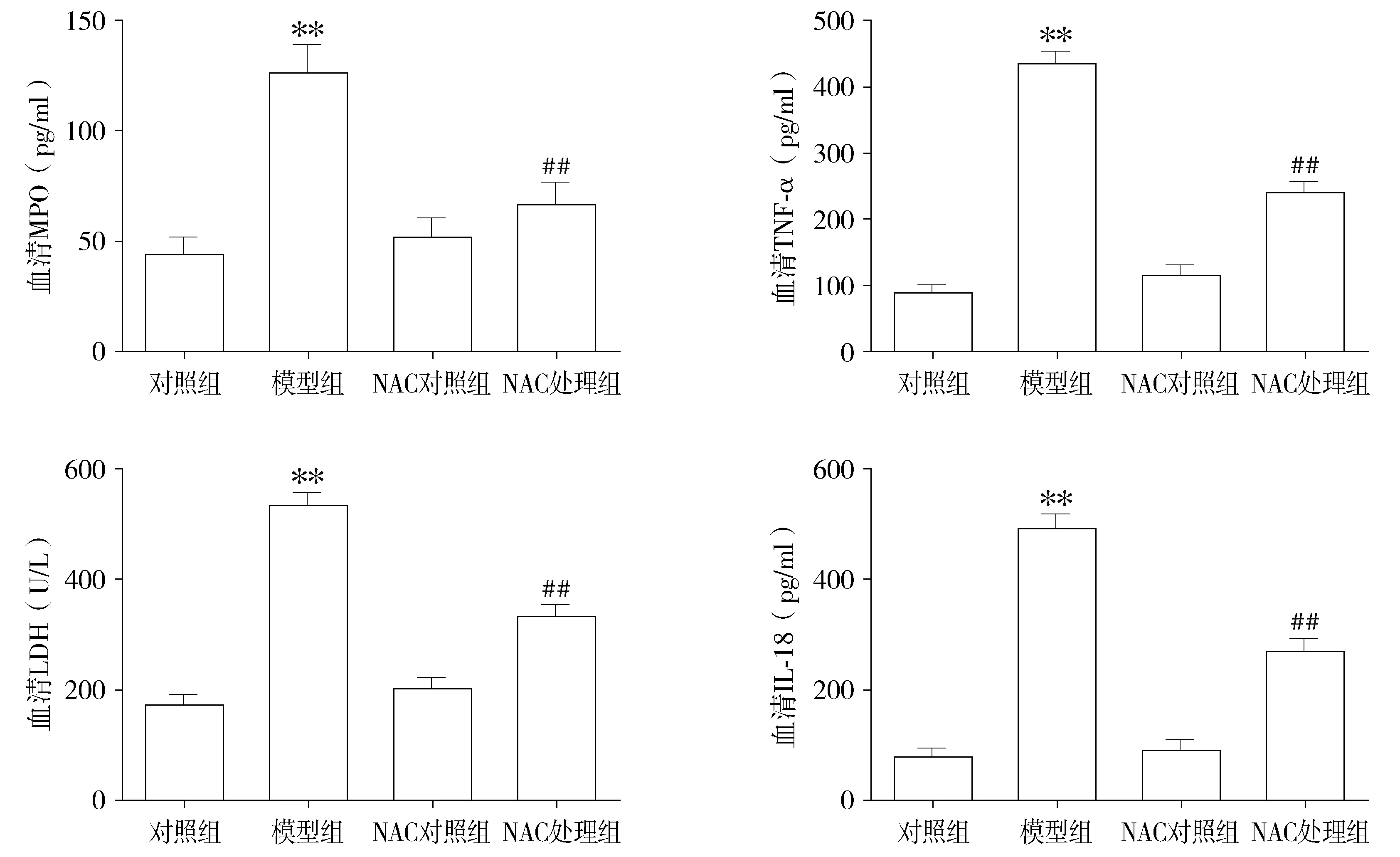
与对照组相比,**P<0.01;与模型组相比,##P<0.01图2 各组大鼠血清MPO、LDH、TNF-α、IL-18含量比较Figure 2 Comparison of serum MPO, TNF-α, LDH and IL-18 level among four groups
2.3 各组大鼠BALF中MPO、TNF-α、LDH、IL-18水平
与对照组比较,ALI模型组BALF中MPO、LDH水平显著升高(P<0.01),炎症因子TNF-α、IL-18水平也显著升高(P<0.01);且与模型组组比较,NAC处理组大鼠BALF中MPO、TNF-α、LDH、IL-18水平明显降低(P<0.01)。对照组和NAC对照组两组大鼠BALF中MPO、TNF-α、LDH、IL-18平无明显差异,差异无统计学意义(见图3)。
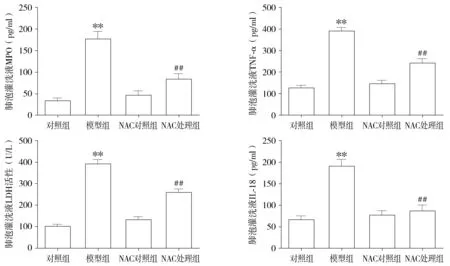
与对照组相比,**P<0.01;与模型组相比,##P<0.01图3 各组大鼠鼠BALF中MPO、TNF-α、LDH、IL-18含量比较Figure 3 Comparison of BALF MPO, TNF-α, LDH and IL-18 levels among four groups
2.4 各组大鼠肺组织中NLRP3、caspase-1、ASC和IL-1β表达水平
与对照组大鼠相比,ALI模型组大鼠肺组织中NLRP3、caspase-1、ASC和IL-1β蛋白表达水平显著增加(P<0.05);且与模型组相比,NAC处理组肺组织NLRP3、caspase-1、ASC和IL-1β蛋白表达水平显著下降。对照组和NAC对照组两组大鼠肺组织中NLRP3、caspase-1、ASC和IL-1β蛋白表达水平无明显差异,差异无统计学意义(见图4)。

与对照组相比,**P<0.01;与模型组相比,##P<0.01图4 各组组大鼠肺组织中NLRP3、caspase-1、ASC和IL-1β蛋白表达水平比较Figure 4 Comparison of NLRP3, caspase-1, ASC and IL-1β protein levels of lung tissue among four groups
3 讨论
临床上,多种因素如细菌感染、外伤、失血性休克、输血和吸入性肺炎等均可以引起ALI的发生。脂多糖是一种脂质和多糖的复合物,是内毒素和重要群特异性抗原(O抗原),其作为脓毒血症的重要介质,腹腔注射后可以通过血液循环可以引起白细胞迁徙活动增强,白细胞可以促进并释放趋化性细胞因子进入支气管肺泡灌洗液(BAL),中性粒细胞浸润和激活,组织炎症反应级联放大,从而介导急性肺损伤[8,9]。本实验采用腹腔注射LPS致大鼠急性肺损伤模型,结果显示,与正常组比较,LPS诱导急性肺损伤组大鼠肺组织腔内出现大量渗出物,大量水肿液形成,肺间质增宽,中性粒细胞浸润,肺W/d明显增加;并且肺泡灌洗液和血清中MPO、LDH活性显著升高;表明本实验中LPS诱导的大鼠急性肺损伤模型制备成功。
近年来研究表明,LPS可以触发TLR通路,从而诱导NF-κB等激活和炎性细胞因子的产生,TNF-α、IL-1β等炎性细胞因子的过度产生是LPS诱导ALI发生的重要因素[10,11],而减少炎性细胞因子的表达以及TLR4信号通路可以显著减轻ALI的严重程度[12]。本研究结果显示,与正常大鼠相比,LPS诱导急性肺损伤模型组大鼠肺泡灌洗液和血清中TNF-α和IL-18水平明显增高,与相关研究结果一致[13]。本研究结果还表明,与LPS诱导急性肺损伤模型组相比,NAC预处理组大鼠肺损伤程度明显减轻,肺W/D减少,肺泡灌洗液和血清中MPO、LDH水平降低,且TNF-α和IL-18水平显著下调。这表明,NAC作为ROS抑制剂,通过下调TNF-α和IL-18水平而减轻肺组织炎症反应,从而明显减轻LPS诱导的ALI。
NLRP3是Nod样家族受体,可以识别外源性和内源性刺激因子如ATP、细菌毒素、微晶体物质、脂质颗粒、细菌、病毒和死亡细胞的组分等而介导免疫炎症反应[14,15]。NLRP3炎性小体是由含有3的pyrin结构域炎性蛋白NLRP3、凋亡相关的斑点样蛋白(ASC)和前半胱氨酸天冬氨酸蛋白酶-1(pro-caspase-1)组成的多蛋白复合物,活化的NLRP3炎性小体可以通过诱导pro-caspase-1募集,激活IL-1β成熟并促进其释放,从而介导组织细胞级联炎症反应[16-18]。近年来研究表明,NLRP3在心脏、肾脏、肝脏缺血再灌注损伤,失血性休克诱发的ALI以及高血压引起的心脏重塑等多种疾病中扮演着重要作用。NLRP3炎性小体在肺组织中含量非常丰富。研究表明,活化的NLRP3炎性体介导细胞因子pro-IL-1β和pro-IL-18前体的成熟并释放活性形式IL-1β、IL-18,这些生物活性细胞因子在ALI炎症过程的发生发展中起关键作用[19,20]。Tözsér等[21]研究证明LPS诱导ALI小鼠肺组织中NLRP3炎症小体活性明显增加,IL-1β和IL-18水平增加。本实验结果显示,与对照组相比,LPS诱导ALI模型组大鼠肺组织损伤严重,并且肺组织中NLRP3、caspase-1、ASC蛋白表达水平显著增高。因此,表明NLRP3炎性体在LPS诱导的ALI中活性增高,活化的NLRP3炎性体介导下游IL-1β等炎性因子和细胞因子释放,从而激活肺组织炎症反应而参与ALI。
近年来研究证实,活性氧ROS是NLRP3炎性小体的上游因子[22],ROS可以直接或者间接激活NLRP3炎性体,抑制ROS产生可以明显抑制NLRP3炎性体的活化[23]。Li等[24]研究也表明,过度和/或持续的Ca2+流入可能引起线粒体钙超载,导致线粒体损伤和高水平的ROS产生,抑制Ca2+动员可以减少mtROS产生并减少活化的NLRP3炎性小体。在肺组织损伤中的研究表明,不同刺激物的信号参与离子平衡、溶酶体失调和线粒体损伤途径,导致组织蛋白酶的释放和ROS的产生,ROS可以加重肺损伤[25]。NAC可以抑制活性氧(ROS)的产生,通过调节氧化还原反应从而调控细胞炎症反应[26]。Choi等[27]研究表明,NAC可以抑制LPS诱导的ALI,具体机制尚未完全明确。本研究中,在LPS注射前30 min经腹腔注射NAC进行预处理,结果表明,NAC预处理组大鼠肺组织损伤明显减轻,肺泡灌洗液和血清中MPO、LDH、TNF-α和IL-18水平下降,且肺组织NLRP3、caspase-1、ASC、IL-1β水平明显下调。本研究结果表明,NAC作为ROS抑制剂,可以抑制NLRP3炎性体激活,从而抑制下游IL-1β等炎性因子的成熟和释放,减轻肺组织炎症反应和损伤,从而介导ALI的保护作用。
综上所述,本实验表明NAC预处理可以减少LPS诱导的ALI,其作用机制可能是通过抑制NLRP3炎性体激活从而减轻其介导的炎症反应,这可以为临床预防和治疗ALI提供新方向和靶点。

