光谱法研究DDAB与人免疫球蛋白G的结合作用
刘 丹,靳 宁,杨 婷,奥瑞芳,乔 华
(1山西医科大学基础医学院生物化学与分子生物学教研室,太原 030001;2出生缺陷与细胞再生山西省重点实验室;3山西医科大学基础医学实验教学中心;*通讯作者,E-mail:danliu007@126.com)
双十二烷基二甲基溴化铵(didodecyldimethylammonium bromide,DDAB)是第一个被合成的,具有两条饱和氢链的阳离子表面活性剂[1,2],可以自发形成水分散相和固态支持相以模拟生物膜结构[3-5],常被用于阳离子脂质体传递工具以改善药物的传递效能[6-9],然而单独使用DDAB常会使DNA变性、多种细胞凋亡,对机体存在潜在的毒副作用[10,11]。
载药脂质体在到达靶器官发挥作用之前,会和血液中蛋白质发生作用。免疫球蛋白是血液中含量最丰富的免疫蛋白,参与外源性物质在体内的运送、分布、代谢及消除等过程,是一种重要的潜在药物运输蛋白,对研究药物循环和药物对人体的影响有重要意义[12]。
本研究以免疫球蛋白G(immunoglobulin G,IgG)为研究对象,采用荧光猝灭法研究DDAB与IgG的结合作用,计算出结合反应的结合常数、结合位点数、结合热力学参数,并用同步荧光光谱、圆二色谱考察了IgG在DDAB作用下构象的变化,为阐明DDAB在阳离子脂质体中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
DDAB(分析纯,上海阿拉丁生化科技股份有限公司),用蒸馏水配制1.0×10-4mol/L储备液,常温保存;IgG(购自SIGMA-ALDRICH),用pH=7.40磷酸盐缓冲溶液(简称PBS溶液)配制1.5×10-5mol/L储备液,保存于4 ℃冰箱中备用;其他试剂均为分析纯;实验用水为Milli-Q超纯水。
1.2 仪器设备
Cary Eclipse荧光光谱仪(美国Varian公司);UV 2550紫外分光光度计(日本Shimadzu公司);MOS 500圆二色光谱仪(法国Bio-Logic公司);pHS-3C型酸度计(上海雷磁仪器厂);Milli-Q Academic A10(美国Milli-Q公司)。
1.3 实验方法
1.3.1 溶液配制
1.3.1.1 储备液配制 IgG储备液配制:用pH=7.40磷酸盐缓冲溶液(简称PBS溶液)配制1.5×10-5mol/L IgG储备液,保存于4 ℃冰箱中备用。
DDAB储备液配制:用蒸馏水配制1.0×10-4mol/L储备液,常温保存。
1.3.1.2 DDAB-IgG混合液配制 在10 ml比色管中,依次加入1.0 ml IgG储备液及不同体积DDAB储备液,再加入适量PBS溶液,配制成DDAB浓度梯度为0,2.0,4.0,6.0,8.0,10.0,12.0,14.0,16.0,20.0 μmol/L的DDAB-IgG混合液。
1.3.2 光谱测定
1.3.2.1 紫外光谱 在恒温25 ℃仪器室中,Shimadzu UV 2550紫外分光光度计记录200-300 nm范围内298.15 K时各样品的紫外吸收光谱,其中石英比色皿厚度为1.0 cm。
1.3.2.2 荧光光谱 Cary Eclipse荧光光谱仪的光源为氙弧灯,激发和发射狭缝宽度为5 nm,在预先设定的温度下,利用荧光光谱仪“Prescan”功能选择待测溶液的最佳激发光波长,以IgG的最佳激发光波长280 nm为激发光源,记录300-400 nm波长范围荧光发射光谱,荧光比色皿厚度为1.0 cm。
1.3.2.3 同步荧光光谱 同步荧光光谱测定条件:激发光和发射光波长差(Δλ)分别固定在Δλ=15 nm和Δλ=60 nm,其他条件同1.3.2.2。
1.3.2.4 圆二色谱 室温下,利用MOS 500圆二色光谱仪测定各样品在200-250 nm波长范围的圆二色谱,比色皿厚度为1.0 cm,扫描速度60 nm/min。
2 结果
2.1 紫外吸收光谱
图1A反映DDAB对IgG紫外吸收光谱的影响,如图所示,IgG的紫外吸收光谱中有两个吸收峰,220 nm附近的强吸收峰是蛋白质中肽键结构的典型特征吸收峰,由肽键中的-C=O的π→π*跃迁引起[13],吸收峰的摩尔吸收系数较大;270-283 nm范围(280 nm附近)出现的弱吸收峰是色氨酸、酪氨酸等残基的特征吸收峰,因此,可利用弱吸收峰的变化来反映IgG中氨基酸环境的变化。DDAB在200-300 nm范围内无特征吸收峰。当DDAB与IgG的浓度比在1 ∶1到20 ∶1范围时,IgG 220 nm处强吸收峰峰值下降,出现减色效应,表明二者混合时DDAB对IgG的结构产生影响。图1B反映不同浓度的DDAB对IgG紫外吸收光谱的影响趋势,如图所示,根据280 nm吸收峰摩尔吸收系数较小且由280 nm蓝移到278 nm的特点,判断弱吸收为n→π*跃迁产生。
2.2 DDAB对IgG的猝灭机制研究
2.2.1 DDAB与IgG作用的荧光猝灭光谱 DDAB与IgG作用的荧光光谱图见图2。
由图2可以看出,随着DDAB的浓度增大,IgG的荧光强度逐渐降低,荧光峰发生弱的红移,由333 nm红移到335 nm,说明DDAB会引起IgG的荧光猝灭。其原因是IgG分子的多肽链发生一定程度的伸展,包埋在蛋白分子内部的疏水性氨基酸残基暴露出来,使得荧光基团的疏水性降低,氨基酸残基的微环境极性增大,暗示着IgG的构象发生改变,这与圆二色谱实验相符。
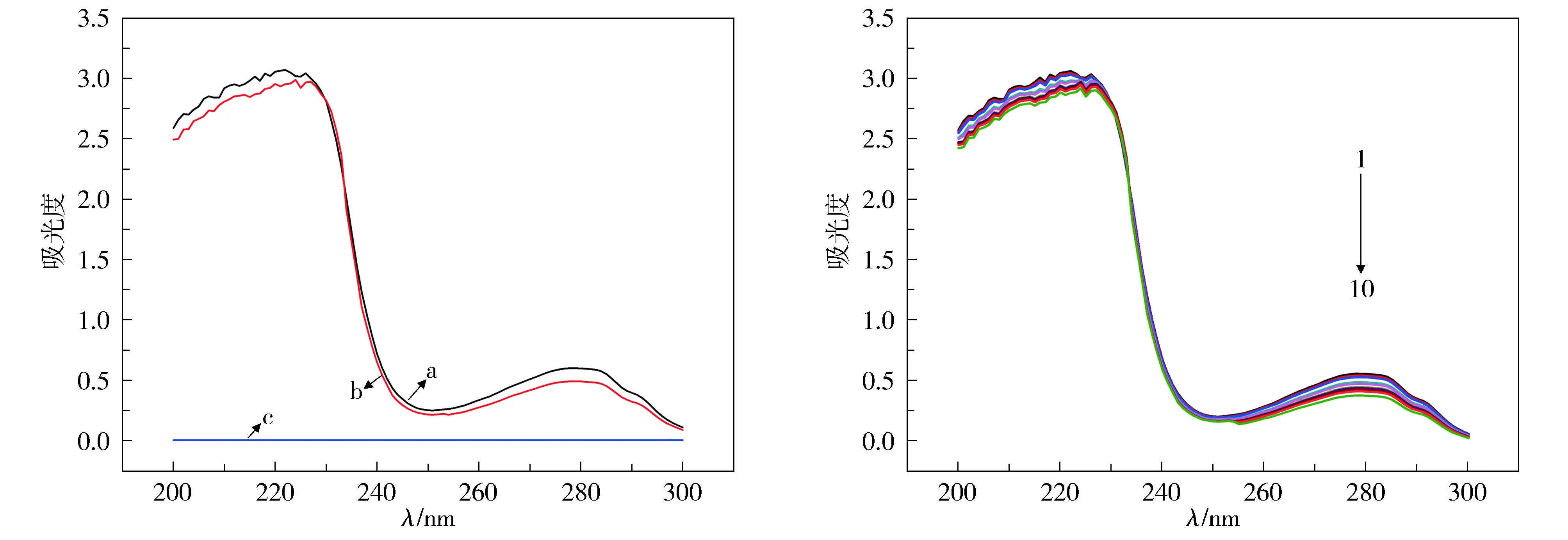
a: IgG浓度为1.5 μmol/L; b: IgG浓度为1.5 μmol/L,DDAB浓度为10 μmol/L; c: DDAB浓度为10 μmol/LA.DDAB与IgG相互作用的紫外吸收光谱曲线1-10: IgG浓度为1.5 μmol/L, DDAB浓度分别为0, 2.0, 4.0,6.0, 8.0, 10.0, 12.0, 14.0, 16.0, 20.0 μmol/L; T=298.15 KB.不同浓度DDAB对IgG紫外吸收光谱的影响趋势图1 DDAB与IgG相互作用的紫外吸收光谱图Figure 1 UV spectrum of IgG upon addition of DDAB
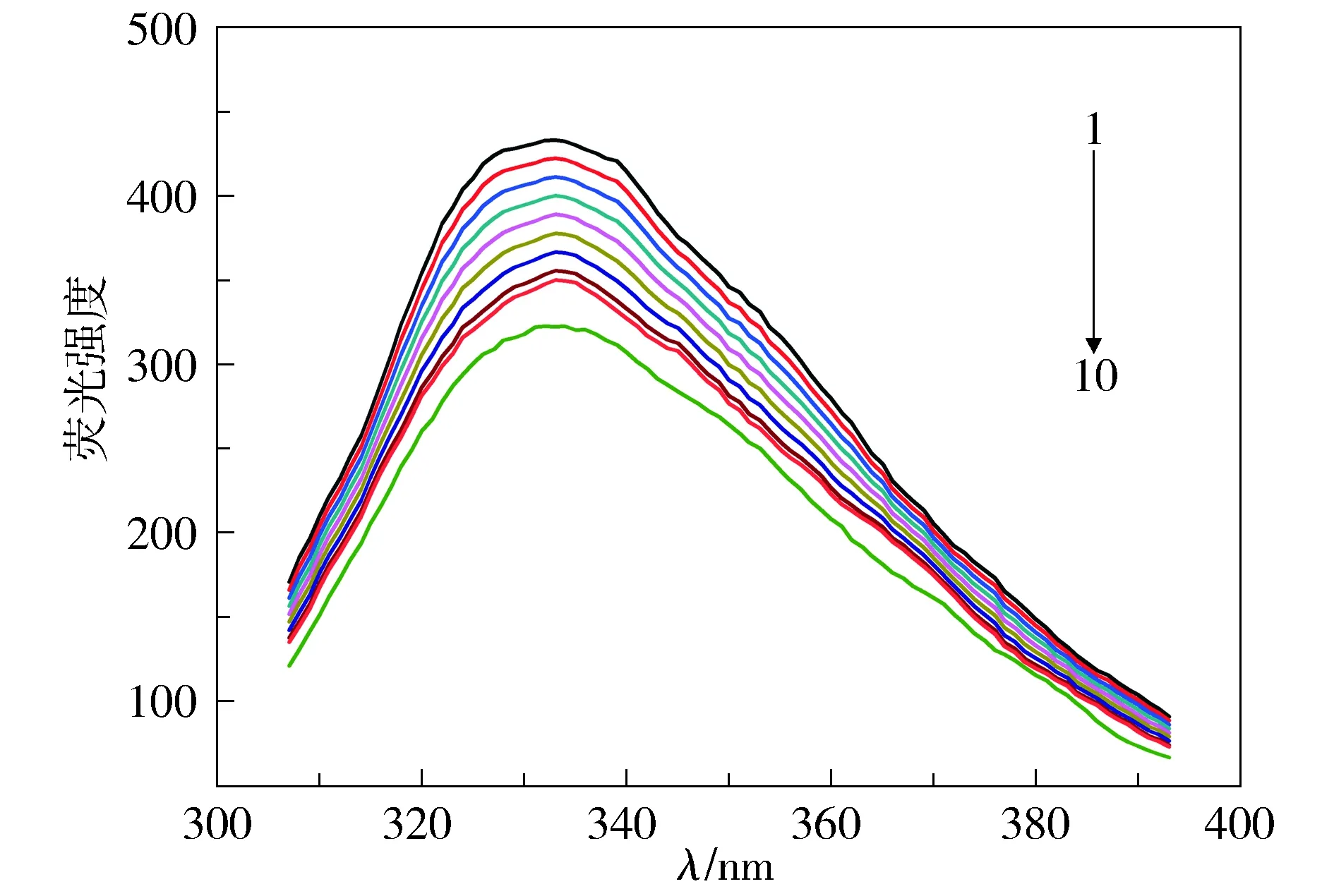
IgG浓度为1.5 μmol/L;曲线1-10:DDAB浓度分别为0, 2.0, 4.0, 6.0, 8.0, 10.0, 12.0, 14.0, 16.0, 20.0 μmol/L; T=298.15 K图2 DDAB对IgG荧光光谱的影响Figure 2 Effect of DDAB on fluorescence spectra of IgG
2.2.2 DDAB对IgG的荧光猝灭机制 为了进一步阐明DDAB对IgG的荧光猝灭机理,用Stern-Volmer方程(1)[14]对测定数据进行分析:
(1)
式中,F0和F分别是未加入和加入DDAB时IgG的荧光强度;KSV为动态猝灭常数;[Q]为DDAB的浓度;Kq为双分子猝灭速率常数;τ0为猝灭体不存在时荧光分子平均寿命。
作出F0/F-[Q]关系图并计算出不同温度下的动态猝灭常数,结果见图3和表1。
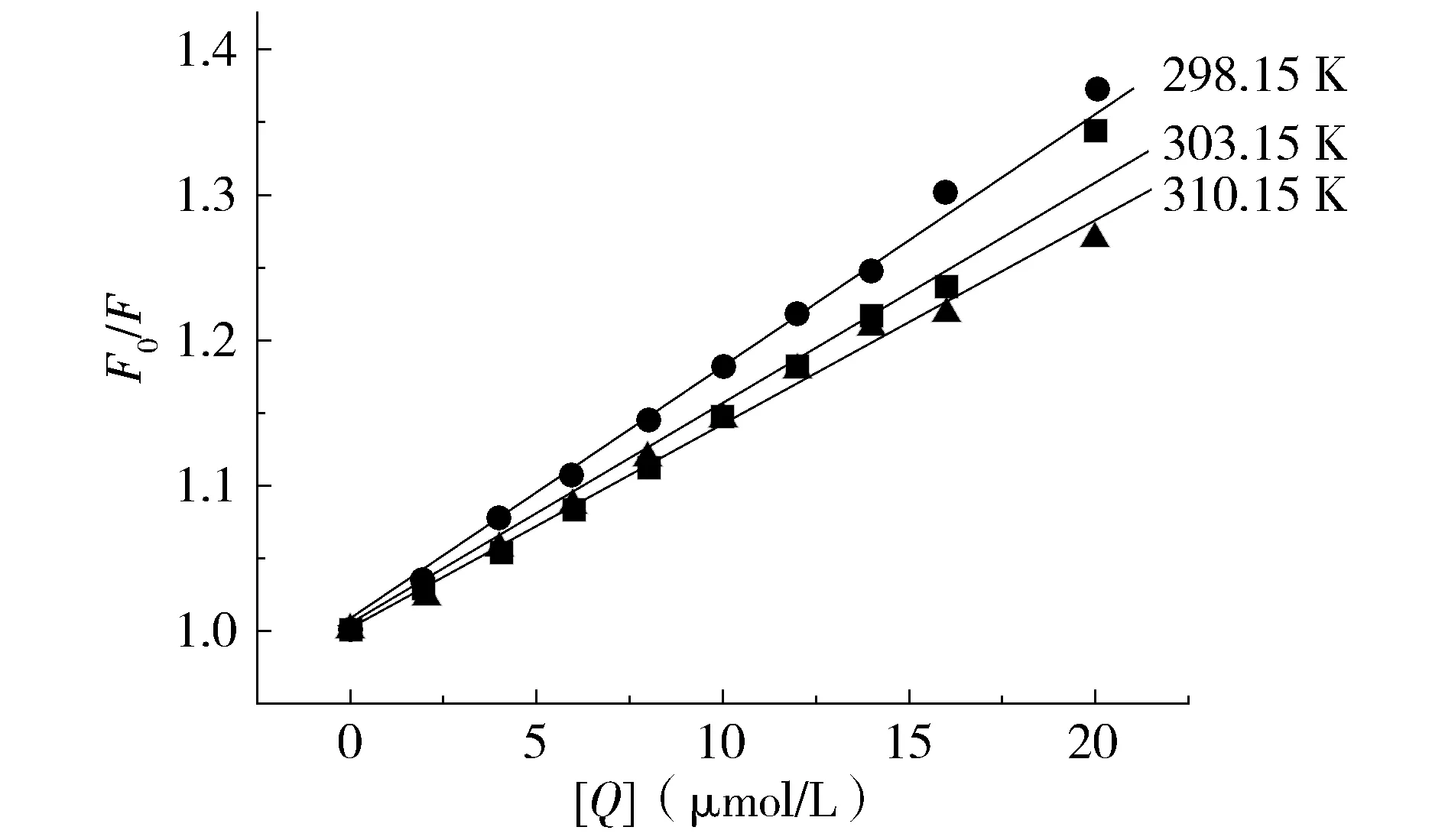
图3 DDAB与IgG作用的Stern-Volmer图Figure 3 Stern-Volmer plots of the interaction between DDAB and IgG
表1结果显示,猝灭常数随着温度的升高而减小,表明猝灭机制为静态猝灭过程。
为验证猝灭类型,依据方程(1)计算出Kq值(见表1)。由于生物大分子荧光寿命约为10-8s,298.15 K时,Kq计算值为1.86×1012L/(mol·s)。而各类猝灭剂与生物分子的最大碰撞猝灭速率常数为2.0×1010L/(mol·s),表明DDAB对IgG的猝灭过程常数大于扩散控制的速率常数。所以DDAB对IgG的猝灭属静态猝灭,即DDAB与IgG在基态时形成了复合物,引起IgG构象发生改变。
2.2.3 结合常数和结合位点数 静态猝灭的结合常数Ka由修正的Stern-Volmer方程(2)计算而得:
(2)
表1不同温度下DDAB与IgG作用的猝灭常数KSV
Table1QuenchingconstantsfortheinteractionofDDABwithIgGatdifferenttemperatures

温度(K)Stern-Volmer方程动态猝灭常数KSV/(L/mol)相关系数r双分子猝灭速率常数Kq[L/(mol·s)]298.15F0/F=1.86×104[Q]+0.99711.86×1040.99881.86×1012303.15F0/F=1.70×104[Q]+0.98191.70×1040.99431.70×1012310.15F0/F=1.38×104[Q]+1.00451.38×1040.99521.38×1012
式中,F0和F分别是未加入和加入DDAB时IgG的荧光强度;Ka为结合常数;n为结合位点数;[Q]为DDAB的浓度。计算结果见表2。
表2不同温度下DDAB与IgG作用的的结合常数Ka和结合位点数n
Table2Bindingconstants(Ka)andsitenumbers(n)fortheinteractionofDDABwithIgGatdifferenttemperatures

温度/K修正的Stern-Volmer方程结合常数Ka(L/mol)结合位点数n相关系数r298.15lg[(F0-F)/F]=4.67+1.09lg[Q]4.67×1041.090.9995303.15lg[(F0-F)/F]=4.46+1.06lg[Q]2.88×1041.060.9989310.15lg[(F0-F)/F]=4.27+1.00lg[Q]1.86×1041.000.9958
表2结果表明,Ka随温度升高而减小,说明温度升高时DDAB与IgG结合能力减弱,进一步证明DDAB对IgG荧光猝灭过程为静态猝灭过程。同时,由表2可知n都在1附近,说明DDAB与IgG结合时是1 ∶1结合;但随温度升高,n减小,说明温度升高,DDAB与IgG结合程度减弱,与Ka结果相符。
2.2.4 DDAB与IgG的结合作用力研究 为了考察DDAB与IgG的结合作用力,可以通过计算结合的热力学常数进行预测。在温度变化不大时,可以近似认为反应的焓变(ΔH)为常数,根据热力学参数间的关系式(3)-式(5)[15]:
(3)
ΔG=-RTlnKa
(4)

(5)
分别计算得到ΔH,熵变(ΔS)和吉布斯自由能变(ΔG)。式中:Ka为结合常数;R为气体摩尔常数;ΔH、ΔS及ΔG计算结果见表3。
表3不同温度下DDAB与IgG作用的热力学参数
Table3ThermodynamicparametersfortheinteractionofDDABwithIgGatdifferenttemperatures

温度(K)ΔH(kJ/mol)ΔS[J/(mol·K)]ΔG(kJ/mol)298.15-59.780-161.68-11.576303.15-160.07-11.255310.15-157.23-11.015
依据Ross与Subramanian判断小分子与生物大分子作用力类型的规律[16],可知,DDAB与IgG结合时氢键和范德华力起主要作用。
2.3 DDAB对IgG构象的影响
2.3.1 同步荧光光谱 同步荧光光谱因具有简化光谱、窄化谱带和减小光谱重叠等优点而常用来探讨蛋白质构象的变化。Δλ为15 nm和60 nm时所得同步荧光光谱分别表示蛋白质酪氨酸残基和色氨酸残基的光谱特征,这两种氨基酸的最大发射波长与其所处的微环境的极性有关,若其所处环境的疏水性逐渐降低,则最大发射波长会发生红移,反之,则发生蓝移。因此,根据最大发射波长的改变可以判断蛋白质构象的变化。实验结果见图4。
图4显示,IgG的同步荧光峰随DDAB浓度的增加而降低。其中,酪氨酸残基荧光发射峰由291 nm红移到293 nm,色氨酸残基发射峰由276 nm红移至278 nm,说明两种氨基酸残基周围的疏水性都降低,其原因是DDAB的加入使得IgG构象发生改变。
2.3.2 圆二色谱 DDAB与IgG作用的圆二色谱见图5。IgG在206 nm有1个正峰,在217 nm有1个负槽,这是典型β-折叠结构的特征表现。当加入DDAB时,IgG的CD值有所减小,预示着IgG的肽链发生一定程度伸展,这与2.1.1荧光猝灭实验一致;但并未靠近0线,且峰的形状和位置基本不变,说明在研究浓度范围内DDAB对IgG β-折叠结构影响不大。
3 讨论
脂质体是一种多功能药物载体,能使药物具有靶向性,降低药物不良反应,提高生物利用度,提高和延长疗效,避免耐药性和改变给药途径等。阳离子脂质体由一个荷正电的两性化合物(即阳离子脂质)及中性脂质组成,是最具潜力的病毒载体替代品,在基因递送中前景广阔。新型阳离子类脂分子不断涌现,研究其血液安全性,将为增加阳离子脂质体种类提供一定理论依据[17,18]。
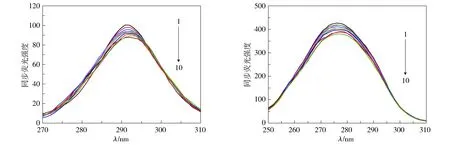
A. Δλ=15nm, 酪氨酸残基同步荧光光谱 B. Δλ=60 nm, 色氨酸残基同步荧光光谱IgG浓度1.5 μmol/L;曲线1-10: DDAB浓度分别为0, 2.0, 4.0, 6.0, 8.0, 10.0, 12.0, 14.0, 16.0, 20.0 μmol/L;T=298.15 K图4 DDAB与IgG相互作用的同步荧光光谱图Figure 4 Synchronous fluorescence spectra of IgG upon addition of DDAB

IgG浓度1.5 μmol/L;曲线1-5:DDAB浓度分别为0, 4.0, 8.0, 12.0, 20.0 μmol/L;T=298.15 K图5 DDAB对IgG圆二色谱的影响Figure 5 Effect of DDAB on circular dichroism spectra of IgG
血液组成复杂,其中血浆蛋白含量丰富,对血液功能的发挥起着不可忽视的作用。免疫球蛋白是血液中含量最丰富的免疫蛋白,参与外源性物质在体内的运送、分布、代谢及消除等过程,研究DDAB与IgG的相互作用,可以从分子水平评价阳离子类脂质分子的血液安全性,为阳离子脂质体的成功构建提供指导。
蛋白质的紫外吸收,主要来源于肽键对光的强烈吸收,此外组成氨基酸的侧链基团(如Trp的吲哚基,Tyr的酚基)对光也有吸收。小分子化合物与蛋白质结合前后吸收光谱的差异,说明蛋白质的构象发生了变化,也可借此来推断小分子化合物对蛋白荧光的猝灭机制[13]。IgG分子中的色氨酸和酪氨酸残基是产生荧光的主要基团[19],可采用两种氨基酸残基的荧光猝灭来表征外源性小分子化合物与IgG的结合作用。同步荧光光谱能够提供蛋白分子中酪氨酸残基和色氨酸残基的特征信息,圆二色光谱是评价蛋白质构象的一种简单而有效的方法[20],因此可以利用两种光谱对蛋白的构象变化进行考察。
本工作采用多光谱联用技术,考察了DDAB与IgG之间的结合作用。DDAB使IgG的紫外吸收光谱发生减色效应,表明DDAB与IgG形成了复合物,引起IgG的构象发生变化。从DDAB对IgG荧光光谱的影响,可以推测DDAB对IgG的荧光猝灭过程是形成复合物的静态猝灭,在形成DDAB-IgG复合物时,使IgG分子的多肽链发生一定程度的伸展,氨基酸残基的微环境极性增大。热力学计算结果表明,DDAB与IgG结合时ΔG<0,表明结合过程是自发进行的,而ΔH和ΔS均小于零说明DDAB与IgG之间通过氢键和范德华力产生了较强的结合作用[21]。DDAB与IgG的结合常数在104数量级,小于一般小分子化合物与血清白蛋白的结合常数[22],说明DDAB对IgG的β-折叠构象影响较小,这与同步荧光和圆二色实验结果完全相符,预示其可以作为阳离子脂质体的组成成分。

